致倦库蚊天蚕素CecB2基因的原核表达及蛋白纯化
2016-12-09王吉平张春林赵文静翟素珍
王吉平,张 堤,张春林,赵文静,张 晶,翟素珍
(贵州医科大学生物学教研室,贵州贵阳 550025)
致倦库蚊天蚕素CecB2基因的原核表达及蛋白纯化
王吉平,张 堤,张春林*,赵文静,张 晶,翟素珍
(贵州医科大学生物学教研室,贵州贵阳 550025)
构建致倦库蚊(贵阳株)天蚕素B2(CecB2)基因原核表达载体,并原核表达获得重组蛋白。定向克隆CecB2成熟肽序列至原核表达载体pET32a(+)上,将成功构建的pET32a-CecB2重组表达质粒转化大肠埃希菌Rosetta中经IPTG诱导表达,对IPTG诱导浓度和诱导时间优化后表达所得目的蛋白采用镍离子亲和层析纯化,SDS-PAGE和Western blot检测鉴定表达蛋白。结果表明,成功构建原核表达载体pET32a-CecB2,IPTG浓度和时间优化结果为IPTG浓度为0.05 mmol/L,诱导时间为3 h。SDS-PAGE检测获得大小约25 ku的可溶性纯化蛋白,Western blot鉴定纯化蛋白可与鼠抗His-tag单克隆抗体发生抗原抗体结合反应。说明所构建原核表达载体pET32a-CecB2能在大肠埃希菌中可溶表达,为进一步研究其生物学功能奠定了基础。
致倦库蚊;天蚕素基因;原核表达;蛋白纯化
天蚕素抗菌肽是一种阳离子抗菌肽,由Boman等瑞典科学家最早于20世纪70年代至80年代从惜古比天蚕(Hyalophoracecropia)蛹中发现[1],是一种广谱杀菌、具有潜在开发应用价值的抗菌肽,不仅在抗细菌、真菌、寄生虫和原虫、病毒及肿瘤方面表现出不同程度的抗性,在天然免疫中还具有调节免疫,促进中性粒细胞、T细胞的化学趋化和促进伤口愈合等作用[2]。天蚕素抗菌肽由31~39个氨基酸组成,分子质量大小为3.5 ku~4 ku,分子结构特点为N端双亲性α-螺旋,C端疏水性α-螺旋,属于α-螺旋类抗菌肽,该肽发挥抗菌作用与这种独特的结构密切相关[3]。有别于传统抗生素,天蚕素通过在细菌质膜上形成小孔,导致细胞内容物外流致使细菌死亡,从而不易产生耐药性[4];另外,天蚕素虽具有较强的抗菌活性和较广的抑菌谱,但对真核细胞低毒性[5]。
已报道的天蚕素(Cecropins)主要有A、B、C、D、E、F等类型及类似物Factor G和Cecropin Ps。其中,Cec B是多种类型中抗菌活性最强的,已应用于多个研究领域。邹修平等[6]将人工合成的两个含有信号肽的Cec B基因转化塔罗科血橙(CitrussinensisOsbeck)上胚轴,获得转基因植株,提高了血橙抗溃疡病水平; Wu C等[7]临床研究发现天蚕素Cec B 能够选择性的识别细胞毒素和抗恶性细胞增生,可抑制人肝癌细胞HepG-2增殖。目前,在草地贪夜蛾(Spodopterafrugiperda)、家蚕(Bombyxmori)、家蝇(Muscadomestica)、斜纹夜蛾(Spodopteralitura)、小菜蛾(Plutellaxyllostella)、烟草天蛾(Maducasexta)等昆虫中已发现多种天蚕素家族抗菌肽及其类似物[8],在多种物种中已开始功能研究。而对于致倦库蚊天蚕素的研究仅见零星报道[9-10]。本文利用分子生物学手段,对致倦库蚊CecB2基因进行体外表达研究,为进一步研究其生物学功能提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂及耗材 DNA标准DL 2 000、限制性内切酶BamHⅠ和HindⅢ、T4 DNA连接酶为宝生物工程(大连)有限公司产品;2×TaqPCR Star Mix、蛋白分子质量标准、DNA回收试剂盒和质粒小提试剂盒购自北京康润生物科技有限公司;异丙基硫代-β-D-半乳糖苷(isopropylthjo-β-D-galactoside,IPTG)、氨苄青霉素、氯霉素为北京索莱宝科技有限公司产品;一抗抗体Anti-His Antibody小鼠抗单克隆抗体购于天根生物科技有限公司;辣根过氧化物酶(HRP)山羊抗兔IgG(二抗)为武汉博士德公司产品;其他化学试剂为国产分析纯;引物合成及质粒测序由上海生工生物工程股份有限公司完成。
1.1.2 试验材料 致倦库蚊(贵阳株)由贵州医科大学生物学教研室长期饲养繁殖;pET32a(+)原核表达载体及大肠埃希菌(E.coli)Rosetta、宿主菌DH5α由贵州医科大学生物学教研室保存。
1.2 方法
1.2.1 引物设计与合成 根据GenBank上公布的致倦库蚊天蚕素基因CecB2序列( Accession :XM-001861707.1),用软件SignalP4.1预测其信号肽位置并应用Primer Premier 5.0软件设计引物,扩增CecB2成熟肽的上下游引物分别引入BamHⅠ和HindⅢ酶切位点(下划线部分),并命名为CxCec-F和CxCec-R。CxCec-F:5′-CGGGATCCGGTGGTCTCAAAAAGT-3′,下划线部分为BamHⅠ酶切位点,CxCec-R:5′-CCCAAGCTTTTTTG GTCCAA GTGCAT-3′,下划线部分为HindⅢ酶切位点。
1.2.2 PCR扩增CecB2成熟肽基因 以课题组前期所得pMD-CecB2阳性克隆菌液为模板PCR扩增CecB2成熟肽序列。扩增体系为20 μL,包括2×TaqPCR Star Mix 10 μL,模板菌液1 μL,上、下游引物各1 μL,灭菌水补足20 μL。扩增条件:94℃ 2 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。20 g/L琼脂糖凝胶电泳检测扩增产物。
1.2.3 阳性克隆筛选及鉴定 pET32a(+)经BamHⅠ和HindⅢ双酶切后进行质粒DNA切胶回收,同样双酶切1.2.2中所得DNA回收产物。用T4 DNA连接酶将回收质粒DNA与酶切CecB2基因片段按1∶3浓度比16℃连接过夜,转化DH5α感受态细胞,交叉PCR验证初步筛选阳性克隆并抽提重组质粒,重组质粒经BamHⅠ和HindⅢ双酶切鉴定后将阳性克隆菌液送上海生工生物工程股份有限公司测序。测序结果经序列比对正确后命名为pET32a-CecB2。
1.2.4 诱导表达条件时间和浓度的优化 将鉴定的菌液按1∶50转接含有氨苄青霉素(Amp)和氯霉素(Cam)抗性的LB液体培养基中,37℃培养过夜。次日以同上比例将过夜培养的菌液转接至新的含同上抗性的培养基中培养,37℃,200 r/min 培养至OD600nm为 0.5左右。取8个培养管加入终浓度分别为0、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG,37 ℃ 200 r/min诱导表达3 h,经15 g/L的SDS-PAGE电泳,考马斯亮蓝染色分析,确定最佳诱导浓度。再以确定的最佳诱导浓度分别诱导重组菌液0、1、2、3、4、5、6、7 h后取样,经15 g/L SDS-PAGE电泳,考马斯亮蓝染色分析,确定其最佳诱导浓度。
1.2.5 重组蛋白大量表达及可溶性检测 以优化的浓度和时间于37℃下对重组菌进行大量诱导表达。诱导结束后,离心收集菌体,菌体沉淀重悬于按His-镍蛋白纯化套装中配方配制的结合液(20 mmol/L Tris-HCl pH7.9,10 mmol/L 咪唑,0.5 mmol/L NaCl)中,反复冻融3次,在冰浴中超声碎菌(100 W,超声5 s,停6 s,重复80次)。4℃、12 000 r/min离心30 min,分离上清和沉淀。150 g/L SDS-PAGE电泳检测蛋白可溶性,再按照His-镍蛋白纯化套装说明进行上清纯化或沉淀变性后纯化。
1.2.6 纯化蛋白Western blot鉴定 将纯化后的CecB2蛋白进行2.5 mA/cm2电流半干转40 min转印至聚偏氟乙烯(PVDF)膜上,1×PBST配制的50 g/L脱脂奶粉室温封闭1 h,抗6×His-tag(一抗1∶1 000)室温孵育2 h,1×PBST洗膜3次,每次5 min,山羊抗鼠IgG(二抗:1∶10 000)室温孵育2 h,1×PBST洗膜3次,每次5 min,DAB显色试剂盒显色观察结果。
2 结果
2.1 CecB2成熟肽基因PCR结果
以pMD-CecB2阳性克隆菌液为模板,PCR扩增CecB2成熟肽基因后核酸电泳显示,在约120 bp位置有一条特异条带,大小与预期扩增长度相符(图1)。测序结果证实与GenBank上的致倦库蚊天蚕素基因去信号肽后的成熟肽基因序列一致。

M.DNA标准DL 2 000; B2.CecB2 基因成熟肽PCR产物
M.DNA Marker DL 2 000;B2.Mature peptide PCR products of CecB2 gene
图1 CecB2基因成熟肽基因PCR扩增结果
Fig.1 The mature peptide PCR results of CecB2 gene
2.2 pET32a-CecB2克隆菌的交叉PCR鉴定结果
用通用引物T7F/R与特异性引物CxCec-F及CxCec-R进行阳性克隆的交叉PCR验证。可见CxCec-F和T7R引物对所扩增出的产物片段约为250 bp,而T7F和CxCec-R引物对所扩增出的产物片段约为750 bp,这与预期大小一致(图2)。由此可知,所挑选克隆菌初步认定为阳性克隆,目标序列CecB2是以正确的方向插入pET32a载体中。

M.DNA标准DL 2 000;1.CxCec-R和T7F扩增产物;2.T7R和CxCec-F扩增产物
M.DNA Marker DL 2 000; 1.PCR products of CxCec-R and T7F; 2.PCR products of T7R and CxCec-F
图2 阳性克隆菌PCR鉴定
Fig.2 Identification of the positive clones by PCR
2.3 pET32a-CecB2质粒双酶切及测序鉴定结果
用BamHⅠ和HindⅢ双酶切pET32a-CecB2重组质粒,核酸电泳检测结果显示酶切后的pET32a-CecB2在约120 bp的位置出现了一条与PCR成熟肽扩增产物大小一致的条带,而在约6 000 bp得位置有一条大小与空质粒pET32a(+)双酶切后大小一致的条带(图3),综合结果2.2说明目的基因与载体连接成功。将测序结果与目的基因序列比对,结果完全一致,说明成功构建了重组表达载体pET32a-CecB2。
2.4 重组蛋白表达条件的优化
SDS-PAGE电泳显示(图4和图5),终浓度为0.05 mmol/L时目的蛋白的表达量较高,且浓度的增加并没有引起目的蛋白表达量的明显增加。以0.05 mmol/L IPTG浓度进行诱导表达时,1 h~4 h表达量较高,目的蛋白可能对宿主细胞产生了毒性作用或细胞内蛋白酶较敏感,致使5 h~7 h时蛋白出现了类似降解的现象。
2.5 重组蛋白大量表达及可溶性检测结果
IPTG浓度为0.05 mmol/L,表达时间为3 h,37℃大量诱导表达,离心所得菌体重悬后超声破碎并离心分离得到上清和沉淀,样品经SDS-PAGE电泳检测结果显示(图6),重组蛋白主要以可溶形式表达。His-镍蛋白纯化柱纯化获得大小约25 ku的融合蛋白,与预期结果相符。

M1.DNA标准λ-HindⅢ;M2.DNA标准DL 2 000 ;1.质粒pET32a(+);2.经BamHⅠ和HindⅢ双酶切后的空质粒pET32a(+);3.重组质粒pET32a-CecB2;4.经BamHⅠ和HindⅢ双酶切后的重组质粒pET32a-CecB2;5.PCR产物
M1.DNA Marker λ-HindⅢ; M2.DNA Marker DL 2 000; 1.Products of pET32a(+) plasmid; 2.Products of pET32a(+) digested byBamHⅠ andHindⅢ; 3.The recombinant plasmid pET32a-CecB2; 4.Products of pET32a-CecB2 digested byBamHⅠ andHindⅢ; 5.PCR products
图3 pET32a-CecB2重组质粒的酶切鉴定
Fig.3 Identification of recombinant plasmid pET32a-CecB2 by enzyme digestion
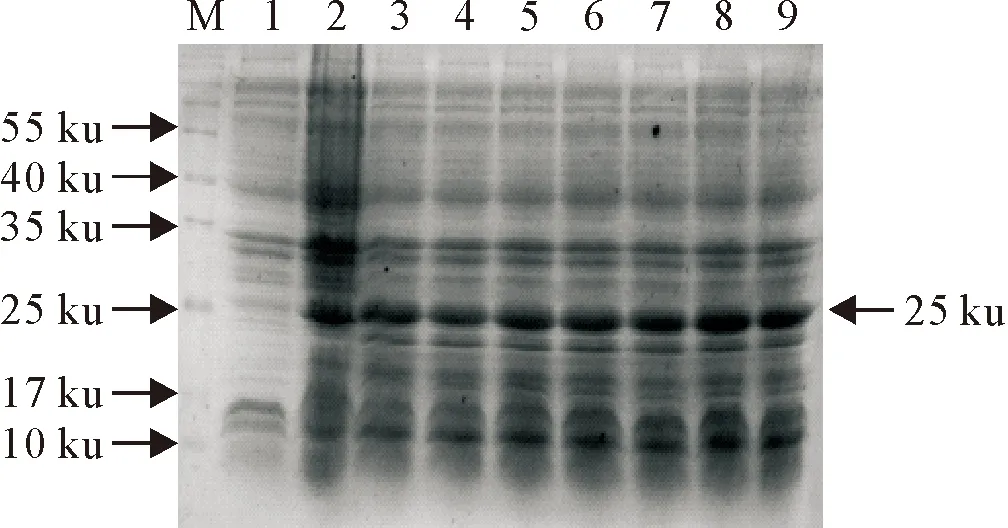
M.蛋白分子质量标准;1.pET32a-CecB2诱导前;2~9.0、0.05、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L IPTG浓度诱导重组菌
M.Protein molecular weight Marker;1.CecB2 expression before IPTG inducted; 2-9.Products of CecB2 inducted with 0,0.05,0.1,0.2,0.4,0.6,0.8,1.0 mmol/L IPTG,respectively
图4 不同IPTG浓度对重组蛋白表达量的影响
Fig.4 The effect of different IPTG concentrations on expression levels of recombinant proteins
2.6 Western blot鉴定纯化蛋白
以鼠抗His-tag单克隆抗体为一抗,辣根过氧化物酶山羊抗鼠IgG为二抗,Western blot免疫印记经DAB显色(图7)显示,免疫印迹反应呈阳性反应,在约25 ku处出现一条特异性条带,与预测的重组蛋白大小相符。
3 讨论
致倦库蚊(Culexquinquefasciatus)属于昆虫纲(Insecta)、双翅目(Diptera)、长角亚目(Nematocera)中的蚊科(Culicidae),是一类重要的医学昆虫。致倦库蚊呈世界性分布,其滋生环境复杂,携带多种病原体,能够抵御多种病原体侵袭,推测其具有强大的天然免疫防御系统。因此,对致倦库蚊先天免疫分子的深入研究有助于了解其在致倦库蚊体内的免疫防御机制。
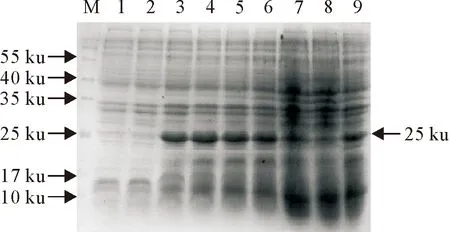
M.蛋白分子质量标准;1.pET32a-CecB2诱导前;2~9.0、1、2、3、4、5、6、7 h诱导的重组菌
M.Protein molecular weight Marker; 1.CecB2 expression before IPTG inducted;2-9.Products of CecB2 induction for 0,1,2,3,4,5,6,7 h respectively
图5 不同诱导时间对重组蛋白表达量的影响
Fig.5 The effect of different induction time on expression levels of recombinant proteins
M.蛋白分子质量标准;1.pET32a(+)诱导前;2.pET32a(+)诱导后;3.pET32a-CecB2诱导前;4.pET32a-CecB2诱导后;5.上清;6.沉淀;7.纯化蛋白
M.Protein molecular weight Marker;1.pET32a(+) vector expression before IPTG induction;2.pET32a(+) vector expression after IPTG induction;3.CecB2 expression before IPTG induction;4.CecB2 expression after IPTG induction;5.Supernatant;6.Precipitate;7.Purified proteins
图6 重组蛋白纯化
Fig.6 Purification of the recombinant protein
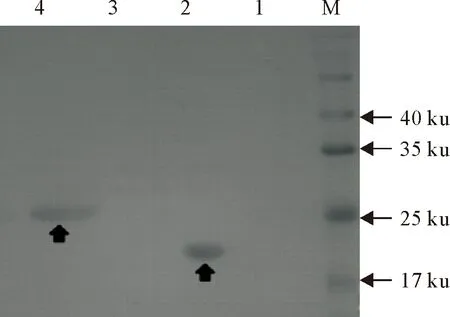
M.蛋白分子质量标准;1.pET32a(+)诱导前;2.pET32a(+)诱导后;3.pET32a-CecB2诱导前;4.纯化蛋白
M.Protein molecular weight Marker;1.pET32a(+) vector expression before IPTG induction;2.pET32a(+) vector expression after IPTG induction;3.CecB2 expression before IPTG induction;4.Purified proteins
图7 Western blot鉴定纯化蛋白
Fig.7 Identification of purified protein by Western blot
天蚕素抗菌肽作为昆虫免疫系统重要成分,是一种小分子多肽,体外表达时对宿主易产生毒性,若直接在表达宿主中进行表达,不仅产量不高,也容易受到宿主细胞蛋白酶的降解[11]。本试验采用融合表达的方式将CecB2基因成熟肽定向克隆到pET表达载体中实现原核表达。与真核表达系统和昆虫表达系统相比,大肠埃希菌具有繁殖力强、生产周期短、产量高且成本低等优点,所以常常作为基因工程表达的首选宿主[12]。pET原核表达载体是一种应用广泛的载体,可提供多个纯化标签如His标签,Trx标签和S标签,便于外源蛋白的分离纯化。本试验选用pET32a表达载体带有的6×组氨酸(His-Tag)序列作为融合表达标签,简化了蛋白纯化和免疫印迹鉴定[13]。
外源蛋白的表达受多种因素的影响,为得到高效表达的融合蛋白,研究者们通常会对表达条件进行优化。海力且木·艾力等[14]对光滑鳖甲抗菌肽原核表达条件优化发现低浓度短时间及低温低转速可增加可溶性蛋白表达量;Salimi A等[15]通过对血管内皮生长因子(VEGF)165在大肠埃希菌中表达时的诱导温度、诱导浓度等表达条件的优化,得到VEGF165可溶性最高表达的最佳条件。本试验对IPTG浓度和诱导时间进行优化,发现在低浓度0.05 mmol/L时重组蛋白就可高表达,且在此浓度条件下诱导1 h~4 h内重组蛋白表达量相近,而诱导5 h后目的蛋白出现了类似降解的现象,7 h时又表现出回缓的趋势,推测该融合蛋白可能会对宿主细胞产生毒性作用或与细胞内蛋白酶的敏感性特性有关。然而本试验这些结果只是对优化浓度条件下的时间优化结果,在更低浓度或低温条件下是否会有所改善将在下一步试验中继续验证。
本试验通过分子生物学手段成功构建了致倦库蚊CecB2基因成熟肽原核表达载体,可在原核表达系统中以可溶性形式表达,为下一步研究致倦库蚊天蚕素生物活性奠定理论基础。遇到的蛋白降解问题也暗示我们可在此基础上更进一步从温度、转速等方面优化表达条件以期获得更佳的高效表达条件。
[1] Hultmark D,Steiner H,Boman H G,et al.Insect immunity:Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalophoracecropia[J].Eur J Biochem,1980,106(1):7-16.
[2] Nhung D,Günther W,Lisa G,et al.Cationic membrane-active peptides-anticancer and antifungal activity as well as penetration into human skin[J].Exp Dermatol,2014,23(5):326-331.
[3] Godreuil S,Leban N,Padilla A,et al.Aedesin:structure and antimicrobial activity against multidrug resistant bacterial strains[J].PLoS One,2014,9(8):e105441.
[4] Eunjung L,Areum S,Yangmee K.Anti-inflammatory activities of cecropin A and its mechanism of action[J].Arch Insect Biochem Physiol,2015,88 (1):31-44.
[5] Akhilesh R,Sandra P,Marta B E.High-density antimicrobial peptide coating with broad activity and low cytotoxicity against human cells[J].Acta Biomat,2016,33:64-77.
[6] 邹修平,彭爱红,刘琦琦,等.分泌型 Cecropin B 抗菌肽基因转化血橙提高其抗溃疡病水平[J].园艺学报,2014,41(3):417-428.
[7] Wu C,Geng X,Wan S,et al.Cecropin-P17,an analog of Cecropin B,inhibits human hepatocellular carcinoma cell HepG-2 proliferation via regulation of ROS,Caspase,Bax,and Bcl-2[J].J Pept Sci,2015,21(8):661-668.
[8] Anchalee T,Kunlaya S,Piti A.Sequence diversity and evolution of antimicrobial peptides in invertebrates[J].Develop Comp Immunol,2015,48 :324-341.
[9] 康 哲,张春林,陈汉彬.致倦库蚊Cecropin基因克隆及序列分析[J].贵阳医学院学报,2008,6(33):643-646.
[10] 赵文静,张春林,王吉平,等.致倦库蚊Cecropin基因家族的比较和系统发育分析[J].基因组学与应用生物学,2016,35(2):294-301.
[11] Skosyrev V S, Kulesskiy E A, Yakhnin A V, et al.Expression of the recombinant antibacterial peptide sarcotoxin IA inEscherichacolicells[J].Protein Expr,2003,28(2):350-356.
[12] Rosano G L,Ceccarelli E.Recombinant protein expression inE.coli:Advances and challenges[J].Frontiers Microbiol,2014,5:1-17
[13] 磨健悦,孙宝丽,魏钟艳,等.猪流行性腹泻病毒COE基因的原核表达及其表达产物的生物活性分析[J].中国兽医科学,2015,45(5):503-508.
[14] 海力且木·艾力,徐 鑫,刘忠渊.光滑鳖甲抗菌肽的原核表达条件优化及其抗菌活性[J].昆虫学报,2016,59(1):8-15.
[15] Salimi A,Babashamsi M.Cloning and optimization of soluble vascular endothelial growth factor 165 expression inE.coli[J].Avicenna J Med Biotechnol,2016,8(1):23-28.
Prokaryotic Expression and Protein Purification of Cecropin CecB2 Gene ofCulexquinquefasciatus
WANG Ji-ping,ZHANG Di,ZHANG Chun-lin,ZHAO Wen-jing,ZHANG Jing,ZHAI Su-zhen
(DepartmentofBiology,GuiyangMedicalUniversity,Guiyang,Guizhou,550025,China)
To construct the prokaryotic expression vector of cecropin CecB2 gene ofCulexquinquefasciatusfor prokaryotic expression recombinant protein.The mature peptide of CecB2 was inserted into the multiple cloning sites of the expression vector pET32a to construct recombinant plasmid firstly,then transformed it intoE.coliRosetta for expression by IPTG induction.The expression conditions were optimized by investigating the effects of concentration of IPTG and induction time.SDS-PAGE and Western blot were used to detect and indentify the recombinant protein respectively.The results showed that prokaryotic expression vector pET32a-CecB2 was constructed successfully and optimum induction condition of fusion protein were as follows:IPTG concentration 0.05 mmol/L,induction time 3 h.The recombinant protein was about 25 ku and identified to react with monoclonal antibody 6×His tag by Western blot.This suggested that the recombinant plasmid was constructed successfully and can be expressed as a soluble fusion protein inE.coliRosetta.It laid the necessary theoretical basic for further study of biological funtions of cecropin ofCulexquinquefasciatusin future.
Culexquinquefasciatus; cecropin gene; prokaryotic expression; protein purification
2016-04-07
贵州省科技厅项目(黔科合LH字[2015]7363号)
王吉平(1989-),女,贵州遵义人,硕士研究生,主要从事医学昆虫分子生物学研究。*通讯作者
S859.799.9;S881.3
A
1007-5038(2016)11-0031-05
