藏羊IFN-γ基因的扩增、序列分析及蛋白结构预测
2016-12-09张晓芬冶贵生文熙萍祁秀清
张晓芬,冶贵生,文熙萍,祁秀清
(青海大学农牧学院,省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
藏羊IFN-γ基因的扩增、序列分析及蛋白结构预测
张晓芬,冶贵生*,文熙萍,祁秀清
(青海大学农牧学院,省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
为了研究藏羊IFN-γ基因的功能,提取藏羊脾脏总RNA,通过RT-PCR扩增藏羊IFN-γ基因并测序,应用DNA Star软件进行序列分析及编码蛋白结构预测。结果表明,藏羊IFN-γ基因长度为429 bp,其中腺嘌呤和胸腺嘧啶含量较高,该基因编码143个氨基酸,其中疏水性氨基酸和亲水性氨基酸的含量较高。藏羊IFN-γ基因与参考绵羊、山羊、藏羚羊和牛IFN-γ基因的核苷酸序列同源性依次为100%、99.3%、99.1%和97.2%,氨基酸序列同源性依次为100%、99.3%、99.3%和95.8%。IFN-γ蛋白主要由α螺旋组成,亲水性较高,含有5种蛋白质功能位点,分别为1个酪蛋白激酶Ⅱ磷酸化位点、1个酰胺化位点、2个N-糖基化位点、2个cAMP和cGMP依赖的蛋白激酶磷酸化位点和3个蛋白激酶C磷酸化位点。
藏羊;IFN-γ基因;反转录-聚合酶链反应;序列分析;蛋白结构预测
藏羊(Tibetan sheep)又称藏系绵羊,生活在青藏高原,青海境内主要分布于黄南、玉树、果洛、海北、海南和海西6个州,青海藏羊能够适应高海拔、高寒的生态环境,且抗病力很强[1]。干扰素(interferon,IFN)是一种由免疫细胞分泌的免疫调节因子,分为Ⅰ型和Ⅱ型两类。IFN-γ又称为免疫干扰素,是Ⅱ型干扰素的一种,较Ⅰ型干扰素具有较强的免疫活性,一方面能激活T淋巴细胞介导的细胞免疫,另一方面又能抑制B淋巴细胞介导的体液免疫,从而抑制Ⅰ型过敏反应[2-3],其最主要的免疫调节活性是通过提高MHC分子的表达来促进抗原提呈[4]。Mcinnes C J等[5]首次克隆出了绵羊IFN-γ基因,该基因编码166个氨基酸,其中23个氨基酸为信号肽序列。IFN-γ可以用来检测动物的细菌性或病毒性感染,Nagata R等[6]研究表明,可以通过测定IFN-γ的水平来早期诊断牛羊是否感染分支杆菌。另外,IFN-γ是一种新型的免疫佐剂,不仅能增强疫苗的免疫效果,而且还能增强机体对疾病的抵抗能力[7]。目前,还未见有关藏羊IFN-γ的研究报道,本研究通过RT-PCR扩增了藏羊IFN-γ基因,并应用DNA Star软件进行序列分析及蛋白结构预测,为青海藏羊IFN-γ基因功能的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 脾脏 青海高原型藏羊脾脏采自西宁市某屠宰场,液氮速冻,带回实验室后在-80℃冰箱中保存备用。
1.1.2 主要试剂 EASY Spin Plus组织/细胞RNA快速提取试剂盒购自北京艾德莱生物科技有限公司;Prime Script反转录试剂盒、ExTaqDNA聚合酶、琼脂糖、DNA Marker DL 2 000购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计与合成 根据NCBI登录的绵羊IFN-γ基因序列设计扩增引物,由宝生物工程(大连)有限公司合成,预期目的片段长度为429 bp。引物序列如下:IFN-γ-F:5′-GCACCCACTCGCCAACCC-3′,IFN-γ-R:5′-CTTCTGGACTGGTTCCCAGCAGTC-3′,合成的引物溶解后稀释成20 μmol/L的工作浓度。
1.2.2 总RNA的提取 按照EASY Spin Plus组织/细胞RNA快速提取试剂盒说明书提取藏羊脾脏中的总RNA。
1.2.3 RT-PCR 取藏羊脾脏总RNA 6 μL,下游引物2 μL,dNTP Mixture 2 μL,65℃预热5 min,然后立即冰浴2 min,加入5倍的反转录缓冲液4 μL,RNA酶抑制剂1 μL,反转录酶1 μL,RNase-Free ddH2O 4 μL。得到cDNA后进行PCR扩增,反应体系为:PCR buffer 5 μL,dNTPs 4 μL,IFN-γ上游引物1 μL,IFN-γ下游引物1 μL,cDNA 3 μL,DNA聚合酶0.5 μL,加去离子水至50 μL。PCR扩增程序为:94℃1 min,55℃1 min,72℃1 min,共35个循环,最后72℃延伸10 min。
1.2.4 序列测定与分析 扩增产物送至宝生物工程(大连)有限公司进行序列测定,然后应用DNA Star软件对IFN-γ基因序列进行分析。
1.2.5 蛋白结构预测 应用DNA Star软件预测藏羊IFN-γ蛋白的二级结构和亲水性,应用PredictProtein和I-Tasser在线服务器分别预测IFN-γ蛋白的修饰位点和三级结构。
2 结果
2.1 总RNA提取结果
RNA所在泳道出现目的条带,28 S的量为18 S的2倍,因此提取的总RNA能够作为下一步反转录的模板 (图2)。

M.DNA标准DL 2 000;1.脾脏总RNA
M.DNA Marker DL 2 000; 1.Total RNA of spleen
图1 总RNA琼脂糖凝胶电泳
Fig.1 Agarose gel electrophoresis of total RNA
2.2 IFN-γ基因PCR扩增结果
将提取的总RNA反转录成cDNA后进行PCR扩增,经电泳检测得IFN-γ基因扩增产物的大小与预期的429 bp片段大小相符,且条带明显。

M.DNA标准DL 2 000;1.阴性对照;2.IFN-γ基因
M.DNA Marker DL 2 000; 1.Negative control; 2.IFN-γ gene
图2 IFN-γ基因琼脂糖凝胶电泳
Fig.2 Agarose gel electrophoresis of IFN-γ gene
2.3 IFN-γ基因序列分析
2.3.1 核苷酸序列分析 核苷酸序列分析结果表明(表1),IFN-γ基因长度为429 bp,其碱基中含有较多的腺嘌呤和胸腺嘧啶。
2.3.2 氨基酸序列分析 氨基酸序列分析结果表明(表2),IFN-γ基因片段编码143个氨基酸,其中疏水性氨基酸的含量最高。
2.3.3 同源比对分析 将获得的藏羊IFN-γ基因与NCBI登录的绵羊(DQ410715.1)、山羊(NM-001285682.1)、藏羚羊(XM-005968140.1)和牛(FJ263670.1)IFN-γ基因的核苷酸序列与氨基酸序列进行比较,结果表明(图3~图5),藏羊与绵羊IFN-γ基因的核苷酸序列同源性最高,为100%;相对于山羊IFN-γ基因核苷酸序列存在3处碱基突变,同源性为99.3%;相对于藏羚羊IFN-γ基因核苷酸序列存在4处碱基突变,同源性为99.1%;相对于牛IFN-γ基因核苷酸序列存在12处碱基突变,同源性为97.2%。另外,藏羊IFN-γ基因与上述基因的氨基酸序列同源性依次为100%、99.3%、99.3%和95.8%。

表1 IFN-γ基因核苷酸序列分析

表2 IFN-γ基因氨基酸序列分析
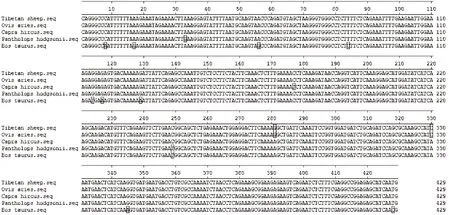
图3 IFN-γ基因核苷酸序列同源性比较
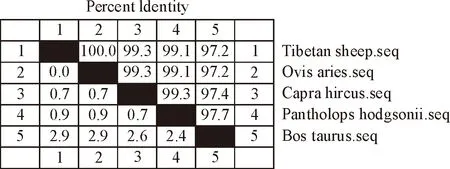
图4 IFN-γ基因核苷酸序列同源性百分比

图5 IFN-γ蛋白氨基酸序列同源性百分比
2.4 IFN-γ蛋白结构预测
2.4.1 二级结构预测 Garnier-Robson方法预测结果表明(图6),IFN-γ蛋白结构中α螺旋占66.4%,分布区域为4-15、28-46、54-81、87-96、101-119和122-128位氨基酸;β折叠占6.29%,主要分布区为47-53位氨基酸;β转角占11.2%,在肽段N端和C端有少量分布,主要区域为21-24、129-133和136-139位氨基酸;无规则卷曲占16.8%,主要分布区域为1-3、18-20、25-27、82-86和140-143位氨基酸。
Chou-Fasman方法预测结果表明(图6),IFN-γ蛋白结构中α螺旋占52.4%,分布区域为6-18、28-38、56-59、75-82、87-120和125-129位氨基酸;β折叠占16.8%,在肽段中只有2个分布区,在43-55和64-74位氨基酸;β转角占25.2%,分布区域为2-5、19-26、39-42、60-63、83-86、121-124和132-139位氨基酸。
2.4.2 亲水性预测 预测结果表明(图7),IFN-γ蛋白具有很强的亲水性,主要分布区为2-24、33-45、57-68、75-95、103-111、119-143位氨基酸。
2.4.3 三级结构预测 预测IFN-γ蛋白三级结构后得到5种模型,C-score值分别为:模型1:1.36,模型2:-1.99,模型3:-2.27,模型4:-2.52,模型5:-2.41,所有模型的C-score值均在[-5,2]的置信区间内,其中模型1的C-score值最大,可信度最高。如图所示(图8),IFN-γ蛋白结构以α螺旋为主,这与二级结构预测结果相符。
2.4.4 蛋白修饰位点预测 修饰位点预测结果表明,IFN-γ蛋白含有1个酪蛋白激酶Ⅱ磷酸化位点,为18-21位的SNPD;1个酰胺化位点,为137-140位的RGRR;2个N-糖基化位点,为16-19位的NASN和83-86位的NGSS;2个cAMP和cGMP依赖性蛋白激酶磷酸化位点,为129-132位的RKRS和139-142位的RRAS;3个蛋白激酶C磷酸化位点,分别为40-42位的SDK、86-88位的SEK和121-123位的SPK。

图6 IFN-γ蛋白二级结构
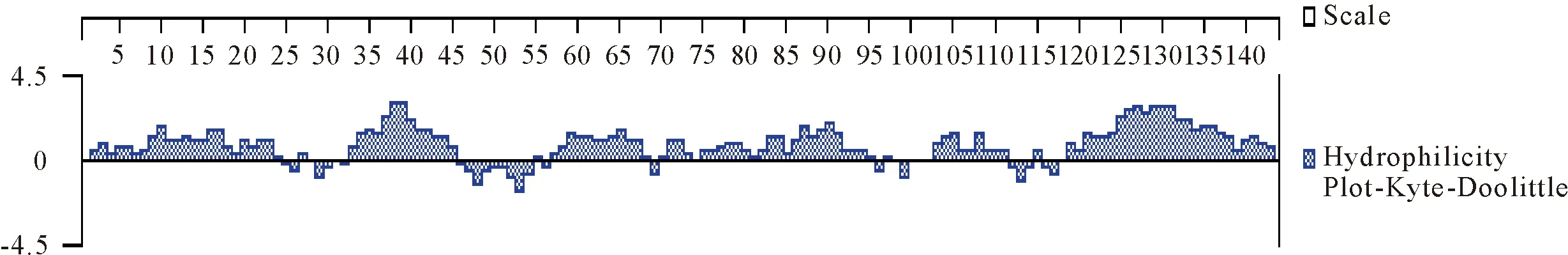
图7 IFN-γ蛋白亲水性
3 讨论
藏羊是青藏高原特有的种质资源,在高海拔和缺氧环境中,具有很强的抗病力。IFN-γ具有免疫调节作用,是增强藏羊抗病力的重要因子,其主要功能是促进MHCⅠ类和MHCⅡ类抗原的递呈。IFN-γ能够诱导免疫蛋白酶体的形成,使其水解和加工MHCⅠ类抗原,并增加抗原肽的产量和多样性[8]。它还能促进抗原提呈相关转运体TAP的表达,使TAP将抗原肽转运并提呈给MHCⅠ类分子,间接提高MHCⅠ类抗原肽的提呈效率[9-10]。此外,在所有干扰素中,只有IFN-γ能够促进MHCⅡ类抗原的提呈,它所生成的反式作用元件能和MHC基因启动子区的顺式作用元件相结合而调控MHC基因转录,激活T淋巴细胞,进一步清除外源性抗原[7,11]。IFN-γ作为一种重要的免疫调节细胞因子,既可以单独用于一些疾病的预防、诊断和治疗,还可以作为免疫佐剂。姜逸等[12]在鸡传染性支气管病毒疫苗株上插入鸡IFN-γ基因,构建了重组病毒。海岗[13]将山羊IFN-γ基因插入到山羊痘病毒中,构建了共表达口蹄疫病毒结构蛋白VP1和山羊IFN-γ的重组山羊痘病毒,为研制安全高效的重组山羊痘病毒疫苗找到可行的方法。本研究通过RT-PCR技术扩增了藏羊IFN-γ基因,并进行了序列分析及蛋白结构预测,研究结果可为藏羊IFN-γ基因抗病功能的研究及相关免疫佐剂的研制提供参考。
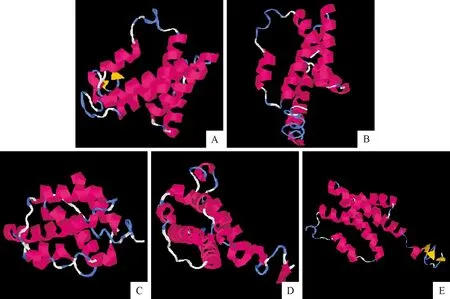
A.模型1;B.模型2;C.模型3;D.模型4;E.模型5
经过同源性比对分析发现,藏羊与绵羊IFN-γ基因的核苷酸和氨基酸同源性均为100%;相对于羊的不同品种,藏羊IFN-γ基因与藏羚羊和山羊IFN-γ基因的同源性很高,达到了99%以上;与牛IFN-γ基因的核苷酸序列同源性也较高,达到了97.2%,说明IFN-γ基因具有相对种属特异性,亲缘关系越近同源性越高。此外,目前还未见有关羊Ⅱ型干扰素亚型的报道,说明羊IFN-γ基因具有高度保守性。
经预测得知藏羊IFN-γ蛋白有5种功能位点,其中酪蛋白激酶Ⅱ(casein kinase Ⅱ,CK Ⅱ)是Ser/thr类蛋白激酶,可以磷酸化IFN-γ蛋白的Ser/thr氨基酸,实现信号的传递[14]。C端氨基酸残基酰胺化的作用可能是保护IFN-γ蛋白免受酶的降解作用从而延长在体内的半衰期或加强与受体的亲和力[15]。IFN-γ蛋白是一种分泌性糖蛋白,有两个N-糖基化位点(N-glycosylation site,ASN),糖基化与IFN-γ在体内的半衰期有关[2],也有可能用来识别细胞膜表面的受体[16],激活宿主免疫应答。环腺苷酸(cyclic adenosine monophosphate,cAMP)和环鸟苷酸(cyclic guanosine monophosnhate,cGMP)作为第二信使,可能在IFN-γ基因表达过程中起到信号传导的作用[17]。蛋白激酶C(protein kinase C,PKC)是参与T淋巴细胞活化的重要分子,可能对CD3+T细胞表达IFN-γ有重要作用,在PKC和胞内钙离子([Ca2+]i)的共同作用下激活IFN-γ基因[18],发挥免疫调节的作用。
[1] 向泽宇,王长庭.青藏高原藏羊遗传资源的现状、存在问题及对策[J].中国畜牧兽医文摘,2011,27(2):1-4.
[2] 夏伦斌.绵羊γ干扰素(IFN-γ)基因的克隆、表达与抗病毒活性初步研究[D].新疆石河子:石河子大学,2007.
[3] 徐宏伟.棉酚对新疆多浪羊IFN-γ基因表达影响及pcDNA3.1-IFN-γ真核表达载体的构建和淋巴细胞转染[D].新疆阿拉尔:塔里木大学,2015.
[4] Rosa F M,Cochet M M,Fellows M.Interferon and major hlstocompatibility complex genes:a model to analyse eukaryotic gene regulation[J].Interferon,1986,7:47-87.
[5] Mcinnes C J,Logan M,Redmond J,et al.The molecular cloning of the ovine gamma-interferon cDNA using the polymerase chain reaction[J].Nucleic Acids Res,1990,18(13):4012.
[6] Nagata R,Muneta Y,Yoshihara K,et al.Expression cloning of gamma interferon-inducing antigens ofMycobacteriumaviumsubsp.Paratuberculosis[J].Infection Immunity,2005,73(6):3778-3782.
[7] 杨生海,殷 宏,刘永生,等.干扰素-γ研究进展[J].生物技术通报,2010(8):29-34.
[8] Groettrup M,Khan S,Schwarz K,et al.Interferon-gamma inducible exchanges of 20S proteasome active site subunits:why?[J].Biochimie,2001,83(3-4):367-372.
[9] York I A,Rock K L.Antigen processing and presentation by the class I major histocompatibility complex[J].Annu Rev Immunol,1996,14:369-396.
[10] Grandea A G,Androlewicz M J,Athwal R S,et al.Dependence of peptide binding by MHC class I molecules on their interaction with TAP[J].Science,1995,270(5233):105-108.
[11] Mach B,Steimle V,Martinez-Soria E,et al.Regulation of MHC class II genes:lessons from a disease[J].Annu Rev Immunol,1996,14:301-331.
[12] 姜 逸,唐梦君,程 旭,等.表达鸡γ-干扰素重组鸡传染性支气管炎病毒的构建及鉴定[J].中国预防兽医学报,2015,37(3):167-171.
[13] 海 岗.表达FMDV vp1基因和山羊γ-干扰素基因的重组山羊痘病毒的构建及其生物学特性研究[D].北京:中国农业科学院,2008.
[14] 谢立苹.幽门螺杆菌CagM、CagI蛋白的生物信息学分析[D].江苏镇江:江苏大学,2012.
[15] 刘深基,陈松森.多肽酰胺化酶的结构与功能[J].生物化学与生物物理进展,1999,26(3):195-197.
[16] 李富强.合作猪血液生理生化及免疫指标的测定和IFN-γ序列分析[D].甘肃兰州:甘肃农业大学,2013.
[17] 王正朝.第二信使cAMP/cGMP信号通路对哺乳动物卵巢功能的调控机制[D].江苏南京:南京农业大学,2008.
[18] 何贤辉,曾耀英,徐丽慧,等.蛋白激酶C抑制剂对T细胞表达IL-2及IFN-γ的影响[J].中国病理生理杂志,2002,18(5):522-525.
Amplification,Sequence Analysis and Protein Structure Prediction of IFN-γ Gene of Tibetan Sheep
ZHANG Xiao-fen,YE Gui-sheng,WEN Xi-ping,QI Xiu-qing
(CollegeofAgricultureandAnimalHusbandry,QinghaiUniversity,StateKeyLaboratoryofPlateauEcologyandAgriculture,Xining,Qinghai,810016,China)
In order to study the function of IFN-γ gene of Tibetan sheep,the total RNA was extracted from spleen of Tibetan sheep firstly,then the IFN-γ gene of Tibetan sheep was amplified by RT-PCR and sequenced.Finally,the DNA Star software was used to analyze the gene sequence and predict the protein structure.The result showed that the length of IFN-γ gene was 429 bp,with a higher content of adenine and thymine,and it encoded 143 amino acids,among which hydrophobic amino acids and polar amino acids were richer.The nucleotide sequence homology of IFN-γ gene with that ofOvisaries,Caprahircus,PantholopshodgsoniiandBostauruswere 100%,99.3%,99.1% and 97.2% respectively,and the amino acid sequence homology were 100%,99.3%,99.3% and 95.8% respectively.In addition,the IFN-γ protein was mainly composed of α-helix,its hydrophilicity was high ,and it contained five kinds of protein functional sites,including one casein kinase II phosphorylation site,one amidation site,two N-glycosylation sites,two cAMP- and cGMP-dependent protein kinase phosphorylation sites and three protein kinase C phosphorylation sites.These results provided some
for studying the immune function of IFN-γ gene of Tibetan sheep in Qinghai province.
Tibetan sheep; IFN-γ gene; RT-PCR; sequence analysis; protein structure prediction
2016-08-04
青海省科技厅项目(2016-ZJ-738);青海大学“123高层次人才培养工程”项目
张晓芬(1992-),女,青海西宁人,硕士研究生,主要从事分子病原生物学与免疫学研究。*通讯作者
S852.4;Q343.1
A
1007-5038(2016)11-0008-06
