猪繁殖与呼吸综合征病毒GP5蛋白单克隆抗体的制备及鉴定
2016-12-09李志杰提金凤沈美艳袁东方苏成文
李志杰,提金凤,李 舫,沈美艳,袁东方,苏成文
(山东畜牧兽医职业学院,山东潍坊 261061)
猪繁殖与呼吸综合征病毒GP5蛋白单克隆抗体的制备及鉴定
李志杰,提金凤,李 舫*,沈美艳,袁东方,苏成文
(山东畜牧兽医职业学院,山东潍坊 261061)
为制备猪繁殖与呼吸综合征病毒(PRRSV)GP5蛋白单克隆抗体,首先构建猪PRRSV GP5基因的真核重组表达载体pCDNA-GP5,将其作为免疫原,对Balb/c小鼠进行免疫。取免疫4次后的小鼠脾细胞与骨髓瘤细胞SP2/0进行融合。构建PRRSV GP5基因的原核重组表达载体pGEX-6P-GP5,将其转化至大肠埃希菌Rosetta(DE3)并诱导表达。以表达的原核蛋白GP5作为单克隆抗体的筛选抗原,通过间接ELISA进行杂交瘤细胞株的检测和筛选。本研究成功构建了GP5基因的真核重组表达载体pCDNA-GP5,表达并纯化了GP5蛋白。经2~3次亚克隆后获得3株针对GP5蛋白的杂交瘤细胞株,IFA和Western blot对3株杂交瘤细胞株分泌的单克隆抗体进行了鉴定。GP5蛋白单克隆抗体的成功研制,为进一步建立特异性PRRSV检测方法奠定了基础。
猪繁殖与呼吸综合征病毒;GP5蛋白;真核表达;单克隆抗体
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是20世纪80年代末暴发的一种新型的高致病性猪传染病,对养猪业造成的危害非常严重[1-2]。PRRSV具有高度变异性,有美洲型和欧洲型两种毒株,我国流行的均属于美洲型[3-4]。PRRSV有9个不分节段的开放阅读框,编码多种非结构蛋白和8个结构蛋白,其中GP5和M蛋白是病毒的主要结构蛋白[5]。GP5蛋白又称为E蛋白,由ORF5编码。是一种跨膜糖蛋白,位于病毒粒子的包膜上,为糖基化的囊膜蛋白[5]。GP5蛋白具有较好的免疫原性,可诱导产生中和抗体,能在体外中和病毒的感染性[6]。动物机体在中和抗体出现之后,抗血清主要识别GP5蛋白[7]。因此,GP5单克隆抗体的研制将在该病的诊断和预防等方面发挥重要的作用。
本研究以PRRSV GP5蛋白的真核重组表达质粒作为免疫原,以GP5原核表达蛋白作为单抗的筛选抗原,通过间接ELISA方法筛选针对GP5蛋白的单克隆抗体。GP5蛋白单克隆抗体的研制为进一步研究建立PRRSV特异性诊断方法提供生物试剂,为养猪生产中对该病更好的防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、细胞及载体 PRRSV SDWF为本实验分离鉴定;Marc-145细胞株、小鼠骨髓瘤细胞SP2/0-Ag14由山东农业大学馈赠;大肠埃希菌Rosetta(DE3)、DH5α购自宝生物工程(大连)有限公司;真核表达载体pCDNA3.1(+)、原核表达载体pGEX-6p-1为本实验室保存。
1.1.2 实验动物 6周龄的Balb/c小鼠以及8周龄~10周龄的昆明小鼠购自山东大学医学院。
1.1.3 主要试剂与仪器
1.1.3.1 试剂 pMD18-T试剂盒、琼脂糖凝胶DNA纯化试剂盒、质粒快速提取试剂盒、Random Premier、dNTP均为宝生物工程(大连)有限公司产品;Trizol 试剂、TaqHIFI DNA高保真扩增酶、反转录酶 MLV、RNA 酶抑制剂、T4 DNA连接酶、SYBR®Premix ExTaqTMkit、dd H2O、小牛血清等均为北京全式金生物技术有限公司产品;BamHⅠ、XhoⅠ、单克隆抗体亚类鉴定试剂盒为Thermo Scientific公司产品;琼脂糖、PEG4000、HT、氨基喋呤(A)为Sigma公司产品;高糖型DMEM购自海克隆,羊抗鼠IgG-HRP、底物显色液为北京全式金生物公司产品;BSA蛋白测定试剂盒为北京康为世纪生物科技有限公司产品。
1.1.3.2 仪器 台式冷冻高速离心机(Beckman Coulter),普通PCR仪(Applied Biosystems 2720),凝胶成像系统(Bio-RAD);电泳仪,北京市六一仪器厂;UV-2000紫外分析仪,天能上海科技有限公司;金属浴CHB-100型,杭州大和热磁电子有限公司。
1.2 方法
1.2.1 PRRSV GP5基因真核表达载体的构建及表达
1.2.1.1 重组质粒pCDNA-GP5的构建及鉴定 以PRRSV全基因组cDNA为模板,利用设计的特异性引物进行GP5基因的扩增。GP5基因的上下游引物为GFP5-F:5′-CGGGATCCATGTTGGGGAAGTGCTTGACC-3′(BamHⅠ),GFP5-R:5′- CGGAATTCCTAGAGACGACCCCATTGTTCCG-3′(EcoRⅠ)。
扩增的PCR产物经琼脂糖凝胶DNA纯化试剂盒回收纯化,与pCDNA3.1(+)载体同时进行BamHⅠ、EcoRⅠ双酶切,回收纯化后进行连接。连接体系为20 μL,分别为:10 μL GP5基因双酶切产物,5 μL pCDNA3.1(+)双酶切产物,1 μL T4 DNA连接酶,2 μL buffer,3 μL ddH2O,混合后于16 ℃反应1.5 h。连接产物转化大肠埃希菌DH5α,在含青霉素的琼脂平板上筛选,挑取阳性克隆扩增并提取重组质粒pCDNA-GP5。
用扩增GP5基因的特异性引物对重组质粒pCDNA-GP5进行PCR扩增,琼脂糖凝胶电泳进行鉴定。BamHⅠ、EcoRⅠ对重组质粒pCDNA-GP5进行双酶切鉴定,同时重组质粒pCDNA-GP5由上海生工生物工程技术服务有限公司测序鉴定。
1.2.1.2 重组质粒pCDNA-GP5的表达及鉴定 将生长状态好的BHK-21细胞分装至24孔细胞板,待细胞密度达到至85%左右进行转染。转染步骤如下:98 μL OPI-MEM与2 μL lifofectamine在离心管中混匀,室温作用5 min;将97 μL OPI-MEM与3 μL重组质粒pCDNA-GP5(大约0.5 μg)在另一个离心管中混匀,室温作用5 min。将两个离心管中的内容物混和均匀,室温作用20 min。BHK-21细胞中(逐滴加入)轻轻加入混合物,边加边混匀,37 ℃继续培养5 h~6 h后弃上清。加入20 g/L DMEM后37 ℃继续培养24 h~48 h,进行IFA。以猪的PRRSV阳性血清为一抗,以山羊抗猪的FITC标记的荧光抗体作为二抗。空载体pCDNA3.1(+)转染的BHK-21细胞作为阴性对照。
1.2.2 PRRSV GP5基因原核表达载体的构建及表达
1.2.2.1 PRRSV GP5基因原核表达载体的构建及鉴定 以PRRSV cDNA为模板,利用特异性引物进行PCR扩增。设计引物时去掉了GP5蛋白N末端的31个氨基酸(AA)的信号肽疏水区,设计的特异性引物为:GFP5-F:5′-GGATCCATGAGCAACAGCAACAG-3′(BamHⅠ);GFP5-R:5′- GAATTCCTAGAGACGACCCCATT-3′(EcoRⅠ)。PCR产物经琼脂糖凝胶DNA纯化试剂盒回收纯化后,与pGEX-6p-1载体分别进行BamHⅠ和EcoRⅠ双酶切,双酶切产物回收纯化后进行连接,构建重组表达质粒pGEX-6P-GP5。20 μL连接体系如下:12 μL GP5 基因酶切回收产物,5 μL pGEX-6p-1酶切回收产物,1 μL T4 DNA连接酶,2 μL T4 DNA连接酶buffer,混匀后16 ℃反应1.5 h。连接产物转化大肠埃希菌DH5α,在含青霉素的琼脂平板上进行筛选,挑取阳性菌落进行扩增并提取质粒。
采用GP5基因特异性引物对重组质粒pGEX-6P-GP5进行扩增,PCR产物进行琼脂糖凝胶电泳,同时重组质粒pGEX-6P-GP5由上海生工生物工程技术服务有限公司进行基因序列测定。
1.2.2.2 PRRSV GP5基因原核蛋白的表达及纯化 将重组表达质粒pGEX-6P-GP5和空载体pEGX-6p-1分别转化至大肠埃希菌Rosetta(DE3)中。挑取菌落,在2YT(Amp)中培养13 h,取50 μL菌液至5 mL 2YT(Amp)中,继续培养至OD600nm为0.6~0.8时,加入终浓度为1 mmol/L的IPTG,诱导3 h~5 h后,取1 mL的菌液,PBS洗涤3次后用100 μL PBS悬浮,加入100 μL 2倍的蛋白质上样缓冲液,煮沸3 min~5 min,取上清液进行SDS-PAGE电泳。SDS-PAGE电泳步骤参照分子克隆(第2版)进行。
诱导100 mL菌液,冰浴条件下超声波裂解,然后12 000 r/min 离心10 min。取离心后的菌液上清和沉淀各100 μL进行SDS-PAGE电泳。超声波裂解后的沉淀分别采用0.5、1、3 moL/L的尿素溶液进行洗涤纯化,每次12 000 r/m离心5 min。纯化后的蛋白采用BSA蛋白测定试剂盒进行蛋白定量。
1.2.3 单克隆抗体的制备
1.2.3.1 间接ELISA方法的建立 采用方阵滴定法来确定包被抗原和阳性血清的最佳稀释倍数。在96孔酶标板中,将纯化后的GP5原核表达蛋白用0.05 mol/L碳酸盐缓冲液(pH9.6)稀释至800 μg/100 μL,然后进行横向倍比稀释至25 μg/100 μL,每孔加入100 μL,4 ℃包被过夜。采用含0.5 mL/L 吐温-20的PBS(PBST)洗涤3次。然后加入倍比稀释的阳性血清和阴性血清(纵向稀释),从1∶10稀释至1∶6 400,100 μL/孔,37 ℃作用1 h。阳性血清采用免疫4次的Balb/c小鼠的血清,阴性血清采用为免疫Balb/c小鼠的血清。PBST洗涤3次后加入HRP标记的羊抗鼠酶标二抗(1∶5 000稀释),50 μL/孔,37℃作用1 h。PBST洗涤3次后加入TMB显色液,100 μL/孔,37 ℃ 闭光显色15 min。最后加入2 mol/L H2SO4终止反应,50 μL/孔,酶标仪测定OD450 nm值。阳性血清与阴性血清OD450 nm比值(P/N)最大时即为最佳的抗原包被浓度和血清稀释倍数。
1.2.3.2 间接ELISA临界值的确定 采用建立的ELISA检测方法,对采集的20份PPRSV GP5蛋白阴性血清样品进行检测,每份样品重复检测3次,计算样品的OD450 nm值和标准方差,阳性样品的临界值=阴性OD450 nm平均值 +3×标准差,当样品OD450nm值大于此值则判为阳性。
1.2.3.3 单克隆抗体的制备 6周龄Balb/c小鼠,腿部肌肉注射重组质粒pCDNA-GP5,100 μg/只,间隔2周免疫1次。3免后1周采血,间接ELISA测定小鼠血清的OD450 nm值,若为阳性(OD450 nm值大于临界值),1周后加强免疫,3 d后融合。
细胞融合参考文献[8]进行,免疫小鼠的脾细胞与处于对数生长期的SP2/0细胞按3∶1的比例混合,以PEG-4000为融合剂进行融合。免疫小鼠的血清作为单克隆抗体筛选时的阳性对照,未免疫小鼠的血清作为筛选时的阴性对照。融合后的细胞采用HAT培养基悬浮,分装96孔细胞板,100 μL/孔,置37 ℃、体积分数为5% CO2培养箱中培养。5 d后补加一半HAT培养基,10 d后用HT培养基将孔中的HAT培养基全部换出,37 ℃继续培养。待96孔细胞板中培养基变黄时,采用间接ELISA法进行检测。将检测结果为阳性的杂交瘤细胞进行亚克隆2次~3次,至到所有亚克隆细胞孔的阳性率为100%。将阳性杂交瘤扩大培养并冻存。按照Golding方法[6],制备阳性杂交瘤的腹水。
1.2.4 单克隆抗体的鉴定
1.2.4.1 亚类鉴定 根据鼠亚类快速鉴定试剂条的说明书对本研究中获得的单克隆抗体进行亚类鉴定。
1.2.4.2 间接ELISA效价的测定 将本研究中获得的杂交瘤细胞株的细胞上清和腹水倍比稀释,采用建立的间接ELISA法,测定其抗体效价。
1.2.4.3 间接免疫荧光(IFA)鉴定 将处于对数生长期的Marc-145 细胞分装至24孔细胞板中,当细胞孔铺满大约85%左右的细胞时,进行PRRSV吸附,之后加入细胞维持液继续培养。待细胞中出现大约50%细胞病变时,利用甲醇和丙酮固定细胞。然后加入GP5蛋白的单抗,37 ℃作用1 h,PBS洗涤3次。以FITC标记的羊抗鼠荧光抗体作为二抗,37 ℃避光作用1 h后,PBS洗涤3次。荧光显微镜下观察结果。
1.2.4.4 Western blot鉴定 分别取15 μL处理好的Rosetta(DE3)菌液样品(分别含空载体pEGX-6p-1和重组质粒pGEX-6P-GP5)进行SDS-PAGE电泳,电泳结束后取出凝胶。将硝酸纤维素薄膜(NC)和滤纸放入转印缓冲液中,室温浸泡10 min,然后按照2张滤纸→凝胶→NC膜→2张滤纸的顺序放好,中间不能有气泡,进行转印。转印后的NC膜放在平皿中,用50 g/L脱脂乳37 ℃封闭2 h, PBST洗涤3次,5 min/次。然后加入杂交瘤细胞株的细胞上清,37 ℃水作用1 h,PBST洗涤3次,5 min/次。然后再加入1∶5 000稀释的HRP标记羊抗鼠酶标二抗, 37 ℃作用1 h,PBST洗涤3次,5 min/次。DAB避光显色,流水终止反应,观察结果。
2 结果
2.1 GP5基因真核重组表达载体pCDNA-GP5的鉴定
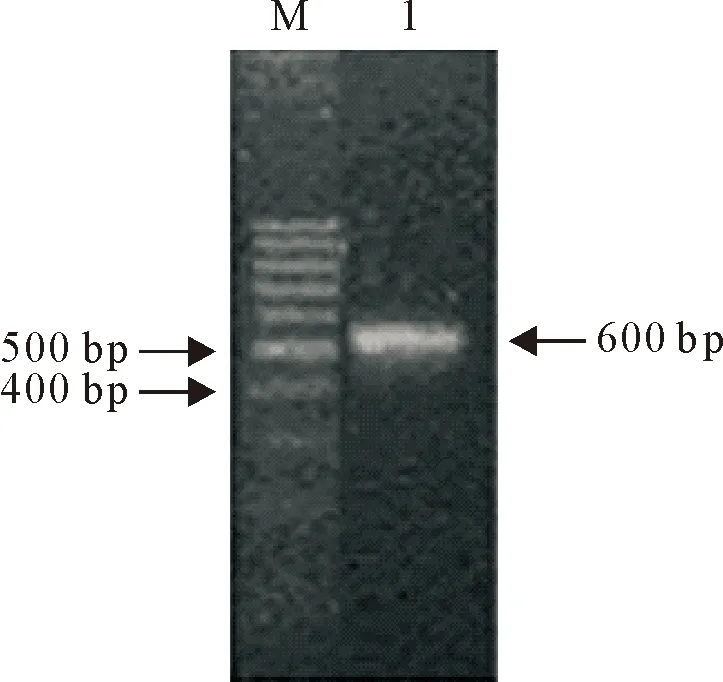
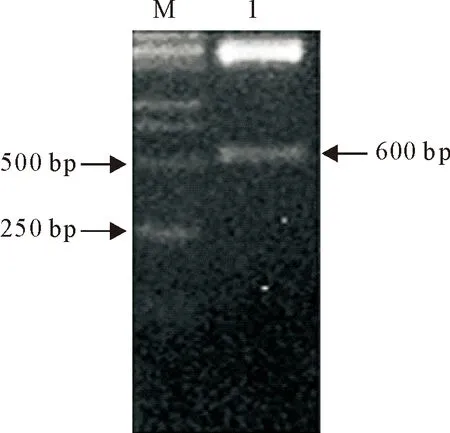
真核重组表达质粒pCDNA-GP5进行PCR和双酶切鉴定,PCR和酶切产物分别进行8 g/L的琼脂糖凝胶电泳。PCR结果显示,在600 bp左右的位置出现目的条带(图1)。酶切结果如图2所示,大小为5 kb左右的条带为切开的载体片段,大小为600 bp左右的条带是目的片段。
重组质粒基因序列测定结果显示,其GP5核苷酸序列与GenBank上发布的美洲型PRRSV GP5基因(登录号:KR706344.1)核苷酸序列的同源性为99%。
2.2 重组质粒pCDNA-GP5的表达及鉴定
重组质粒pCDNA-GP5和空载体pCDNA3.1(+)分别转染BHK-21细胞,进行IFA,荧光显微镜进行观察。结果显示,转染重组质粒pCDNA-GP5的BHK-21细胞出现绿色荧光,说明GFP5基因在BHK-21细胞中表达;而转染空载体pCDNA3.1(+)的BHK-21细胞无荧光产生(图3)。
2.3 NS1基因原核重组表达载体的鉴定
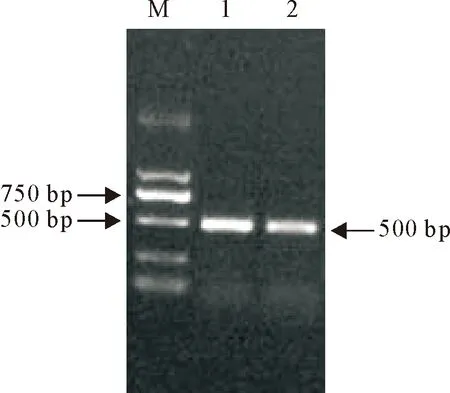
以重组质粒pGEX-6p-GP5为模板,用GP5基因特异性的上下游引物进行PCR扩增。PCR产物进行8 g/L琼脂糖凝胶电泳,在500 bp左右的位置出现目的条带(图4),这与删去GP5基因N末端的31个氨基酸信号肽疏水区后的大小一致。重组质粒序列测定结果显示,其GP5基因序列与GenBank上PRRSV GP5基因(登录号:KR706344.1)核苷酸序列的同源性为99%。
M.DNA 标准DL 2 000;1.PCR 产物
M.DNA Marker DL 2 000 ;1.PCR products
图1 重组质粒pCDNA-GP5的PCR鉴定
Fig.1 PCR identification of recombinant vector pCDNA-GP5
M.DNA 标准DL 2 000;;1.重组质粒pCDNA-GP5酶切鉴定
M.DNA Marker DL 2 000;1.The identification of recombinant vector pCDNA-GP5 with enzyme digestion
图2 重组质粒pCDNA-GP5的酶切鉴定
Fig.2 Identification of recombinant vector pCDNA-GP5 by enzyme digestion

A.重组质粒pCDNA-GP5转染BHK-21细胞;B.空载体pCDNA3.1(+)转染BHK-21细胞
2.4 GP5原核蛋白的表达及纯化
原核重组表达载体pGEX-6p-GP5及空载体pGEX-6p-1分别转化至大肠埃希菌Rosetta(DE3)中,采用终浓度为1 mmoL/L IPTG进行诱导。SDS-PAGE电泳结果显示,诱导5 h后GP5蛋白表达量最高,GP5与GST形成融合蛋白的大小为42 ku左右(图5)。超声波裂解诱导后的菌液,将菌液上清和沉淀分别进行SDS-PAGE电泳。表达的GP5蛋白主要出现在沉淀中,提示该蛋白以包涵体的形式表达。超声波裂解的菌液沉淀分别采用不同浓度的尿素洗涤,最终获得了纯度较高的GP5蛋白(图5)。纯化后的GP5蛋白浓度为3.85 μg/μL。
2.5 抗原最佳包被浓度和血清最佳稀释倍数的确定
采用方阵滴度法,将纯化后的GP5蛋白倍比稀释后包被酶标板,阳性血清和阴性血清倍比稀释后进行检测。结果显示,阳性血清与阴性血清OD450 nm比值最高为10.18,GP5蛋白最佳宝贝浓度为100 ng/孔,阳性血清的最佳稀释倍数为20倍。
1~2.pGEX-6p-GP5 PCR产物;M.DNA 标准DL 2 000
1-2.PCR products of recombinant vector pGEX-6p-GP5;M.DNA Marker DL 2 000
图4 重组质粒pGEX-6p-GP5 的PCR鉴定
Fig.4 PCR identification of recombinant vector pGEX-GP5
2.6 间接ELISA临界值的确定
采用建立的ELISA检测方法,对采集的20份PPRSV GP5蛋白阴性血清样品进行检测,阴性血清的OD450 nm的平均值为0.184,标准差为0.051,根据公式临界值=阴性OD450 nm平均值+3×标准差,阴阳性血清的临界值为0.337。
2.7 杂交瘤细胞株的建立及其部分生物学特性
通过间接ELISA方法共筛选到3株针对GP5蛋白的杂交瘤细胞株,分别命名为1D5、2H4和3G5。传代培养后,杂交瘤细胞株依然能稳定的分泌单抗。3株杂交瘤细胞分泌的单抗亚类、细胞上清和腹水的间接ELISA效价见表1。
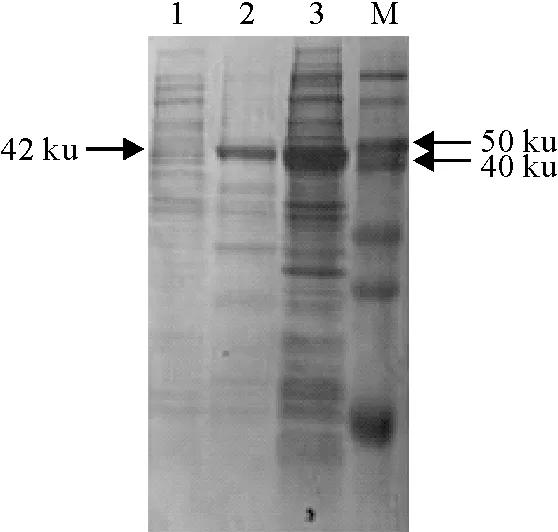
1.含空载体pGEX-6p-1的Rosetta(DE3)经IPTG诱导;2.纯化后的GP5原核表达蛋白;3.含重组质粒pGEX-6p- GP5的Rosetta(DE3)经IPTG诱导;4.蛋白分子质量标准(14 ku~100 ku)
1.Rosetta(DE3) containing pGEX-6p-1 with IPTG indution; 2.The purified prokaryotic expression product of GP5 protein; 3.Rosetta(DE3)containing pGEX-6p- GP5 with IPTG indution; M.Marker (14 ku-100 ku)
图5 GP5基因原核表达产物的SDS-PAGE鉴定
Fig.5 Identification of prokaryotic expression products of GP5 gene by SDS-PAGE
2.8 IFA鉴定
将Marc-145细胞分装至24孔细胞板中,PRRSV吸附后进行IFA,一抗分别采用本研究中获得的3株单抗,二抗采用FITC标记的羊抗鼠荧光抗体,反应结束后荧光显微镜下观察。结果显示,加入3株单抗的细胞均产生了特异性的绿色荧光,表明3株单抗均与PRRSV反应。阴性对照没有出现任何荧光(图6)。

表1 3株单抗的部分生物学特性
2.9 Western blot鉴定
将分别含重组质粒pGEX-6p-GFP和空载体pGEX-6p-1的菌液Rosetta(DE3),采用IPTG诱导后进行SDS-PAGE电泳,电泳结束后将蛋白条带转印到硝酸纤维素薄膜(NC)上,一抗分别采用3株杂交瘤细胞株的细胞上清,进行Western blot鉴定。结果显示,3株单抗均在42 ku的位置上出现特异性条带,阴性对照没有条带出现(图7)。这进一步表明3株单抗是针对GP5蛋白。
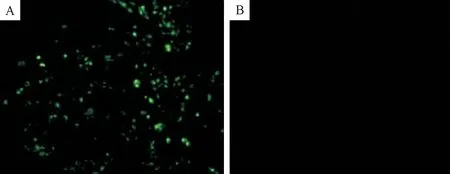
A.单抗3G5的IFA鉴定;B.阴性对照
3 讨论
GP5含有6个抗原决定簇,能诱导机体产生特异性中和抗体,因此该蛋白在新型疫苗研发及检测方法建立等方面有着潜在的应用价值[9-11]。本研究通过采用基因免疫Balb/c小鼠,利用GP5原核蛋白来筛选抗体,获得并鉴定了3株针对GFP5蛋白的单克隆抗体,为临床上PRRSV建立新的检测方法奠定了基础。PirZadeh B等[12]证实,将GP5基因真核重组质粒直接免疫猪群,该重组质粒能诱导猪体产生抗GP5的抗体,该抗体能中和PRRSV,引起免疫反应,阻止病毒血症的继续发展。因此,通过构建的GP5基因真核重组质粒免疫动物,能够诱发机体产生针对GP5蛋白的抗体。本研究采用基因免疫来研制针对GP5蛋白的单克隆抗体,通过构建真核重组表达载体pGEX-6p-GP5,利用该重组质粒作为Balb/c小鼠的免疫原,以期获得针对GP5蛋白的单克隆抗体。

1.阴性对照(3G5与含空载体pGEX-6P-1的菌液反应);2.单抗1D5与含重组载体pGEX-6P-GP5诱导的菌液反应结果;3.单抗2H4与含重组载体pGEX-6P-GP5诱导的菌液反应结果;4.单抗3G5与含重组载体pGEX-6P-GP5诱导的菌液反应结果;M.蛋白分子质量标准
1.Negative control; 2.The reaction of 1D5 and Rosetta(DE3)containing pGEX-6P-GP5 induced with IPTG; 3.The reaction of 2H4 and Rosetta(DE3)containing pGEX-6P-GP5 induced with IPTG;4.The reaction of 3G5 and Rosetta(DE3)containing pGEX-6P-GP5 induced with IPTG; M.Protein molecular weight Marker
图7 3株单抗的Western blot鉴定
Fig.7 Identification of 3 monoclonal antibodies by Western blot
研究表明,若将GP5基因全基因序列克隆至原核表达载体中,蛋白难以表达,原因是PRRSV-GP5具有疏水跨膜特性,其N端的信号肽序列使表达的蛋白锚定在细胞膜上导致细胞裂解,影响表达量GP5基因的表达剂量[13-14]。李建辉等[15]将GP5基因N端的信号肽去掉后在大肠埃希菌中获得了蛋白的表达,但蛋白的表达量较低。周恩民等[16]将GP5基因去掉2段跨膜区和信号肽后进行了分段表达,获得了蛋白的高效表达。该方法虽然能获得大量蛋白,但操作复杂,而且去掉的核酸片段较多,这样可能会影响到融合蛋白的抗原性。袁庄川等[17]研究发现,GP5基因与GST形成融合蛋白能获得较高水平的表达。本研究采用原核表达载体pGEX-6P-1,以GST作为融合蛋白来表达目的基因,以期获得GP5蛋白的高表达。同时,在构建重组表达载体pGEX-GP5时,去掉GP5基因N端31个氨基酸的信号肽序列,重组载体在大肠埃希菌Rosetta(DE3)中得以表达,并最终得到了纯化的GP5原核表达蛋白,为下一步研制针对GP5蛋白的单克隆抗体提供了筛选抗原,奠定了坚实的基础。
王志红等[18]采用原核蛋白免疫的方式研制GP5的单抗,免疫原和筛选抗原一样,容易出现筛选困难;谢甜甜等利用全病毒筛选单抗[19];马苏[20]采用基因免疫,全病毒筛选的方式研制单抗。这些报道中存在着病毒纯化步骤繁琐,难以纯化等难题。本研究采用GP5基因真核重组表达载体作为免疫原,以GP5原核蛋白作为筛选抗原,这样更容易筛选到针对GP5蛋白的单抗,而且操作方法比较简单方便。
总之,本研究共筛选并鉴定了针对PRRSV GP5蛋白的3株杂交瘤细胞株,3株杂交瘤细胞分泌的单抗均具有较高的抗体效价、特异性和敏感性,为PRRSV检测方法的建立提供了重要的生物试剂。
[1] 代 军,雷 蕾,任志华.猪繁殖与呼吸综合征防控研究进展[J].动物医学进展,2014,35(4):97-101.
[2] Karniychuk U U, Nauwynck H J.Pathogenesis and prevention of placental and transplacental porcine reproductive and respiratory syndrome virus infection [J].Vet Res,2013, 44(1):95.
[3] Li B,Fang L,Guo X,et al.Epidemiology and evolutionary characteristics of the porcine reproductive and respiratory syndrome virus in China between 2006 and 2010 [J].J Clin Microbiol,2011,49(9):3175-3183.
[4] 朱佳毅,任晓峰.猪繁殖与呼吸综合征病毒检测方法的研究进展[J].中国预防兽医学报,2014,36(1):77-80.
[5] 林思远,洪绍锋,黄加滨,等.PRRSV广西分离株GXYL-1403全基因克隆与序列分析 [J].动物医学进展,2016,37(2):44-49.
[6] Thaa B,Sinhadri B C,Tielesch C,et al.Signal peptide cleavage from GP5 of PRRSV:A minor fraction of molecules rtains the decoy epitope,a presumed molecular cause for viral persistence [J].PLoS One,2013,8(6):e65548.
[7] 彭 军,郭中坤,杜以军,等.猪繁殖与呼吸综合征病毒GP5抗体检测ELISA在中和抗体评估中潜在应用的研究 [J].中国预防兽医学报,2015,37(10):774-779.
[8] 孙建慧,黄立平,危艳武,等.猪细小病毒1型VP2蛋白的表达与单克隆抗体的制备及应用[J].中国兽医科技,2014,44(12):1279-1285.
[9] 刘 杏,王凤雪,温永俊,等.猪繁殖与呼吸综合征病毒感染和复制机制及其毒力研究进展[J].病毒学报,2015,31(5):585-592.
[10] Roques E,Girard A.Immunogenic and protective properties of GP5 and M structural proteins of porcine reproductive and respiratory syndrome virus expressed from replicating but nondisseminating adenovectors[J].Vet Res,2013,44:17.
[11] Ren J Q,Sun W C,Lu H J,et al.Construction and immunogenicity of a DNA vaccine coexpressing GP3 and GP5 of genotype-I porcine reproductive and respiratory syndrome virus[J].Vet Res,2014,10:128.
[12] Pirzadeh B,Gagnon C A,Dea S.Genomic and antigenic variations of porcine reproductive and respiratory syndrome virus major envelope GP5 glycoprotein[J].Can J Vet Res,1998,62(3):170-177.
[13] 陈如敬,吴学敏,车勇良,等.PRRSV GP5抗原表位的串联表达及生物学活性鉴定[J].中国兽医学报,2014,34(6):904-907.
[14] 张茂东.Marc-145细胞内GP5表达对猪繁殖与呼吸综合征病毒感染的影响[D].陕西杨凌:西北农林科技大学,2015.
[15] 李建辉,左玉柱,孙彦欣,等.猪繁殖与呼吸综合征病毒GP5基因的亚克隆及原核表达[J].动物医学进展,2012,33(1):19-22.
[16] 刘 岳,肖一红,崔 然,等.猪繁殖与呼吸综合征病毒GP5蛋白分段表达及其生物学功能的鉴定[J].中国预防兽医学报,2011,33(4):257-260.
[17] 袁庄川,王鲁彦,梅匀安,等.猪繁殖与呼吸综合征病毒GP5基因的克隆和原核表达[J].动物医学进展,2013,34(12):17-21.
[18] 王志红.猪繁殖与呼吸综合征病毒GP5蛋白单克隆抗体制备与鉴定[D].河南郑州:郑州大学,2012.
[19] 谢甜甜.抗猪繁殖与呼吸综合征病毒GP5蛋白的单克隆抗体与胸膜肺炎放线杆菌apxIA基因的核酸疫苗研究[D].湖北武汉:华中农业大学,2005.
[20] 马 苏.猪繁殖与呼吸综合征病毒GP5、M和N蛋白单克隆抗体的研制及生物学特性分析[D].江苏南京:南京农业大学,2006.
Preparation and Identification of Monoclonal Antibodies Against GP5 Protein of Porcine Reproductive and Respiratory Syndrome Virus
LI Zhi-jie,TI Jin-feng,LI Fang,SHEN Mei-yan,YUAN Dong-fang,SU Cheng-wen
(ShandongVocationalAnimalScienceandVeterinaryCollege,Weifang,Shandong,China261061)
The eukaryotic recombinant expression plasmid of GP5 gene of porcine reproductive and respiratory syndrome virus (PRRSV) GP5 gene was constructed and the recombinant plasmid was named pcDNA-GP5.The recombinant plasmid was used to inoculate Balb/c mice as the immunogen.After 4 times of immunization,spleen cells from mice were fused with SP2/0 cells.The prokaryotic recombinant expression plasmid of GP5 gene of PRRSV was constructed and the recombinant plasmid was named pGEX-6P-GP5.The plasmid pGEX-6P-GP5 was transformed toE.coliRosetta(DE3)and induced to express protein.The expressed protein was used to screen the monoclonal antibodies against GP5 protein by indirect ELISA.Three hybridoma cell lines were abtained after 2-3 subclones,and monoclonal antibodies against GP5 protein were identified by IFA and Western blot.
Porcine reproductive and respiratory syndrome virus; eukaryotic expression; monoclonal antibody
2016-05-05
潍坊市科技发展计划项目(20122050);山东省农业重大应用技术创新课题(规模化畜禽场清洁生产关键技术研究与示范);国家星火计划项目(2013GA740071)
李志杰(1978-),男,山东寿光人,讲师,硕士,主要从事畜禽传染病研究。*通讯作者
S852.659.6
A
1007-5038(2016)11-0036-07
