高效液相色谱法测定青稞红曲中内酯式和酸式洛伐他汀的含量
2016-12-03陈发贵张丹刘敏熊燕张森林赵辉
陈发贵,张丹,刘敏,熊燕,张森林,赵辉*
(1.青藏高原微生物国家地方联合工程中心,西藏拉萨850000;2.西藏月王生物技术有限公司,西藏拉萨850000)
高效液相色谱法测定青稞红曲中内酯式和酸式洛伐他汀的含量
陈发贵1,2,张丹2,刘敏1,2,熊燕1,2,张森林2,赵辉2*
(1.青藏高原微生物国家地方联合工程中心,西藏拉萨850000;2.西藏月王生物技术有限公司,西藏拉萨850000)
采用高效液相色谱法测定青稞红曲中内酯和酸式洛伐他汀的含量,以体积分数75%的乙醇作为提取剂,在室温条件下超声提取青稞红曲中的洛伐他汀1 h。使用Eclipse Plus C18柱(5 μm,250 mm×4.6 mm),调整柱温30℃,流动相为甲醇∶0.1%磷酸=73∶27;流速1.0 mL/min;进样量20 μL;紫外检测器波长238 nm。内酯式洛伐他汀标准品溶液在20~100 μg/mL时呈良好的线性(r2=0.999 7),内酯式洛伐他汀的平均回收率为99.30%,相对标准偏差为1.67%;酸式洛伐他汀标准品溶液在20~100 μg/mL时呈良好的线性(r2=0.999 9),酸式洛伐他汀的平均回收率为98.50%,相对标准偏差为1.65%。因此高效液相色谱法能够简便、快捷、准确测定青稞红曲中内酯式和酸式洛伐他汀的含量。
青稞红曲;洛伐他汀;酸式洛伐他汀;高效液相色谱
青稞[1]是禾本科大麦属的一种禾谷类作物,因其内外颖壳分离,籽粒裸露,故又称裸大麦、元麦、米大麦。红曲[2]别名赤曲、丹曲、红米、福曲、红大米、红槽、红曲米,以籼米为原料,接种优质的红曲霉菌经深层发酵而成,是一种纯天然、安全性高、有益于人体健康的食品添加剂和药材[3],其中含有的洛伐他汀具有优良的降脂功能[4]。青稞红曲[5]是以禾本科植物青稞的果实为原料,接种红曲菌,经固态发酵而成的功能性红曲,具有药食兼用的特性。青稞红曲主要含有丰富的色素[6]、他汀类(主要为洛伐他汀)、γ-氨基丁酸和β-葡聚糖[7]等物质。
红曲发酵产生的洛伐他汀有酸式和内酯式两种形态[8-10],其中酸式洛伐他汀为药理活性形态,因其化学结构中开环羟基酸部分与3-羟基-3-甲基-戊二酰CoA(HMG-CoA)的化学结构十分类似,可用于胆固醇合成的早期阶段,竞争性地抑制胆固醇生物合成限速酶——HMG-CoA还原酶。因此,在评价红曲洛伐他汀含量时不能单独测定内酯的含量或者将内酯转化为酸式进行测定,应当同时测定内酯式和酸式洛伐他汀的含量,这样才能真实反映红曲中洛伐他汀的含量[11-15],对红曲的品质做出全面的评价。
1 材料与方法
1.1材料与试剂
甲醇(色谱纯):成都市科隆化学品有限公司;磷酸、乙醇(均为分析纯):成都市科龙化工试剂厂;洛伐他汀标准品(C24H36O5,99.4%,批号100600-201003)中国食品药品检定研究院;实验用水为超纯水;青稞红曲药材:西藏月王藏药有限责任公司。
1.2仪器与设备
安捷伦1260 infinity高效液相色谱(high performanceliquid chromatography,HPLC)仪,可变波长VWD检测器:安捷伦科技有限公司;BSA224S电子天平:赛多利斯科学仪器有限公司;SB-5200D超声波清洗机:宁波新芝生物科技有限公司。
1.3方法
1.3.1标准溶液制备
内酯洛伐他汀标准溶液制备:准确称取洛伐他汀标准品20.00 mg,用体积分数75%乙醇定容至100 mL,即得质量浓度为0.2 mg/mL的洛伐他汀标准贮备液。
酸式洛伐他汀标准溶液制备:准确称取洛伐他汀标准品20.00 mg,用0.2 mol/L氢氧化钠溶液定容至100 mL,在50℃条件下超声转化1 h,自然冷却至室温后静置1 h,即得质量浓度为0.2 mg/mL的酸式洛伐他汀标准贮备液[16]。
1.3.2样品溶液制备
取适量青稞红曲,粉碎,过40目筛,取筛下粉末混合均匀。准确称取约0.5 g,试样置于50 mL容量瓶中。加入30 mL体积分数75%的乙醇,摇匀,室温条件下超声提取(功率240 W,40 kHz)50 min。加体积分数75%的乙醇接近刻度,再超声10 min,冷却至室温,用体积分数75%的乙醇定容至50mL。摇匀后4 000 r/min离心10 min,取上清液过0.24 μm微孔滤膜,收集滤液用于高效液相色谱测定。
1.3.3色谱条件
色谱柱:Eclipse Plus C18柱(250 mm×4.6 mm);柱温:30℃;流动相:甲醇∶0.1%磷酸=73∶27;流速:1.0 mL/min;进样量:20 μL;紫外检测器波长:238 nm。
1.3.4方法学验证
(1)标准曲线
准确量取1.3.1中的内酯洛伐他汀标准贮备液1 mL、2 mL、3 mL、4 mL、5 mL分别于10 mL容量瓶中,用体积分数75%的乙醇稀释至刻度,制成20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的内酯洛伐他汀溶液;准确量取1.3.1中的酸式洛伐他汀标准贮备液1 mL、2 mL、3 mL、4 mL、5 mL分别于10 mL容量瓶中,用体积分数75%乙醇稀释至刻度,制成20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的酸式洛伐他汀溶液。两种溶液分别经过0.24 μm微孔滤膜过滤,取滤液,进HPLC测定。记录色谱图,以质量浓度为X轴、峰面积为Y轴,绘制标准曲线。
(2)精密度实验
分别准确吸取质量浓度为20 μg/mL的内酯洛伐他汀溶液和酸式洛伐他汀溶液,各重复进样6次(进样量20 μL)测定,记录色谱图,计算相对标准偏差(relative standard deviation,RSD)。
(3)重复性实验
取适量粉碎后的同一批次青稞红曲药材,准确称取6份,每份约0.5 g。按照1.3.2中样品溶液制备方法进行处理并测定,记录色谱图,分别计算样品中内酯洛伐他汀和酸式洛伐他汀含量及RSD。
(4)稳定性实验
取按照1.3.2中样品制备方法制备的供试品溶液,分别于0、2 h、4 h、6 h、8 h、12 h进样测定,记录色谱图,计算RSD。
1.3.5加标回收率实验
内酯洛伐他汀加标回收率实验:取适量已知含量的青稞红曲药材粉末,准确称取9份,每份约0.5 g,分别置于50 mL容量瓶中,分别加入6 mL、8 mL、10 mL按1.3.1方法配制的内酯洛伐他汀标准贮备液各3份,其余按照1.3.2处理并测定,记录色谱图,计算平均回收率。
酸式洛伐他汀加标回收率实验:取适量已知含量的青稞红曲药材粉末,准确称取9份,每份约0.5 g,分别置于50 mL容量瓶中,分别加入6.5 mL、9.0 mL、11.5 mL按1.3.1方法配制的酸式洛伐他汀标准贮备液各3份,其余按照1.3.2处理并测定,记录色谱图,计算平均回收率。
2 结果与分析
2.1标准曲线
内酯式洛伐他汀标准曲线见图1。
回收率=
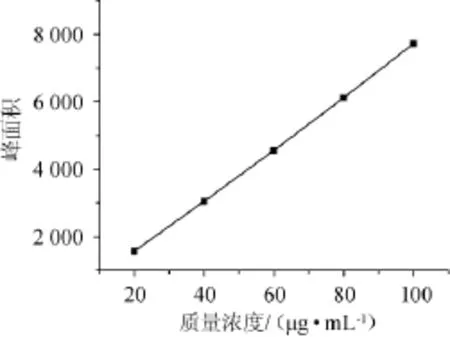
图1 内酯式洛伐他汀标准曲线Fig.1 Standard curve of lovastatin
由图1可知,内酯式洛伐他汀标准品溶液在20~100 μg/mL时呈良好的线性,标准曲线方程为y=76.872x-5.948(R2=0.999 7)。
酸式洛伐他汀标准曲线见图2。
由图2可知,酸式洛伐他汀标准品溶液在20~100 μg/mL时呈良好的线性,标准曲线方程为y=73.766x-53.678(R2=0.999)。
2.2精密度实验
方法的精密度实验结果见表1。
由表1可知,内酯洛伐他汀的对照品重复进样6次,峰面积RSD为0.52%,酸式洛伐他汀的对照品重复进样6次,峰面积RSD为0.56%,结果表明,系统精密度良好。
2.3重复性实验
方法的重复性实验结果见表2。
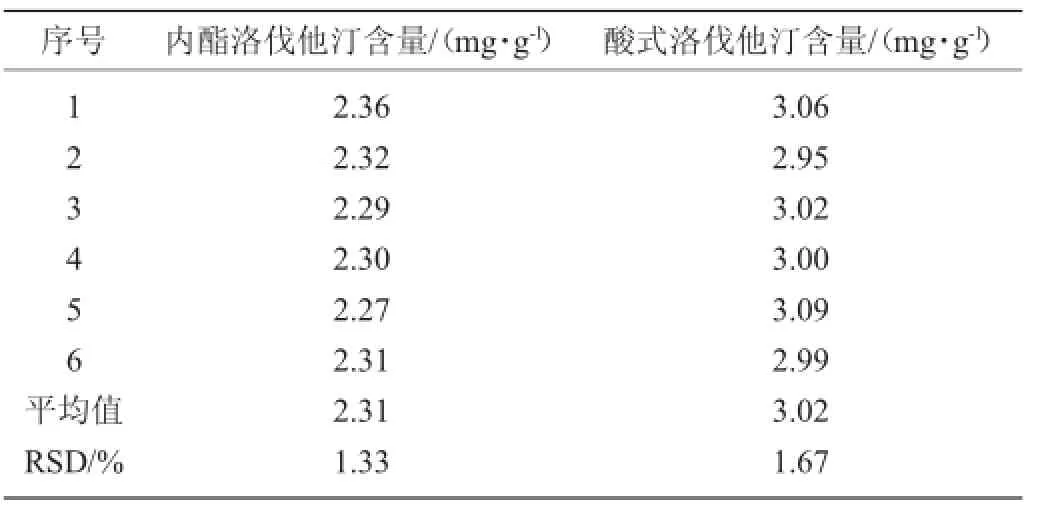
表2 方法的重复性实验结果Table 2 Repeatability results of the method
由表2可知,内酯洛伐他汀平均含量为2.31 mg/g,RSD为1.33%;酸式洛伐他汀平均含量为3.02 mg/g,RSD为1.67%。表明方法重复性良好。
2.4稳定性实验
方法的稳定性实验结果见表3。
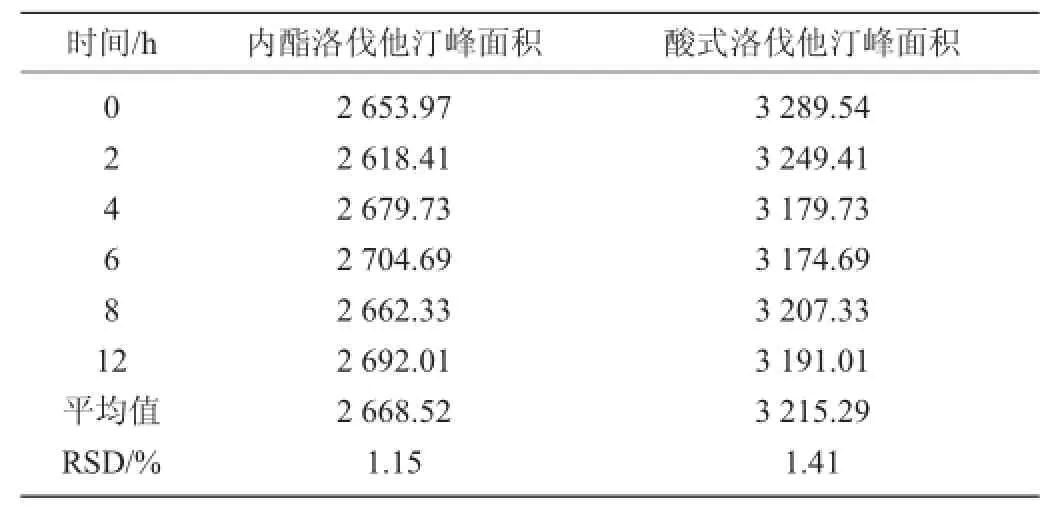
表3 方法的稳定性实验结果Table 3 Stability results of the method
由表3可知,内酯洛伐他汀峰面积的RSD为1.15%,酸式洛伐他汀峰面积的RSD为1.41%。在本实验条件下,供试品溶液在12 h内稳定。
2.5加标回收率实验
内酯洛伐他汀加标回收率实验结果见表4。
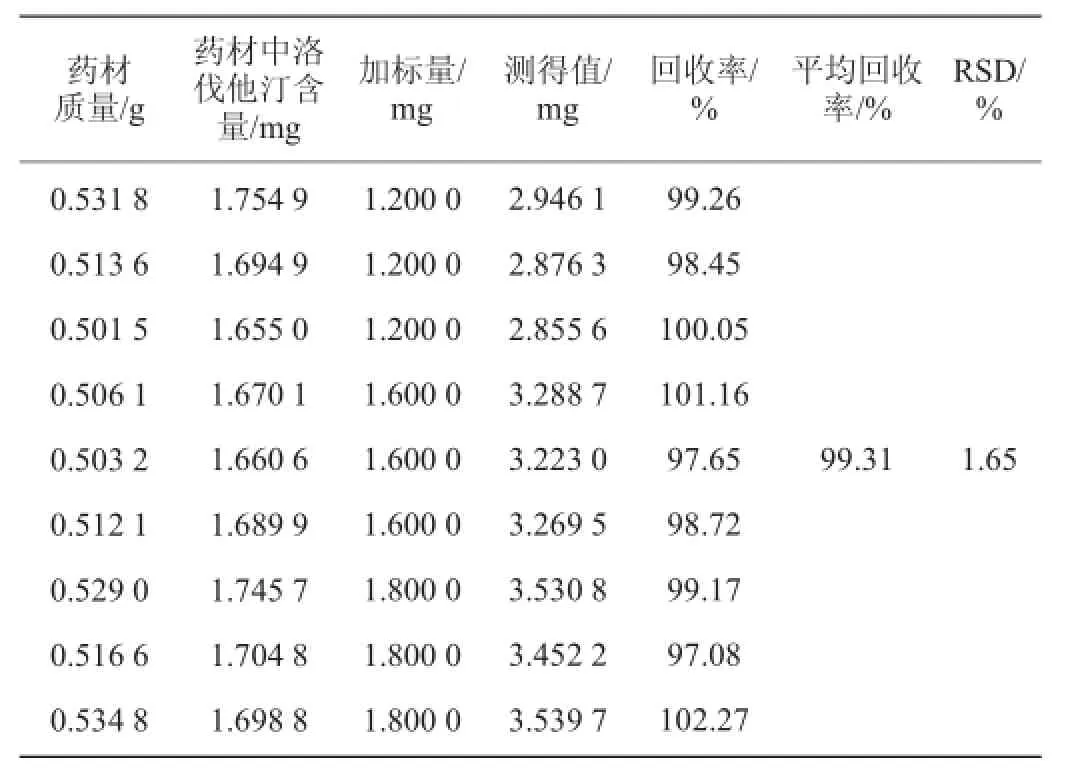
表4 洛伐他汀内酯加标回收率实验结果Table 4 Adding standard recovery results of lovastatin
由表4可知,内酯洛伐他汀的平均加标回收率为99.31%,RSD为1.65%。样品加标回收率在97.08%~102.27%,表明该方法准确度良好。
酸式洛伐他汀加标回收率实验结果见表5。
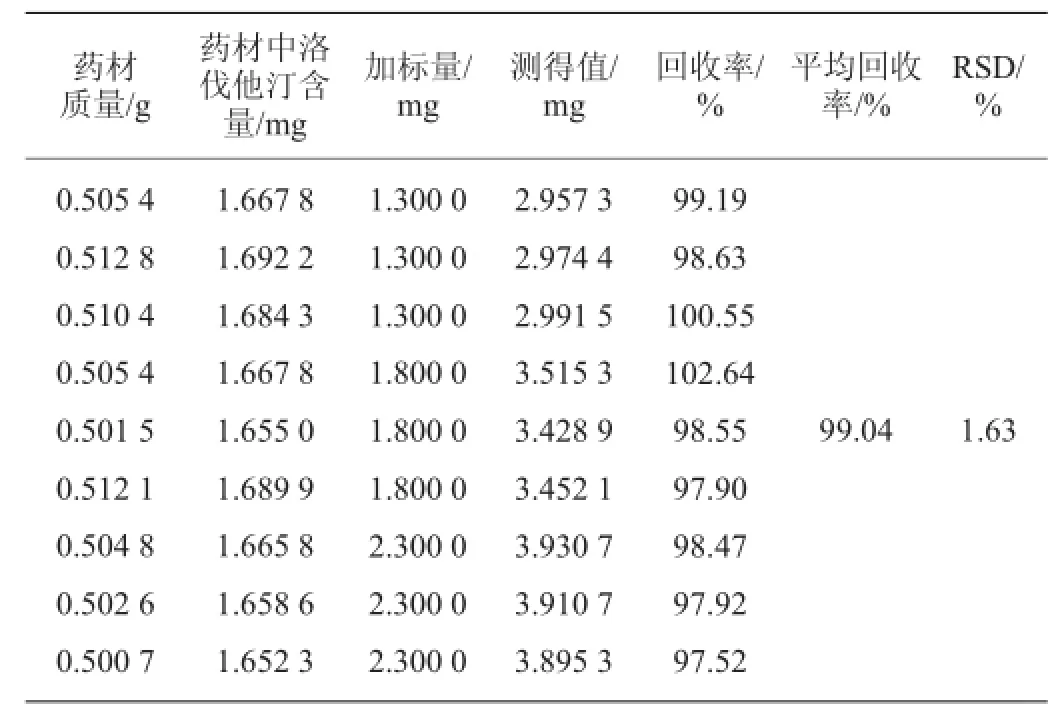
表5 酸式洛伐他汀加标回收率实验结果Table 5 Adding standard recovery results of lovastatin acid
由表5可知,酸式洛伐他汀的平均加标回收率为99.04%,RSD为1.63%。样品加标回收率在97.52%~102.64%,表明该方法准确度良好。
2.6实际样品测定结果
实际样品测定结果见表6,内酯、酸式洛伐他汀标准品色谱图及样品色谱图见图3。
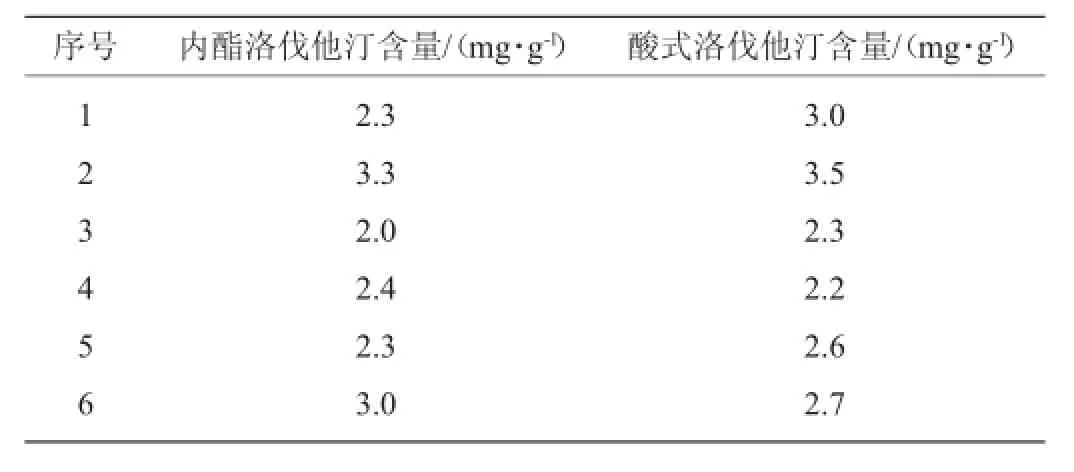
表6 实际样品测定结果Table 6 Determination results of samples
由图3可知,样品中2种洛伐他汀出峰时间和2种洛伐他汀标准品出峰时间相近,分离度良好,并且附近不存在干扰峰,表明检测结果准确。
3 结论
本文所建立的高效液相色谱法测定青稞红曲药材中内酯和酸式洛伐他汀的方法简便、快捷、结果准确,所选用的流动相毒性较低,此方法可以在青稞红曲药材片生产过程中用于洛伐他汀含量的检测和饮片质量控制。
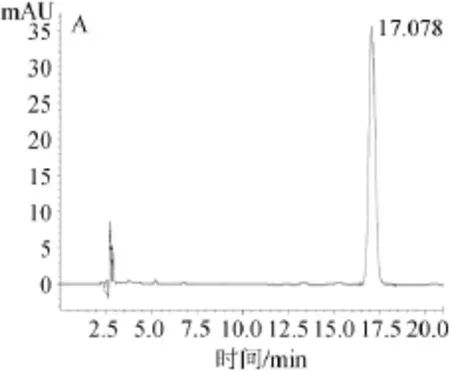
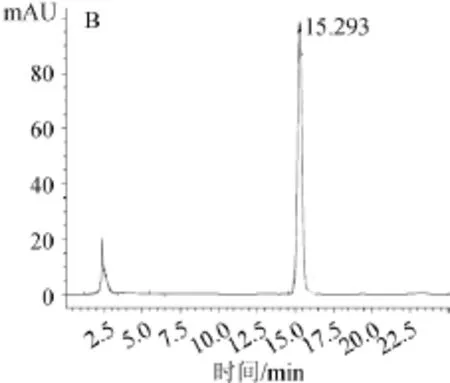
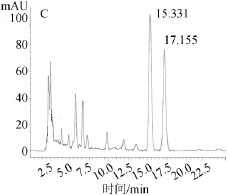
图3 内酯式洛伐他汀标准品(A)、酸式洛伐他汀标准品(B)以及样品(C)高效液相色谱图Fig.3 HPLC chromatography of lovastatin standard(A), lovastatin acid standard(B)and sample(C)
[1]臧靖巍,阚建全,陈宗道,等.青稞的成分研究及其应用现状[J].中国食品添加剂,2004(4):43-46
[2]周立平.红曲霉在中国的生产及其应用(上)[J].中国酿造,2004,23(9):1-4.
[3]周立平.红曲霉在中国的生产及其应用(下)[J].中国酿造,2004,23(10):5-7.
[4]赵秀举,刘志国.红曲洛伐他汀发酵条件优化及降脂功能[J].中国酿造,2014,33(1):32-35.
[5]周礼红,万强,刘敏,等.青稞红曲固态发酵工艺研究初探[J].中国酿造,2012,31(10):46-49.
[6]陈发贵,刘敏,熊燕,等.青稞红曲色素稳定性影响因素的分析[J].食品科技,2016,41(2):300-303.
[7]谭友莉.青稞红曲化学成分与质量标准的初步研究[D].成都:成都中医药大学,2015.
[8]姜冰洁,许赣荣,张薄博,等.降脂红曲产品质量标准的探讨[J].中草药,2015,46(3):453-456.
[9]魏巍.红曲霉发酵合成洛伐他汀的研究[D].武汉:华中科技大学,2013.
[10]张秋燕,王家龙,白鸽.红曲药材中活性成分洛伐他汀和毒性成分桔霉素的HPLC-DAD/FLD测定[J].时珍国医国药,2016,27(4):816-819.
[11]张小茜,周富荣,石济民.高效液相色谱法测血脂康胶囊及红曲中洛伐他汀的含量[J].中国中药杂志,1997,22(4):222-224.
[12]朱华,许赣荣,陈蕴.HPLC法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[13]范雯.高效液相色谱法测定红曲药材中洛伐他汀的含量[J].现代医药卫生,2013,29(16):2417-2419.
[14]张艳红,侯团章,张胜.高效液相色谱法测定红曲米中洛伐他汀的含量[J].食品科学,2001,22(7):67-69.
[15]杜方鸣,于燕梅,李洲,等.高效液相色谱法分离测定洛伐他汀及其开环酸[J].分析测试技术与仪器,2003,9(2):95-97.
[16]中华人民共和国国家发展和改革委员会.QB/T 2847—2007功能性红曲米(粉)[S].北京:中国标准出版社,2007.
Content determination of lovastatin and lovastatin acid in highland barleyMonascusby HPLC
CHEN Fagui1,2,ZHANG Dan2,LIU Min1,2,XIONG Yan1,2,ZHANG Senlin2,ZHAO Hui2*
(1.National United Engineering Research Center for Tibet Plateau Microbiology,Lhasa 850000,China; 2.Tibet Yuewang Biologic Technetronic Co.,Ltd.,Lhasa 850000,China)
Lovastatin and lovastatin acid in the highland barleyMonascuswere determined by HPLC.The sample was extracted using 75%ethanol as extraction solvent at room temperature for 1 h,then detected by HPLC method with Eclipse Plus C18column(5 μm,250 mm×4.6 mm)at column temperature 30℃,methanol-0.1%phosphate solution(73∶27)as mobile phase,flow rate 1.0 ml/min,sample quantity 20 μl and detection wavelength 238 nm.The linear range of lovastatin was 20-100 μg/ml(r2=0.9997),the mean recovery was 99.30%,and the relative standard deviation was 1.67%. While the linear range of lovastatin acid was 20-100 μg/ml(r2=0.999 9),the mean recovery was 98.50%,and the relative standard deviation was 1.65%.The HPLC method to determine the content of lovastatin and lovastatin acid in the highland barleyMonascuswas convenient,rapid and accurate.
highland barleyMonascus;lovastatin;lovastatin acid;HPLC
O657.7
0254-5071(2016)10-0162-04
10.11882/j.issn.0254-5071.2016.10.036
2016-07-16
陈发贵(1988-),男,本科,研究方向为微生物生物发酵工程。
赵辉(1969-),男,高级工程师,硕士,研究方向为发酵工程、工商行政管理。
