重组蛋白表达技术的研究进展
2016-12-03苏鹏龚国利
苏鹏,龚国利*
(陕西科技大学食品与生物工程学院,陕西西安710021)
重组蛋白表达技术的研究进展
苏鹏,龚国利*
(陕西科技大学食品与生物工程学院,陕西西安710021)
当前用于药物生产的分子主要为蛋白小分子,大量的高纯度蛋白无法直接获得,而重组蛋白技术能解决这一难题。该文综述了真核、原核、无细胞以及其他蛋白表达系统在重组蛋白表达方面的研究进展,对于探索选择合适的重组蛋白表达系统以及未来药物研发具有重要意义。
重组蛋白;大肠杆菌;真核表达;研究进展
随着遗传学、基因组学以及蛋白组学的发展,重组功能性蛋白的市场需求急剧加大,而其首要条件是获得大量高度纯化且正确折叠的蛋白质[1],以便后续对其结构、功能及相互作用进行系统分析,实现功能性蛋白产品的商业化。然而从原始有机来源或化学合成方法获得大量高纯度蛋白几乎不可能,并且蛋白来源成分复杂、理化性质各异、结构功能多样,蛋白质的纯化一直是结构蛋白质组学研究与生物技术产品开发中的一个瓶颈问题,严重制约了后续功能蛋白质的产品化,因此重组蛋白技术不可或缺。本文对一些常见的外源基因表达系统(包括原核表达系统、真核表达系统、无细胞表达系统以及其他表达系统)进行了综述,对每个表达系统自身的优势进行总结,以期在对何选择表达系统以及提高蛋白表达量上有所突破。
1 原核表达系统
1.1大肠杆菌表达系统
外源蛋白在原核宿主内重组表达时,转录后修饰缺乏糖基化和磷酸化作用(见表1),并且原核细胞质不是形成复杂二硫键的合适场所,导致外源蛋白在原核细胞质中的表达尤为困难。然而,大肠杆菌(Escherichia cole)遗传背景清楚、繁殖快、成本低、表达量高、2H/13C/15N同位素标记技术稳定以及适用范围广等优点,外源蛋白的表达依然使用。近年来市售的大约30%的重组蛋白产品是由大肠杆菌生产[2]。当蛋白分子质量<100 ku,翻译后修饰作用不影响特定结构和生物活性时,大肠杆菌表达系统是首要选择。但利用大肠杆菌表达系统生产药用蛋白时,存在外源蛋白表达水平低、易形成不溶性包涵体以及表达易泄露等缺点,针对这些问题采取相应措施可优化其表达系统。
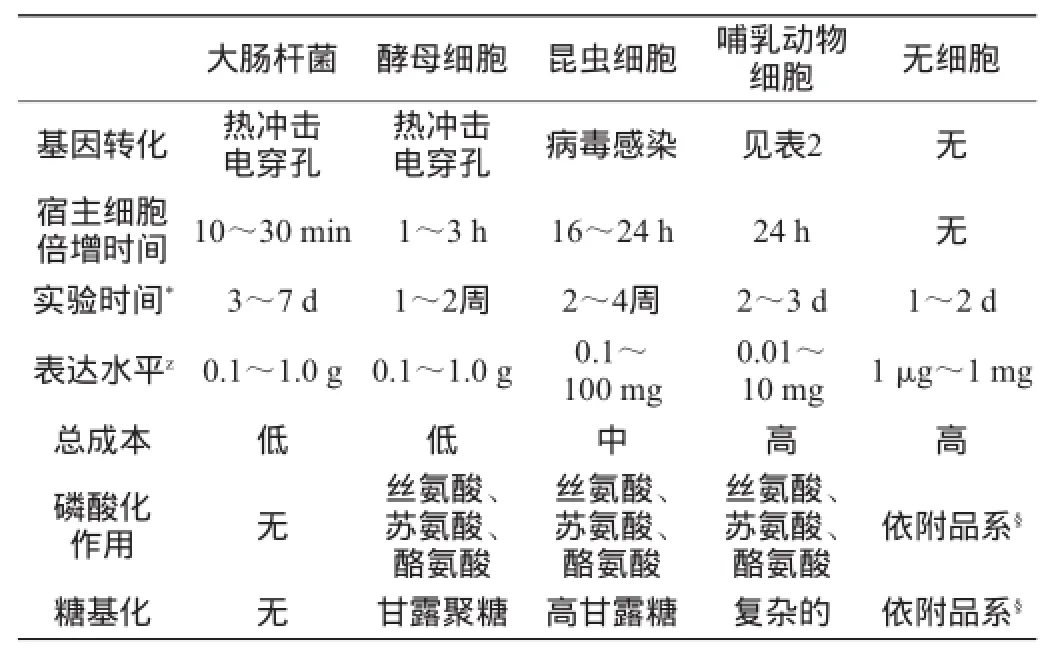
表1 外源蛋白表达系统的差异Table 1 Difference of heterologous protein expression systems
一方面,可根据宿主偏爱性优化互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)密码子及互联网程序已开发出来协助密码子优化、采用能为目标基因提供稀有密码子并可共表达的大肠杆菌、将pCold载体与增溶标签融合,找到使pCold系统作用最大化的增溶标签或将蛋白融合[3]和纯化的“融合标签”措施均可提高外源蛋白表达水平[4-6]方面,如果外源蛋白易形成不可溶的聚集物,温度调节为20~30℃或采取低营养物质能使基因的转录翻译被减弱,靶标蛋白适当折叠,溶解性提高[7],可降低不溶性包涵体形成;此外,抑制泄露表达也对其有利,如当质粒转化大肠杆菌时,往培养基中添加葡萄糖0.5%~1.0%,T7 RNA聚合酶泄漏表达可被抑制,质粒的稳定性提高;另一种方法是通过与T7溶菌酶共表达抑制T7RNA聚合酶泄漏活性,T7溶菌酶是T7RNA聚合酶天然抑制剂。大肠杆菌(Escherichia coli)宿主菌株与葡萄糖诱导性代谢物阻遏剂的联合使用可有效表达目标蛋白、质粒的低拷贝数等都是抑制泄露表达的好方法。
除此之外,单一蛋白生产技术、自动诱导、高细胞密度培养、流加培养等方法在提高原核系统表达外源蛋白上也有不可忽略的作用。
1.2乳酸乳球菌表达系统
乳酸菌是革兰氏阳性菌,膜单一,在大量膜蛋白的表达方面提供了革兰氏阴性菌无法比拟的优势,原因是革兰氏阴性菌具有内外膜并覆盖着厚厚的、刚性的肽聚糖层的内表面周质空间[8],影响蛋白质的表达,而蛋白在乳酸乳球菌(Lactococcus lactis)中的表达是通过融合Mistic到目标膜蛋白而加以改善[9],提高其表达量。
1.3芽孢杆菌表达系统
芽孢杆菌(Bacillus)也属于革兰氏阳性菌。桥石短芽孢杆菌(Brevibacillus choshinensis)和枯草芽孢杆菌(Bacillus subtilis)表达系统由Takara、MoBiTec公司开发与提供。芽孢杆菌能过表达并且能分泌外源蛋白到培养基中,这适合分泌型蛋白的生产,如细胞因子或需要形成复杂二硫键的外源蛋白。这个系统也被用来生产2H/13C/15N同位素标记的外源蛋白,用于溶液核磁共振研究[10]。
2 真核表达系统
2.1酵母表达系统
酵母是一种真核微生物,其细胞有表达外源蛋白的能力,可以达到一个相当高的胞密度状态,在酵母中表达外源蛋白可以进行翻译后修饰,如磷酸化和糖基化。由于酵母宿主细胞结合了细菌和高阶生物宿主细胞表达系统的优良特性,当外源蛋白未能成功地在大肠杆菌中表达时,它是一个不错的选择(见表1)。酵母能在pH值为4~7的范围内生存,但不能在易导致蛋白质变性或聚集的pH值条件下分泌外源蛋白。充足的碳源和通气是酵母细胞生长和蛋白表达的关键[11],能实现高速搅拌和连续供气效率的最大化,但搅拌产生的气泡会破坏宿主细胞,所以消泡剂的添加必不可少。
用于外源蛋白表达的酵母菌株包括酿酒酵母(Schizosaccharomyces pombe)、粟酒裂殖酵母(Schizosaccharomyces pombe)、毕赤酵母(Pichia pastoris)和乳酸克鲁维酵母(Kluyveromyces lactis)。甲基营养型毕赤酵母可增强AOX启动子活性,当一个兴趣基因位于AOX启动子下游时,可以在培养基中加入甲醇诱导外源蛋白的表达[12]。利用乳酸克鲁维酵母来表达外源蛋白时,可被LAC4启动子调控,LAC4启动子可通过在培养基添加半乳糖来激活。因此,培养基中的半乳糖作为碳源来培养转化株,外源蛋白的表达和细胞生长同步进行。人血清白蛋白(human serum albumin,HSA),麦芽糖结合蛋白(maltose-binding protein,MBP),谷胱甘肽-S-转移酶(glutathione S-transferase,GST)和小泛素相关修饰蛋白(small ubiquitin modifier,SUMO)被用作酵母表达系统的融合标签[13]。缺少半胱氨酸残基的MBP可以用作增溶标签在细胞质或分泌物间协调表达。采用毕赤酵母和乳酸克鲁维酵母作为异源表达的2H/13C/15N同位素标记技术已被开发[14]。
2.2昆虫细胞表达系统
膜蛋白、大分子质量蛋白和蛋白激酶这些很难用细菌表达系统表达的蛋白,在Sf9或High-5等昆虫细胞中实现了表达[15]。
在大多数昆虫细胞表达系统中,外源基因通过杆状病毒载体转染宿主细胞,含有目标基因的标记盒通过同源重组并入宿主基因组中(表1)。为构建杆状病毒载体,市面上提供了Bac-to-Bac,baculogold,bacpak和bacmagic等,将目的基因或不同基因的多拷贝整合到宿主基因能实现对多个靶蛋白实现共表达[16]。最近的MultiBac系统实现了在昆虫宿主细胞内协助多蛋白复合物的表达[17]。用于昆虫细胞表达系统的增溶标签包括GST和SUMO,外源蛋白的2H/13C/15N同位素标记也可使用昆虫宿主细胞[18]。
2.3哺乳动物细胞表达系统
高创造性思维是观念、思维、联想、表达、变通能力的体现。本研究显示,舰艇军人高创造性思维水平人数占15.8%,一般创造性思维水平占84.2%,符合常态分布。流畅力、开放力、变通力、独创力及标题5个维度A、C组差异有统计学意义。 C组不成熟防御方式平均分显著高于A组,成熟防御方式平均分显著低于A组,这提示高创造性思维水平更多的使用成熟的防御方式,在应用不成熟的防御方式人群中其创造性思维水平低于应用成熟防御方式。
当含有复杂二硫键或翻译后修饰的靶蛋白不能使用其他表达系统表达时,哺乳动物细胞可表达外源蛋白(表1)。常用的外源蛋白表达的哺乳动物细胞系包括海拉(Hela)细胞、人胚肾细胞(HEK293)和中国仓鼠卵巢细胞(CHO)。哺乳动物细胞的各种异源基因转染方法总结见表2[19]。外源蛋白的成功生产,重要的是选择合适的转染方法。如果兴趣蛋白通过与其他分子或翻译后修饰形成的配合物证实有生物活性是形成分子复合物所需的,则复合物可以纯化。这些复合物也可以用昆虫宿主细胞产生。复杂分子的三维结构可以通过X射线晶体学或电子的微观结构分析。然而有时候消除在处理糖基化酶时可能在分子配合物中出现的糖链是更可取的,这是由于异源糖链可以干扰结晶或后续的结构分析[20]。与其他系统相比哺乳动物宿主细胞的缺点包括外源蛋白表达能力较差、成本高,尤其是产生2H/13C/15N同位素标记的外源蛋白。

表2 哺乳动物细胞的异源基因转染方法的特点Table 2 Characteristics of heterologous gene transfection methods of mammalian cells
增溶标签已被用于哺乳动物宿主细胞的外源蛋白表达,包括GST,SUMO和卤代烷脱卤素酶(HaloTag)[21]。外源蛋白的硒代蛋氨酸标记和同位素标记可分别用于哺乳动物细胞表达系统的结晶相和核磁共振测量[22]。
3 无细胞表达系统
在无细胞蛋白的合成中,通过混合cDNA或信使核糖核酸(messenger ribonucleic acid,mRNA)编码靶蛋白和细胞提取物(含有核糖体和其他蛋白质生物合成所需的分子体系)实现目标多肽在试管中翻译,提取物来源于大肠杆菌、小麦胚芽、昆虫细胞和哺乳动物细胞(来自兔子镰状红细胞或CHO细胞)。主流的无细胞(cell free,CF)表达策略为分层、分批提供新鲜组分到混合物中,消除混合物中副产物。在分批处理时,mRNA编码的蛋白连续注入反应物中,这可以提高产量,特别是当反应时间长、反应规模大时,并且存在裂解液中核糖核酸酶使靶标mRNA降解可能性增加。
无细胞蛋白合成系统能够表达其他表达系统很难表达的蛋白,如毒性蛋白、膜整合蛋白、生物活性肽,并有一些优点:1)共表达的蛋白复合物明确;2)高通量特性;3)全自动化[23]。此外,能更好的生产需要二硫键形成的外源蛋白,因为裂解物的氧化还原条件可使用添加剂或改变还原剂/氧化剂的比例进行调节[24]。用于CF反应的大肠杆菌裂解物组分可以根据单系统的实验目的设计[25]。
CF表达系统可将化学修饰的氨基酸整合到蛋白质所需的位置,因为它具有简洁的基因翻译工具和代谢稳定的特点[26]。蛋白表达过程中增加转氨酶和氨基酸合成酶抑制剂或硼氢化钠(NaBH4)抑制其不规则性[27]。2H/13C/15N同位素标记的氨基酸样品可以使用CF表达系统制备。此外,一种新的氨基酸和特定同位素标记技术已被MIYANOIRI Y等[28]发展,这种技术被称为立体阵列同位素标记(stereo array isotope labeling,SAIL)。用SAIL技术,先前分子质量限制不能进行的蛋白质核磁共振研究现在已经得到认可,同时该方法可得到简化光谱,增加了核磁共振(nuclear magnetic resonance,NMR)信号的敏感性[28]。
CF表达系统适用于膜蛋白的生产,溶解的膜蛋白在含有洗涤剂的CF反应混合物中的表达可以重组到脂质双分子层中如脂质体、双层细胞和奈米圆盘[29]。在这个过程中,在附带脂质清洁剂交换程序下,自发的共转化和翻译后修饰方法被使用。CF表达系统的易操作和高通量特性,能够用于膜蛋白最佳增溶条件的筛选[30],缺点是不适合大量蛋白质的生产,因为蛋白表达水平比活宿主细胞的低,成本昂贵。
4 其他蛋白质表达系统
植物细胞表达系统已被开发,利用烟草BY-2来作为宿主细胞,可生产出13C/15N同位素标记的外源蛋白,还可通过溶液NMR法成功地测定蛋白质的三级结构[31]。此外,几种不同的重组蛋白表达系统也相继被开发,如原生动物或真菌重组蛋白表达系统[32]。
5 总结与展望
综上所述,获得具有天然结构和足够多的生物功能的蛋白质,以及发现新型蛋白分子对于实现药物发现新突破尤为重要。重组蛋白技术使蛋白分子功能得以改善,蛋白纯度有效提高。原核表达系统、真核表达系统、无细胞表达系统以及其他蛋白生产方法的应用,虽然尚存缺点,但其独有的优势应该加以利用。另外同位素标记技术以及核磁共振技术的结合,使活细胞分子以及蛋白结构测定的生物学分析迈上新台阶,这将更有利于药物研发[33]。目前重组蛋白的表达和纯化技术仍然需要克服困难并在研究过程中积累经验,及时汲取相关领域的研究进展,找出重组蛋白的制约因素,对症下药。随着基因工程技术以及蛋白质组学的发展,重组蛋白技术将会越来越成熟,作为药物分子的靶标蛋白将会有新的突破。
[1]LICHTY J J,MALECKI J L,AGNEW H D,et al.Comparison of affinity tags for protein purification[J].Protein Expres Purif,2011,41(1):98-105.
[2]FERRERMIRALLES N,DOMINGOESP N J,CORCHERO J L,et al. Microbial factories for recombinant pharmaceuticals[J].Microb Cell Factor,2009,8(2):17-17.
[3]HAYASHI K,KOJIMA C.pCold-GST vector:A novel cold-shock vector containing GST tag for soluble protein production[J].Protein Expres Purif,2008,62(1):120-127.
[4]PEI Z,WAGNER G.Overcoming the solubility limit with solubility-enhancement tags:successful applications in biomolecular NMR studies[J]. J Biomol Nmr,2010,46(1):23-31.
[5]YOUNG C L,BRITTON Z T,ROBINSON A S.Recombinant protein expression and purification:A comprehensive review of affinity tags and microbial applications[J].Biotechnol J,2012,7(5):620-34.
[6]GOPAL G J,KUMAR A.Strategies for the production of recombinant protein inEscherichia coli[J].Int J Prod Res,2013,32(6):1-17.
[7]OVERTON T W.Recombinant protein production in bacterial hosts[J]. Drug Discov Today,2013,19(5):590-601.
[8]CHEN R.Bacterial expression systems for recombinant protein production:E.coli,and beyond[J].Biotechnology Advances,2011,30(5):1102-1107.
[9]XU Y,KONG J,KONG W.Improved membrane protein expression in Lactococcus lactisby fusion to mistic[J].Microbiology,2013,159(6): 1002-1009.
[10]TANIO M,TANAKA R,TANAKA T,et al.Amino acid-selective isotope labeling of proteins for nuclear magnetic resonance study:Proteins secreted byBrevibacillus choshinensis[J].Anal Biochem,2009,386(2): 156-160.
[11]SUGIKI T,ICHIKAWA O,MIYAZAWA-ONAMI M,et al.Isotopic labeling of heterologous proteins in the yeastPichia pastorisandKluyveromyces lactis[J].Methods Mol Biol,2012,83(1):19-36.
[12]GELLISSEN G.Heterologous protein production in methylotrophic yeast[J].Appl Microbiol Biotechnol,2000,54(6):741-50.
[13]WU M,LIU W,YANG G,et al.Engineering of aPichia pastorisexpression system for high-level secretion of HSA/GH fusion protein[J].Appl Biochem Biotechnol,2014,17(2):2400-2411.
[14]MIYAZAWA-ONAMI M,TAKEUCHI K,TAKANO T,et al.Perdeuteration and methyl-selective(1)H,(13)C-labeling by using aKluyveromyces lactisexpression system[J].Biomol NMR,2013,57(3):297-304.
[15]MAEDA S,SCHERTLER G F.Production of GPCR and GPCR complexes for structure determination[J].Curr Opin Struct Biol,2013,23 (3):381-392.
[16]CREMER H,BECHTOLD I,MAHNKE M,et al.Efficient processes for protein expression using recombinant baculovirus particles[J].Methods Mol Biol,2014,110(4):395-417.
[17]BIENIOSSEK C,IMASAKI T,TAKAGI Y,et al.MultiBac:expanding the research toolbox for multiprotein complexes[J].Trends Biochem Sci,2012,37(2):49-57.
[18]KOFUKU Y,UEDA T,OKUDE J,et al.Efficacy of the beta2-adrenergic receptor is determined by conformational equilibrium in the transmembrane region[J].Nature Commun,2012,104(3):1-9.
[19]SUGIKI T,FUJIWARA T,KOJIMA C.Latest approaches for efficient protein production in drug discovery[J].Expert Opin Drug Discov, 2014,9(10):1-16.
[20]ARICESCU A R,OWENS R J.Expression of recombinant glycoproteins in mammalian cells:towards an integrative approach to structural biology[J].Curr Opin Struct Biol,2013,23(3):345-356.
[21]OHANA R F,HURST R,VIDUGIRIENE J,et al.HaloTag-based purification of functional human kinases from mammalian cells[J].Protein Expr Purif,2011,76(2):154-164.
[22]SASTRY M,BEWLEY C A,KWONG P D.Mammalian expression of isotopically labeled proteins for NMR spectroscopy[J].Adv Exp Med Biol,2012,99(2):197-211.
[23]BEEBE E T,MAKINO S,NOZAWA A,et al.Robotic large-scale application of wheat cell-free translation to structural studies including membrane proteins[J].Biotechnol,2011,28(3):239-249.
[24]MICHELE,WÜTHRICHK.Cell-free expression of disulfide-containing eukaryoticproteinsforstructuralbiology[J].FEBS,2012,279(17):3176-3184.
[25]SHIMIZU Y,KURUMA Y,KANAMORI T,et al.The PURE system for protein production[J].Methods Mol Biol,2014,111(8):275-284.
[26]YOKOYAMA J,MATSUDA T,KOSHIBA S,et al.A practical method for cell-free protein synthesis to avoid stable isotope scrambling and dilution[J].Anal Biochem,2011,411(2):223-229.
[27]SU X C,LOH C T,QI R,et al.Suppression of isotope scrambling in cell-free protein synthesis by broadband inhibition of PLP enymes for selective 15N-labelling and production of perdeuterated proteins in H2O [J].Biomol NMR,2011,50(1):35-42.
[28]MIYANOIRI Y,TAKEDA M,KAINOSHO M.Stereo-array isotope labeling method for studying protein structure and dynamics[J].Adv Exp Med Biol,2012,99(2):83-93.
[29]MAZHAB-JAFARIMT,MARSHALLCB,STATHOPULOSP B,et al. Membrane-dependent modulation of the mTOR activator Rheb:NMR observations of a GTPase tethered to a lipid-bilayer nanodisc[J].Am Chem Soc,2013,135(9):3367-3370.
[30]ISAKSSON L,ENBERG J,NEUTZE R,et al.Expression screening of membrane proteins with cell-free protein synthesis[J].Protein Expr Purif,2012,82(1):218-25.
[31]OHKI S,TAKEUCHI M,MORI M.The NMR structure of stomagen reveals the basis of stomatal density regulation by plant peptide hormones [J].Nature Commun,2011,2(1):487-502.
[32]FERNÁNDEZ F J,VEGA M C.Technologies to keep an eye on:alternative hosts for protein production in structural biology[J].Curr Opin Struc Biol,2013,23(3):365-73.
[33]TOCHIO H.Watching protein structure at work in living cells using NMR spectroscopy[J].Curr Opin Chem Biol,2012,16(5-6):609-613.
Research progress on the recombinant protein expression technology
SU Peng,GONG Guoli*
(School of Food and Biological Engineering,Shaanxi University of Science&Technology,Xi'an 710021,China)
At present,the molecules used in drug production are mainly small molecules.A large amount of proteins with high purity cannot be obtained directly,but the recombinant protein technology can solve this problem.The research progress of eukaryon,protokaryon,acellular and other protein expression system in the recombinant protein expression was summarized,which had important significance for choosing the appropriate expression system to express proteins and development of drugs in the future.
recombinant protein;Escherichia coli;eukaryotic expression;research progress
Q786
0254-5071(2016)10-0009-04
10.11882/j.issn.0254-5071.2016.10.003
2016-06-17
国家自然科学基金项目(20906085);陕西科技大学学术骨干培育计划项目(XSG2010009)
苏鹏(1991-),男,硕士研究生,研究方向为中药生物技术。
龚国利(1976-),男,教授,博士,研究方向为食品微生物技术。
