α-菠菜甾醇对小鼠小肠段药物转运体P-gp和PEPT1表达的影响
2016-11-28吴丽娜李英伦
吴丽娜,赵 玲,叶 刚,李英伦
(四川农业大学 动物医学院,四川 成都 610000)
α-菠菜甾醇对小鼠小肠段药物转运体P-gp和PEPT1表达的影响
吴丽娜,赵 玲,叶 刚,李英伦*
(四川农业大学 动物医学院,四川 成都 610000)
以酒石酸泰乐菌素为底药,探讨α-菠菜甾醇对小鼠小肠段药物转运体P-gp和PEPT1表达的影响。48只小鼠分为4组:α-菠菜甾醇组,酒石酸泰乐菌素组,α-菠菜甾醇和酒石酸泰乐菌素混合组,生理盐水对照组。每组按0.2 mL·10 g-1体质量的剂量每天灌胃一次,共灌胃5 d,分别在1,3,5 d后处死1批采样。采用免疫组化的方法测定1,3,5 d的小鼠肠道上P-gp和PEPT1的表达。试验结果表明,α-菠菜甾醇组和混合组相对于对照组外排性药物转运体P-gp表达减少,而摄取性药物转运体PEPT1表达增多;酒石酸泰乐菌素组的外排性药物转运体P-gp表达增多,摄取性药物转运体PEPT1表达减少;且都随着用药时间的延长差异增大。表明α-菠菜甾醇具有抑制药物转运体P-gp表达和促进药物转运体PEPT1表达的作用。
α-菠菜甾醇;小鼠;药物转运体;P-gp;PEPT1
药物在体内的转运过程,包括吸收、分布、代谢,这些都涉及药物对生物体膜的通透。在这些生物膜上存在着特殊的转运蛋白系统来介导药物的跨膜转运,称之为药物转运体。近年来,随着分子生物学的发展,越来越多的目光关注到了药物转运体上。药物转运体一般表达于各组织的特定细胞膜上,执行着特定的转运任务。口服药物在肠道里的吸收不仅仅是简单的被动转运,还能通过肠上皮细胞黏膜的药物转运体跨膜转运。肠上皮细胞存在着多种转运体,它们在药物的吸收过程中扮演着非常重要的角色。根据转运底物跨膜转运方向的不同,将药物转运体分为摄取性转运体和外排性转运体[1]。在外排性转运体中,P-糖蛋白(p-glycoprotein,P-gp)由mdr1基因编码[2],170 ku,是最早发现的ATP结合盒转运蛋白[3],此蛋白大多表达于肠道上皮细胞顶端[4];摄取性转运体H+偶联PEPT1是目前研究较为深入、应用较为广泛的转运体之一。寡肽转运体PEPT1主要表达在小肠刷状缘膜上[5],从小肠近端到远端表达逐渐增加。基于定位,P-gp和PEPT1对口服药物的吸收和分布起着重要的调节作用,是决定一些药物口服生物利用度至关重要的因素。
口服药物的生物利用度即是其在肠道的吸收速度和程度,肠道里的转运蛋白P-gp对许多药物的吸收存在外排现象,加强对P-gp抑制剂的研究是非常必要的。随着P-gp作用机制及药物构效关系研究的深入,对P-gp抑制剂的研究也逐步完善,迄今,P-gp抑制剂已经发展到第3代[6]。随着目光投向中药成分,越来越多的研究倾向于在植物单体中寻找好的P-gp抑制剂[7-8]。而关于PEPT1的抑制或促进研究虽不及P-gp,但也有研究显示冰片可以改变PEPT1的底药更昔洛韦的组织分布[9]。植物药中的植物甾醇近年来越来越多地出现在人们的视野中,α-菠菜甾醇作为其中的一种,具有抗炎、抗肿瘤、抗癌等作用[10-11],而α-菠菜甾醇的机理研究尚少,因α-菠菜甾醇无毒和丰富的药理活性,且化学药物结构明晰,便于检测,本实验室在前期的研究中,将桔梗中提取的α-菠菜甾醇和泰乐菌素联用,采用高效液相色谱法,研究了桔梗中α-菠菜甾醇对酒石酸泰乐菌素药动学参数的影响。发现同时灌服α-菠菜甾醇和酒石酸泰乐菌素时可使酒石酸泰乐菌素的血药浓度达峰时间提前,说明联用加快了酒石酸泰乐菌素的吸收速度。同时,联用时α-菠菜甾醇显著改变酒石酸泰乐菌素在小鼠体内的药动学参数,即产生了药物-药物间的相互作用(DDI)。DDI由哪些转运体介导,其机制是什么?本实验在上述研究基础上,拟探究α-菠菜甾醇与肠道上转运体的关系,旨在揭示联合用药时α-菠菜甾醇提高口服药物吸收的机理。
1 材料与方法
1.1 实验动物
SPF级昆明小鼠,雌雄兼用,体质量为18~22 g ,由简阳达硕动物科技有限公司提供,编号为SCXK(川)2014-24。
1.2 主要试剂与药品
α-菠菜甾醇,含量≥98%(慕远,中国上海);酒石酸泰乐菌素,含量98%(普洛康裕,中国浙江);SABC试剂盒,DAB显色试剂盒,苏木素染液和生物素标记羊抗鼠IgG(博士德,中国武汉);Anti-PEPT1(A0848),Anti-P-glycoprotein(GR167860-3)(Covance,美国)。
1.3 样本的采集和处理
48只小鼠随机分为4组,雌雄各半,饲喂正常饲料的同时,每组按0.2 mL·10 g-1体质量的剂量每天灌胃1次,连续灌胃5 d。T1组为α-菠菜甾醇组(12.5 mg·kg-1体质量),T2组为α-菠菜甾醇和酒石酸泰乐菌素的混合组(12.5 mg·kg-1体质量+600 mg·kg-1体质量),T3组为酒石酸泰乐菌素组(600 mg·kg-1体质量),T4组为生理盐水组。分别在1 d(24 h),3 d(72 h),5 d(120 h)3个时间点每组各处死2只雌鼠和2只雄鼠,迅速采集十二指肠、空肠、回肠,用生理盐水冲洗,样品修剪后固定于波音(Bouin)试剂,用石蜡包埋。
1.4 免疫组织化学方法检测P-gp和PEPT1在肠道中的表达
将切片用二甲苯脱蜡,通过梯度酒精,用蒸馏水和磷酸盐缓冲液(PBS)洗涤,然后3%过氧化氢15 min,封闭内源性过氧化物。将组织切片用微波炉进行抗原修复过程。PBS洗涤,一抗稀释100~200倍,在4 ℃下过夜。所使用的一抗是抗P-gp 和抗PEPT1的。将PBS代替一抗,用于阴性对照。洗涤后,滴加二抗,山羊抗鼠IgG(ZSGB-BIOSP试剂盒)37 ℃处理1 h。切片浸入盐酸二氨基联苯胺(DAB)。通过显微镜监测反应,出现褐色染色浸入蒸馏水停止。切片轻轻用苏木素复染,在乙醇中脱水,在二甲苯中清除并封片。
通过使用连接到光学显微镜(Olympus AX70)的计算机成像系统计数。然后,P-gp和PEPT1阳性表达数通过Image-Pro+ 5.1(美国)图像分析软件进行定量。每组每个样取5个视野(照5张照片,4个角和中央),测5个视野的平均值。
1.5 数据统计与分析
应用SPSS 19.0软件对均数进行单因素方差分析(One-way ANOVA),结果以平均数±标准差表示。
2 结果与分析
2.1 P-gp和PEPT1在每组中的表达
2.1.1 P-gp表达的强弱
在高倍镜下(图1),T1(α-菠菜甾醇组)和T2(混合组)的阳性颗粒表达强度低于T4(生理盐水组)(P<0.05),T3(泰乐菌素组)阳性表达强于其他组(P<0.05)。且趋势随用药时间延长越来越明显(表1)。总体来说,有α-菠菜甾醇参与的小组,P-gp的表达受到抑制,T1与T2组相比无特异性差异,而与P-gp表达被促进的泰乐菌素组相比,差异极显著(P<0.01)。说明α-菠菜甾醇有抑制P-gp表达的效果。

a, T1组(α-菠菜甾醇组);b, T2组(混合组);c, T3组(泰乐菌素组);d, T4组(生理盐水组)。箭头所指示的为阳性表达图1 不同组别的P-gp第5天在十二指肠中的表达Fig.1 The expression of P-gp in different groups in duodenum on the fifth day
表1 肠道P-gp蛋白的阳性细胞表达强度
Table 1 The intensity of positive cells containing P-gp protein in intestine

用药时间/dT1T2T3T410.93±0.15cB0.88±0.16cB1.70±0.64aA1.27±0.43bAB30.91±0.17cB0.91±0.16cB2.00±0.25aA1.12±0.20bB50.57±0.15cB0.55±0.15cB2.58±0.80aA1.12±0.12bB
注:同行数据后无相同小写字母表示差异显著(P<0.05),无相同大写字母表示差异极显著(P<0.01)。下同。
2.1.2 PEPT1表达的强弱
与P-gp结果恰好相反,在高倍镜下(图2),T1(α-菠菜甾醇组)和T2(混合组)的PEPT1阳性表达强于T4(生理盐水组)(P<0.05),T3(泰乐菌素组)阳性表达低于T4组(P<0.05),且极显著(P<0.01)低于T1(α-菠菜甾醇组)和T2(混合组)。总体来说,有α-菠菜甾醇参与的小组,PEPT1的表达被促进,2组间差异不明显。但通过与PEPT1表达被抑制的泰乐菌素组对比,差异极显著(P<0.01),更能说明α-菠菜甾醇有促进PEPT1表达的效果。
2.2 P-gp和PEPT1在每组不同肠道中的表达
2.2.1 P-gp在不同肠道的表达
P-gp在十二指肠上的差异变化相对于空肠和回肠较为明显。处理3,5 d,泰乐菌素组(T3)在各肠段显著(P<0.05)上调了P-gp的表达。有α-菠菜甾醇参与的小组(T1和T2)在各肠段都下调了P-gp的表达。总体来看,各肠道每段的差异随用药时间延长而越发明显。
2.2.2 PEPT1在不同肠道的表达
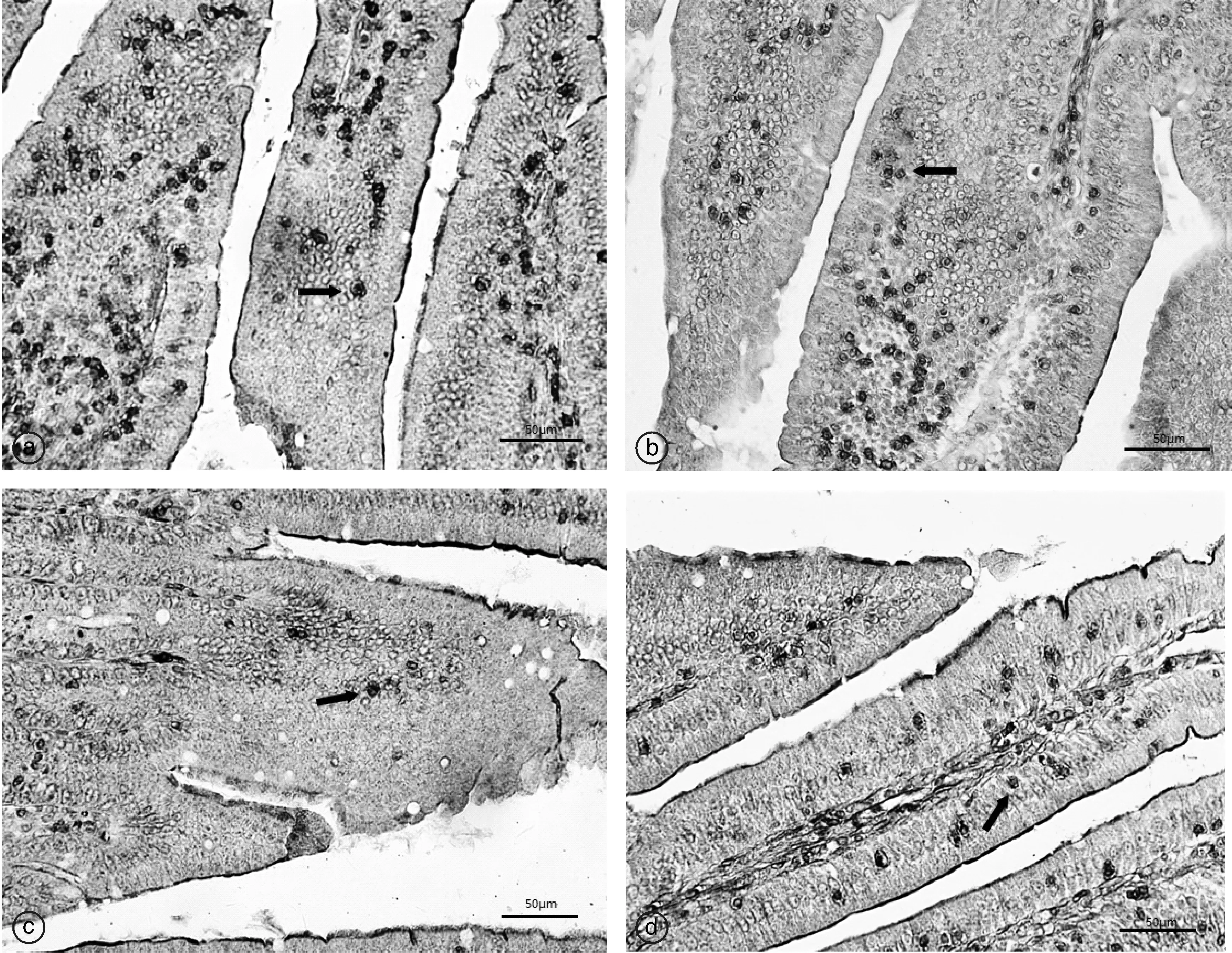
a, T1组(α-菠菜甾醇组);b, T2组(混合组);c, T3组(泰乐菌素组);d, T4组(生理盐水组)。箭头所指示的为阳性表达图2 不同组别的PEPT1第5天在十二指肠中的表达Fig.2 The expression of PEPT1 in different groups in duodenum on the fifth day
表2 肠道PEPT1蛋白的阳性细胞表达强度
Table 2 The intensity of positive cells containing PEPT1 protein in intestine
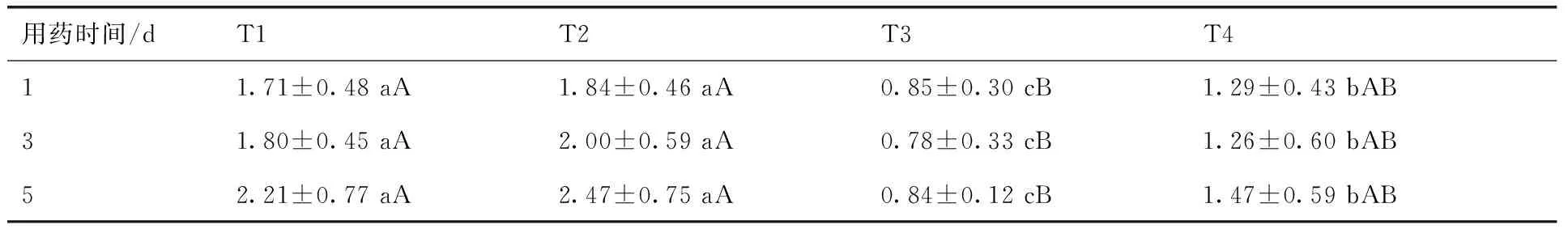
用药时间/dT1T2T3T411.71±0.48aA1.84±0.46aA0.85±0.30cB1.29±0.43bAB31.80±0.45aA2.00±0.59aA0.78±0.33cB1.26±0.60bAB52.21±0.77aA2.47±0.75aA0.84±0.12cB1.47±0.59bAB

Ⅰ,Ⅱ,Ⅲ分别表示在1 , 3 , 5 d P-gp对每个组别不同肠段的影响。从左至右分别表示T1组(α-菠菜甾醇组)、T2组(混合组)、T3组(泰乐菌素组)和T4组(生理盐水组)。*表示相较于T4组差异显著(P <0.05),**表示相较于T4组差异极显著(P <0.01)。图4同图3 P-gp在不同组别不同肠段的表达Fig.3 The expression of P-gp in different intestines in different groups
PEPT1在回肠的变化比十二指肠和空肠更为明显。T3(泰乐菌素组)下调PETP1表达,T2(混合组)上调PEPT1的表达。有α-菠菜甾醇参与的小组(T1和T2)在各肠段都上调了PEPT1的表达。总体来看,各肠道每段的差异随用药时间延长而越发明显。

图4 PEPT1在不同组别不同肠段的表达Fig.4 The expression of PEPT1 in different intestines in different groups
3 结论与讨论
已知伊维菌素[12]、氟喹诺酮类药物[13]和大环内酯类药物等都是P-gp的底物,与P-gp的亲和度高。本试验T3组(酒石酸泰乐菌素)P-gp的表达较对照组增多,说明其亲和力与P-gp较高,上调了P-gp的表达,可知泰乐菌素作为大环内酯类药物,也属于P-gp的底药。通过与T3组(酒石酸泰乐菌素)和T4(生理盐水组)对比,含有α-菠菜甾醇的组分(T1和T2)都抑制P-gp的表达,且与T3组(酒石酸泰乐菌素)差异极显著(P<0.01)。据此,可明确得出α-菠菜甾醇能够抑制P-gp表达的结论。PEPT1具有广泛的底物专属性,一些临床药物中,如血管紧张素转化酶抑制剂,既是它的底物又是它的抑制剂[14]。迄今发现的与PEPT1亲和力最高的药物氯沙坦,也不是其底物而是抑制剂[15]。本实验结果显示,泰乐菌素虽然不确定是否为PEPT1的底物,但其抑制了PEPT1的表达,说明泰乐菌素和PEPT1还是有一定的亲和力。无论是混合组(T2)或单用α-菠菜甾醇组(T1),都促进了PEPT1的表达,揭示α-菠菜甾醇对于PEPT1确实具有一定的促进能力。两药物联用产生的DDI是由转运体介导[16]。本试验结果表明,α-菠菜甾醇和酒石酸泰乐菌素联用产生DDI的机制,是α-菠菜甾醇抑制P-gp表达和促进PEPT1的表达。
泰乐菌素本身是浓度依耐性药物,对G+和一些G-菌有效,其中对支原体作用最强。本试验结果可知,泰乐菌素可以上调P-gp和抑制PEPT1的表达,从而限制了泰乐菌素在肠道的吸收。而与α-菠菜甾醇联用后,可以减少肠道上P-gp对药物外排的同时增加PEPT1对药物的摄取,有效地促进泰乐菌素的吸收。增强泰乐菌素的口服生物利用度,可以为临床上治疗支原体等疾病提供指导性的用药依据。P-gp能识别和转运许多化学结构与相对分子质量差别很大的物质,包括抗癌药物、抗菌药物、抗病毒药、抗心律失常药、免疫抑制剂等[17-18],P-gp的过度表达是介导肿瘤多药耐药的重要机制之一[19]。因此,研究机体肠道P-gp的抑制具有重要意义。由于PEPT1具有低亲和、高转运能力的特点,且能识别众多药物,许多研究都以PEPT1作为药物靶点来提高药物生物利用度[15]。这表明,PEPT1的表达水平的任何变化都会影响药物的肠道吸收。故研究改变PEPT1的表达水平也具有一定的临床治疗学意义。
口服给药是较为方便的给药途径之一,了解肠道转运体机制有助于获得药物在肠道的吸收动力学、吸收机制、有效吸收部位及影响吸收的因素等信息。通过转运体介导的底物之间相互作用,降低药物不良反应、提高目标药物的生物利用度及疗效,能为临床合理用药提供更科学的理论依据。在吸收环节上,α-菠菜甾醇能够抑制P-gp和促进PEPT1的表达,那么,在药物分布和排泄环节上α-菠菜甾醇对不同的转运体还有没有影响这将是以后进一步研究的内容。
[1] 钟运鸣, 王素军, 杨本坤, 等. 肠道转运体在药物吸收中作用的研究进展 [J]. 广东药学院学报, 2013, 29(4):458-461.
[2] 朱宝英, 黄静, 王永林,等. P-糖蛋白及肿瘤多药耐药的逆转 [J]. 中国药房, 2011, 22(6):550-552.
[3] ANDERLE P, NIEDERER E, RUBAS W, et al. P-Glycoprotein( P-gp) mediated efflux in Caco-2 cell monolayers: the influence of culturing conditions and drug exposure on P-gp expression levels [J].JournalofPharmaceuticalSciences, 1998, 87(6): 757-762.
[4] LOHNER K,SCHNBELE K,DANIEL H, et al. Flavonoids alter P-gp expression in intestinal epithelial cellsinvitroandinvivo[J].MolecularNutrition&FoodResearch, 2007, 51(3): 293-300.
[5] BRANDSCH M,IKNÜTTER I,BOSSE-DOENECKE E. Pharmaceutical and pharmacological importance of peptide transporters [J].JournalofPharmacy&Pharmacology, 2008, 60(5): 543-585.
[6] 潘树矿, 张令达. 多药耐药糖蛋白p-glycoprotein及其抑制剂的研究进展 [J]. 广东牙病防治, 2007, 15(5):236-238.
[7] 王庆端, 韩立, 江金花. 植物来源的P糖蛋白抑制剂研究进展[C]//2013医学前沿论坛暨第十三届全国肿瘤药理与化疗学术会议论文集. 洛阳:中国工程院医药卫生学部和中国抗癌协会抗癌药物专业委员会、中国药理学会肿瘤药理专业委员会. 2013.
[8] 李峥,庄笑梅,李素云,等. P-糖蛋白中药抑制剂的研究进展 [J]. 解放军药学学报, 2009, 25(4):326-329.
[9] REN J, ZOU M, GAO P, et al. Tissue distribution of borneol-modified ganciclovir-loaded solid lipid nanoparticles in mice after intravenous administration [J].EuropeanJournalofPharmaceutics&Biopharmaceutics, 2013, 83(2): 141-148.
[10] TREVISAN G, ROSSATO M F, WALKER C I, et al. Identification of the plant steroid α-spinasterol as a novel transient receptor potential vanilloid 1 antagonist with antinociceptive properties [J].JournalofPharmacology&ExperimentalTherapeutics, 2012, 343(2): 258-269.
[12] KWESTPHAL K, WEINBRENNER A,ZSCHIESCHE M, et al. Induction of P-glycoprotein by rifampin increases intestinal secretion of talinolol in human beings: a new type of drug/drug interaction [J].ClinicalPharmacology&Therapeutics, 2000, 68(4): 345-355.
[13] SCHINKEL A H,WAGENAAR E,MOL C A, et al. P-glycoprotein in the blood-brain barrier of mice influences the brain penetration and pharmacological activity of many drugs [J].JournalofClinicalInvestigation, 1996, 97(11): 2517-2524.
[14] 刘志浩, 刘克辛. 肠道药物转运体及其研究方法 [J]. 药学学报, 2011, 46(4): 370-376.
[15] BRANDSCH M. Drug transport via the intestinal peptide transporter PepT1 [J].CurrentOpinioninPharmacology, 2013, 13(6): 881-887.
[16] 刘克辛. 转运体介导的药物相互作用与临床安全用药 [J]. 大连医科大学学报, 2012, 34(1): 1-8.
[17] CATIA M, ERIK P, THIERRY B, et al. Polymorphisms in human MDR1 (P-glycoprotein): recent advances and clinical relevance [J].ClinicalPharmacology&Therapeutics, 2004, 75(1): 13-33.
[18] MÜLLER F, FROMM M F. Transporter-mediated drug-drug interactions [J].Pharmacogenomics, 2011, 89(4): 481-484.
[19] 胡静姿, 刘惠敏, 李玉莉. 多药耐药基因/P-糖蛋白介导的多药耐药逆转策略的研究进展 [J]. 上海医学, 2006 (1):64-66.
(责任编辑 卢福庄)
Influence of α-spinasterol on expression of P-gp and PEPT1 in small intestine of mice
WU Li-na, ZHAO Ling, YE Gang, LI Ying-lun*
(CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu610000,China)
In order to research the effect of α-spinasterol on the intestine transporters P-gp and PEPT1 when the tylenol tartrate was introduced as a substrate, 48 mice were equally divided into 4 treatment groups: α-spinasterol group, tylenol tartrate group, mixed (α-spinasterol and tylenol tartrate) group, and normal saline group which was used as control group. The formulations were administered by oral gavage with a dose of 0.2 mL·10 g-1depending on body weight of mice. The small intestine samples of the dissected mice were excised at predetermined time intervals (1, 3, 5). The expressions of P-gp and PEPT1 on the mice intestines were detected by immunohistochemical method at 1, 3, 5 d, respectively. The results showed that the protein expression of P-gp was distinctly reduced in α-spinasterol and mixed groups, and the protein expression of PEPT1 was increased in these 2 groups compared with normal saline group. However, the protein expression of P-gp was increased and the protein expression of PEPT1 was decreased in tylenol tartrate group compared with normal saline group. The difference was more obvious with time pass by. In summary, α-spinasterol had an obvious impact on intestine transporters, including inhibiting P-gp expression and inducing PEPT1 expression.
α-spinasterol; mice; drug transporter; P-gp; PEPT1
10.3969/j.issn.1004-1524.2016.06.07
2015-11-22
国家自然科学基金项目(31272599)
吴丽娜(1989—),女,回族,四川成都人,硕士研究生,从事中兽药研究。E-mail:wulina07@sina.com
*通信作者,李英伦,E-mail:liyinglun01@163.com
S853.74;R932
A
1004-1524(2016)06-0944-07
吴丽娜,赵玲,叶刚,等. α-菠菜甾醇对小鼠小肠段药物转运体P-gp和PEPT1表达的影响[J].浙江农业学报,2016,28(6): 944-950.
