泰乐菌素纯化工艺优化研究
2023-02-08陈东张晓强纳奇锁嘉伟
*陈东 张晓强 纳奇 锁嘉伟
(宁夏泰益欣生物科技有限公司 宁夏 750205)
泰乐菌素(Tylosin),亦称泰农、泰乐霉素,是美国于1959年从弗氏链霉菌(Streptomyces fradiae)的培养液中获得的一种大环内酯类抗生素。泰乐菌素的外观呈现为一种白色板状结晶,在水中的溶解性较低,呈现碱性。主要的产品有酒石酸泰乐菌素、磷酸泰乐菌素、盐酸泰乐菌素、硫酸泰乐菌素及乳酸泰乐菌素,以上盐在水中的溶解性良好。泰乐菌素水溶液在25℃、pH5.5~7.5时可保存3个月,但是当水溶液中含有铁离子、铜离子等金属离子时,会使泰乐菌素水溶液失效。
泰乐菌素是禽畜专用的大环内酯类抗生素,其活性组分主要包括ABCD四种,以A组分为主,在动物体内的活性最强[1]。在2011版英国药典(兽药)中,规定泰乐菌素的总组分(A+B+C+D)含量在95%以上,且A组分含量在80%以上[2]。目前,已有报道显示泰乐菌素对于禽畜类的多种病症均具有较好的预防和治疗效果。与此同时,其作为饲料添加剂已经被国际所认可,且在国内甚至国际市场上的需求量都较大[3]。纯度较高的泰乐菌素成品具有广阔的市场前景,也能带来较为良好的经济效益。随之而来的问题就是,如何获得纯度较高的泰乐菌素,这也成为了目前的研究方向和发展趋势。
在生物制药行业中,萃取的方法被广泛应用,此种方法可以有效去除泰乐菌素中大部分水溶性杂质及无机盐,将泰乐菌素的有效成分从水相转移至有机相,除去水溶性杂质,然后通过二级反萃取的方式将泰乐菌素分阶段的从有机相转移至水相,再经过中和精制,得到高纯度的泰乐菌素。达到降低杂质含量,提升泰乐菌素纯度的目的。

图1 泰乐菌素结构式
1.实验仪器及试剂
(1)仪器
实验中所需数显式恒温磁力搅拌水浴锅由天津华鑫仪器提供;低温恒温循环水浴槽由中仪科瑞(郑州)设备有限公司提供;酸度计由梅特勒-托利多仪器(上海)有限公司提供;高效液相色谱仪由安捷伦科技公司提供;分析天平由上海良平仪器仪表有限公司提供。
(2)试剂
实验中所需氢氧化钠、酒石酸、乙酸丁酯全部由天津市承大化学试剂有限公司提供;氢氧化钙、甲醇、乙腈全部由天津市大茂化学试剂有限公司提供。
2.实验材料和实验方法
(1)材料
泰乐菌素滤液来源于宁夏泰益欣生物科技股份有限公司。
(2)方法
①实验方法
取泰乐菌素滤液以及套用乙酸丁酯,分别设置滤液:乙酸丁酯=1:1.5;1:1;1:0.8;1:0.4四种比例进行混合,置于数显恒温水浴锅内,分别设置30℃、35℃、40℃、45℃、50℃五个萃取温度。设定萃取时间分别为20min、25min、30min、35min;分别设置萃取次数为一次萃取,两次萃取,三次萃取;使用浓度为10%~15% NaOH溶液调节pH,最终pH调节到9.0~9.4左右;然后再进行反萃取,最后进行中和精制工艺得到精制液、取样、待检。
②检测方法
用高效液相色谱仪进行含量检测,检测方法按照泰乐菌素组分检验标准操作规程(USP)进行。
色谱条件:以十八烷基硅烷键合硅胶作为填充剂;以200g/L高氯酸钠溶液-乙腈(60:40)为流动相;检测波长设定为290nm;色谱柱型号为:4.6mm×25cm,粒径5um;流速设定为1.0ml/min;柱箱温度设定为35℃。
流动相具体配制方法为:200g/L高氯酸钠溶液与乙腈按照体积比为60:40进行配制,混合均匀之后进行过滤,用超声波清洗器除去流动相中的气泡,即得。
供试品溶液配制方法为:准确称取供试品20mg,置100ml容量瓶中,加入乙腈-水(1:1)进行溶解并稀释,准确定容至刻度线,摇匀,即得。
对照品溶液配制方法为:称取泰乐菌素对照品(USP)20mg,精密称定,置100ml容量瓶中,加乙腈-水(1:1)进行溶解并稀释,准确定容至刻度线,摇匀,即得。
3.结果与分析
(1)滤液与乙酸丁酯的加量对泰乐菌素A组分含量的影响
在萃取这一工序中,萃取剂的用量对萃取的效果会产生极大地作用。萃取剂使用过量可能会加大试剂的浪费,导致生产成本过高;而萃取剂使用量减少会导致萃取不彻底,从而造成泰乐菌素的损失。因此本实验设置四种投料比例进行验证,分别为1:0.4,1:0.8;1:1;1:1.5;其余条件固定不变,考察对泰乐菌素A组分含量的影响。具体结果由表1所示。

表1 加量比例对泰乐菌素A组分含量的影响
由表1和图2可知,随着投料比例的改变,泰乐菌素A组分含量为一个先增加后降低的改变趋势,当加量比例设置为1:0.8时,得到的泰乐菌素A组分含量为最高。
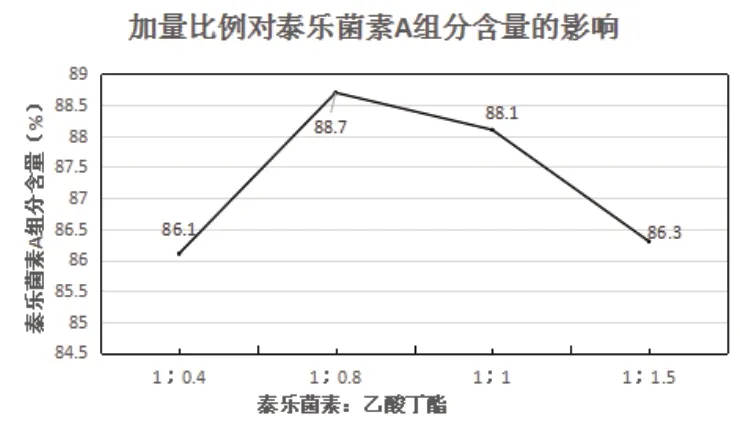
图2 加量比例对泰乐菌素A组分含量的影响
(2)萃取温度对泰乐菌素A组分含量的影响
一般来说,随着温度的升高,溶质在水相及萃取剂中的溶解度都会有所提高,而且在萃取剂中的溶解度比在溶质中的溶解度大,所以利于萃取的进行。除此之外,温度升高,溶液的黏度降低,也便于萃取剂与水的分离。但是当温度过高时,就会导致萃取剂的损失增多。因此设置不同萃取温度进行验证,分别为30℃、35℃、40℃、45℃、50℃,保持其余条件不变,考察对泰乐菌素A组分含量的影响。具体结果由表2所示。

表2 萃取温度对泰乐菌素A组分含量的影响
由表2和图3可知,随着萃取温度的逐渐增加时,泰乐菌素A组分含量变化为先增加后降低,当萃取温度为45℃时,泰乐菌素A组分的含量达到最佳。此后再升高温度时泰乐菌素A组分含量开始降低,综合来看,当萃取温度为45℃时,泰乐菌素A组分含量最佳。

图3 萃取温度对泰乐菌素A组分含量的影响
(3)萃取次数对泰乐菌素A组分含量的影响
萃取是提纯的手段之一,而萃取次数也至关重要。单次萃取效率远低于多次萃取,而随着萃取次数的增加,滤液中泰乐菌素的有效成分会逐渐降低,此时继续增加萃取次数,泰乐菌素A含量降低,还会造成萃取剂的浪费,导致生产成本增加。因此设置不同萃取次数进行验证,分别为一次萃取、两次萃取、三次萃取,保持其余条件不变,考察对泰乐菌素A组分含量的影响。具体结果由表3所示。

表3 萃取次数对泰乐菌素A组分含量的影响
由表3和图4可知,当萃取次数的逐渐增加时,泰乐菌素A组分含量逐渐降低,萃取次数越多,泰乐菌素A组分含量越低,但一次萃取显然无法将绝大多数有效成分萃取出来,综合生产成本与萃取效率,当萃取次数为两次时,既能尽可能多的将泰乐菌素A组分萃取完全,又能节约成本,因此确定萃取次数为两次。

图4 萃取次数对泰乐菌素A组分含量的影响
(4)萃取时间对泰乐菌素A组分含量的影响
在进行萃取工序时,萃取时间的长短对萃取效率的影响也极为重要。萃取时间过短,会导致泰乐菌素有效成分萃取不完全,从而导致泰乐菌素A组分降低;而当萃取时间过长时,不仅对萃取效率起不到明显的促进作用,反而会造成预料之外的浪费。因此设置20min、25min、30min、35min、40min等不同萃取时间,保持其它条件不改变,考察对泰乐菌素A组分含量的影响。具体结果由表4所示。
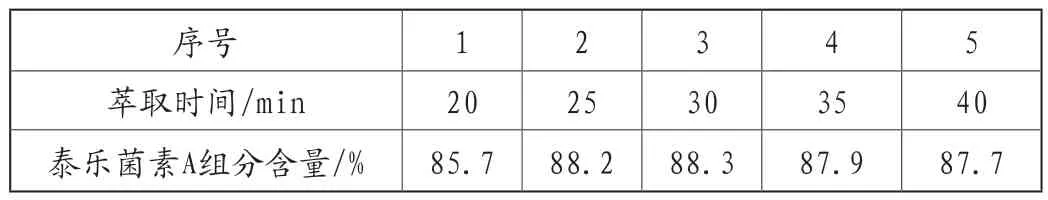
表4 萃取时间对泰乐菌素A组分含量的影响
由表4可知,随着萃取时间的延长,泰乐菌素A组分含量增加,当萃取时间在25~30min这一范围内时,泰乐菌素A组分含量基本保持不变且为最佳,而后萃取时间继续增加,泰乐菌素A组分含量变化不大,综合生产时间来看,当萃取时间为25~30min时,所得泰乐菌素A组分含量是最高的。
(5)最优条件下的平行实验
通过单因素试验,获得最优参数,组合成为最优的泰乐菌素萃取工艺条件,具体参数如下:泰乐菌素滤液加量:乙酸丁酯加量=1:0.8、萃取温度为45℃、进行两次萃取、萃取时间控制为25~30min。以此组合工艺条件进行3组平行实验验证此工艺条件的稳定性,结果如表5所示。

表5 平行实验验证数据
由表5可知,三组实验中所得到的泰乐菌素A组分平均含量为89.6%。
4.结论
本研究通过对泰乐菌素滤液与乙酸丁酯投料比例、萃取温度、萃取次数、萃取时间等工艺参数分别进行单因素实验,结果表明:当投料比例为1:0.8、萃取温度为45℃、萃取次数为两次萃取、萃取时间控制为25~30min时实验结果最优,并验证最优参数组合工艺对泰乐菌素的萃取具有显著的影响,为泰乐菌素的A组分含量的提升提供了有力的支撑,依据此工艺可继续进行优化实验。
