一株鹅源多杀性巴氏杆菌强毒株的分离鉴定及其血清型鉴定相关基因的克隆
2016-11-28杨泽晓刘常钰姚学萍邬旭龙李桂黎蒙正群刘亚东
杨泽晓,刘常钰,王 印,姚学萍,邬旭龙,王 波,李桂黎,蒙正群,刘亚东
(1.四川农业大学 动物医学院, 四川 温江 611130; 2.动物疫病与人类健康四川省重点实验室,四川 温江 611130)
一株鹅源多杀性巴氏杆菌强毒株的分离鉴定及其血清型鉴定相关基因的克隆
杨泽晓1,2,刘常钰1,王 印1,2,姚学萍1,邬旭龙1,王 波1,李桂黎1,蒙正群1,刘亚东1
(1.四川农业大学 动物医学院, 四川 温江 611130; 2.动物疫病与人类健康四川省重点实验室,四川 温江 611130)
为探索某鹅场鹅巴氏杆菌病疫情发生的原因,采集初诊为鹅巴氏杆菌感染病例的肝脏、心脏等样品进行细菌分离纯化,经过染色镜检、培养特性、生化试验、种与血清型PCR鉴定、致病性试验和药敏试验等进行鉴定,并根据GenBank中多杀性巴氏杆菌血清型相关基因设计引物进行其血清型相关基因的克隆分析。结果显示,分离到1株荚膜A型鹅源多杀性巴氏杆菌,属于多杀亚种,血清型Ⅰ型,具有较强致病性,对实验小鼠最小致死量为5 cfu。该分离菌株具有多重耐药性,仅对头孢三嗪、头孢噻吩、头孢他啶、头孢唑肟和氟苯尼考5种药物敏感。成功克隆的该分离菌株荚膜合成相关基因hyaD-hyaC的开放阅读框4 155 bp,与已发布基因序列同源性高达99%;血清型Ⅰ型PCR的扩增基因片段303 bp,与巴氏杆菌C48-1株扩增基因片段序列完全相同。综上,该株血清型Ⅰ型荚膜A型的鹅源多杀性巴氏杆菌强毒株,是鹅场疫情发生的病原,克隆的荚膜合成相关基因和菌体血清型特异性基因遗传相对稳定。
鹅;多杀性巴氏杆菌;血清型; PCR鉴定
鹅巴氏杆菌病(goose pasteurellosis)又称鹅霍乱,是由多杀性巴氏杆菌(Pasteurellamultocida, Pm)引起的一种高度接触性、败血性传染病[1-2]。随着近些年我国养鹅业的不断发展,有关鹅巴氏杆菌病的报道不断增多[3-4]。
鹅巴氏杆菌病的发生机理尚不清楚,传播途径复杂多样,流行也无明显季节性,常会受到天气剧变、台风、合群、长途运输等外界因素的影响,该病一旦流行,很难查出传染源,且往往会反复发生[5]。该病发病急、死亡快,其发病率和死亡率因饲养管理、病原毒力等方面不同而存在差异。据不完全统计,发病率可高达35%,死亡率高达70%,如果出现混合感染,死亡率可能更高[6-7]。加上Pm的血清型比较复杂,不同血清型间又缺乏交叉免疫保护作用,以及Pm菌株耐药现象,Pm感染的控制难度在不断增加[8],严重威胁着我国养鹅业的健康发展。
刘加波等[9]采用RAPD技术对9株禽Pm广西分离株和3株参考株DNA的多态性分析发现,广西流行Pm菌株呈现多样性,且与标准Pm强毒株存在差异。近些年我国分离到F型Pm[10],这表明我国Pm感染情况呈现越来复杂的趋势。2013年7月,四川某鹅场发生疫情,育成肉鹅出现急性死亡,死亡率15%左右。笔者通过对送检病死鹅只临床症状、剖检病变初诊,认为属鹅巴氏杆菌病,然而与畜主陈述曾免疫接种过巴氏杆菌疫苗的流行病学调查结果出现了较大偏差。为探索是否出现Pm的变异导致免疫失败,并明确引发此次典型鹅霍乱疫情的原因,本研究在对病例剖检基础上无菌采集肝脏、心脏等材料进行细菌分离和纯化,通过染色镜检、培养特性、生化试验、药敏试验、动物致病试验和分子生物学技术对分离株进行了鉴定,并对分离菌株的血清型相关基因进行了克隆分析,以期为鹅巴氏杆菌病的防控提供科学的参考依据。
1 材料与方法
1.1 试剂、菌种与试验动物
营养琼脂,标准药敏试纸和微量生化试管,购自杭州微生物试剂有限公司;DNA marker DL2000和pMD19-T载体购自成都飞克(天泰)科技有限公司;2×TaqPCR Mastermix 、琼脂糖和TIANgel Midi Purification Kit(DP209)等购自成都安雅生物试剂有限公司;15日龄健康雏鹅6只、体质量25 g雌性KM小鼠35只、鹅源大肠埃希菌、Pm参照株 P1059、C48-1由四川农业大学动物检疫研究室提供。
1. 2 引物设计合成
根据GenBank(http://www.ncbi.nlm.nih.gov)已公布的Pm基因序列,参考相关文献[11-13]进行Pmkmt1基因的种特异性引物(P1/P2)、荚膜型分型引物(针对A,B,D,E,F荚膜型特异性基因hyaD-hyaC,bcbD,dcbF,ecbJ,fcbD扩增的A1/A2,B1/B2,D1/D2,E1/E2,F1/F2,A3/A4,A5/A6)和Pm血清Ⅰ型引物(F/R)筛选设计(表1),送往北京华大科技有限公司合成,按照合成说明书将其稀释至10 μmol·L-1,-20 ℃冻存备用。
1.3 临床剖检
按常规方法对送检病鹅进行剖检,观察脏器病理变化,并无菌采取病料以进行细菌分离鉴定。
表1 Pm分离鉴定PCR用扩增引物
Table 1 The PCR primers for Pm identification

项目与引物编号引物序列(5’→3’)产物大小/bp参考文献 Kmt1基因[11]P1ATCCGCTATTTACCCAGTGG456P2GCTGTAAACGAACTCGCCAC 荚膜血清群[12]A1TGCCAAAATCGCAGTCAG1044A2TTGCCATCATTGTCAGTGB1CATTTATCCAAGCTCCACC760B2GCCCGAGAGTTTCAATCCD1TTACAAAAGAAAGACTAGGAGCCCC657D2CATCTACCCACTCAACCATATCAGE1TCCGCAGAAAATTATTGACTC511E2GCTTGCTGCTTGATTTTGTCF1AATCGGAGAACGCAGAAATCAG852F2TTCCGCCGTCAATTACTCTG Pm血清型Ⅰ型[13]FAAGGGGATGGGTTTAGAGCCAGT303RAAGGGGATGGGTTTAGAGCCAGT hyaD-hyaC基因A3ATGAATACATTATCACAAGC2147AF067175A4CTGACTGCGATTTTGGCAA5CACTGACAATGATGGCAA998A6TTAAGCATCACCGCCAAA
1.4 病原菌分离鉴定
1.4.1 细菌分离纯化
按照文献[4]进行绵羊鲜血平板等培养基的制作,将无菌采取的心脏、肝脏、脾脏等病变组织接种于血平板上,37 ℃培养24 h,观察细菌生长情况,挑菌后革兰染色镜检,通过平板划线法进行细菌纯化,进行瑞氏染色镜检。
1.4.2 培养特性与生化试验
取分离菌株纯培养物,接种于鲜血平板、血清平板、普通平板、麦康凯平板,观察细菌培养特性,并根据微量生化发酵管说明书分别接种葡萄糖、乳糖、果糖、木糖、麦芽糖、蔗糖、蕈糖、山梨醇、卫矛醇、肌醇、甘露醇、硫化氢、尿素酶、VP、赖氨酸和鸟氨酸等生化管,同时挑单个菌落进行触酶试验和氧化酶试验。
1.4.3 PCR鉴定
(1)Pmkmt1基因PCR
根据鹅只剖检病变、细菌染色镜检和生化试验的结果,以P1/P2为引物,按照文献[11]中反应体系和反应程序进行分离菌株的kmt1基因PCR鉴定,同时以Pm 参照株P1059、C48-1和鹅致病性大肠埃希菌为对照。
(2)荚膜血清群PCR鉴定
以A1/A2,B1/B2,D1/D2,E1/E2和F1/F2为引物,采用文献[12]中血清群多重PCR方法进行分离菌株荚膜血清群鉴定,同时以Pm 参照株P1059,C48-1和鹅致病性大肠埃希菌为对照。
(3)血清型Ⅰ型PCR鉴定
以分离菌株纯培养物为模板,按照参考文献[13]中PCR方法进行分离菌株的血清型鉴定,同时以Pm 参照株P1059,C48-1和鹅致病性大肠埃希菌为对照。反应体系为2×TaqPCR Master Mix 25.0 μL,引物F和R 各1.5 μL,模板2.0 μL,ddH2O 20.0 μL。反应程序:95 ℃ 5 min;95 ℃ 40 s,59 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。反应结束后取5 μL PCR产物进行1%琼脂糖凝胶电泳分析。
1.4.4 动物试验
[10]方法,将分离菌株在血平板上培养24 h后,用无菌生理盐水冲洗菌苔, 参照麦氏比浊法测定菌液浓度后,稀释至5×108cfu·mL-1,分别进行鹅致病性试验和小鼠致病性研究。
(1)鹅致病试验
将6只雏鹅饲养3 d后,随机分为2组,每组3只。试验组雏鹅腹腔注射分离菌株稀释物0.3 mL,对照组雏鹅腹腔注射生理盐水0.3 mL。连续7 d观察雏鹅发病、死亡情况,并及时采集病死鹅心脏、肝脏、脾脏样品进行抹片镜检和细菌分离鉴定。
(2)小鼠致病性试验
将10只小鼠随机分为2组,每组5只,试验组腹腔注射分离菌株稀释物(每只0.2 mL),对照组注射生理盐水(每只0.2 mL)。连续7 d观察小鼠发病、死亡情况,并及时采集病死小鼠脾脏样品进行抹片镜检和细菌分离鉴定。
(3)小鼠最小致死浓度(MLD)测定
用无菌生理盐水对分离菌株稀释物继续进行梯度稀释,并采用平板法进行cfu计数,使其浓度分别为5 000,500,50和25 cfu·mL-1,将25只小鼠随机分为5组,每组5只,分别腹腔注射不同浓度菌液或生理盐水,每只0.2 mL。连续7 d观察发病、死亡情况,并及时采集病死小鼠脾脏样品进行抹片镜检和细菌分离鉴定。
1.5 药敏试验
按参考文献[4]操作,采用Kirby-Bauer法检测分离菌株对30种常用抗菌药物的敏感性,结果根据药敏试验抑菌环直径判断标准(WS/T125—1999)进行敏感性的判定。
1.6 分离菌株血清型鉴定基因的克隆分析
1.6.1 hyaD-hyaC基因的克隆分析
(1)hyaD-hyaC基因PCR扩增
根据荚膜血清群鉴定结果,设计合成荚膜生物合成相关基因hyaD-hyaC序列的PCR引物(表1),分别以A1/A2,A3/A4,A5/A6为引物进行分离Pm菌株hyaD-hyaC基因的扩增。PCR反应体系为 2×TaqPCR Master Mix 25.0 μL,上下游引物各1.5 μL,菌液模板2.0 μL,ddH2O 20.0 μL。反应程序:95 ℃ 5 min;95 ℃ 45 s,56 ℃ 30 s,72 ℃ 70 s,35个循环;72 ℃ 10 min。反应结束后取5 μL PCR产物进行1%琼脂糖凝胶电泳分析。
(2)hyaD-hya基因的克隆分析
根据TIANgel Midi Purification Kit(DP209)说明书分别纯化回收预期大小的PCR产物,送往北京擎科新业生物技术有限公司进行序列测定,最后将测序结果用DNAStar软件拼接后进行BLAST同源性分析。
1.6.2 血清型Ⅰ型鉴定基因的克隆分析
按照1.6.1节中⑵的方法,分别纯化回收1.4.3节Pm分离菌株和C48-1株血清型Ⅰ型PCR鉴定产物,送往北京擎科新业生物技术有限公司进行序列测定,最后将测序结果进行BLAST同源性分析。
2 结果与分析
2.1 病鹅剖检病变
剖检可见,病鹅呈现急性禽霍乱的特征性病理变化,腹膜、气囊大量点状出血(图1-A),心包大量淡黄渗出液,心肌与心冠脂肪有点状出血(图1-B);气管表面充血和有出血点(图1-C)、肺脏充血和点状出血;肝脏稍肿大,质脆,棕色或者淡黄色,表面有大量白色或淡黄色针尖大小坏死点(图1-B—D);脾脏淤血肿大,也可见淡黄色或白色大小不等坏死点(图1-E);消化道尤其十二指肠充血,呈卡他性或出血性炎症(图1-F)。
2.2 病原菌分离鉴定
按照1.4.1节和1.4.2节操作进行病变组织中细菌的分离纯化及分离菌株的培养特性观察和生化试验,结果分离到1株两端钝圆、两极浓染、革兰阴性小杆菌(图2-A—B);该菌在鲜血平板和血清平板上,37 ℃条件下培养24 h,可以见到大小不一的淡灰白色、湿润、露珠样菌落(图3-A),在白光45度照射下菌落呈现蓝绿色荧光和橙色荧光(图3-B),无溶血性(图3-A),也可在普通平板上生长,但在麦康凯平板上不能生长。生化试验结果显示该菌株可发酵葡萄糖、蔗糖、木糖、果糖、山梨醇和蕈糖;触酶试验(图3-A)和氧化酶试验阳性;不发酵麦芽糖、菊糖、乳糖、卫矛醇、肌醇和甘露醇;硫化氢、尿素酶、VP、赖氨酸和鸟氨酸反应阴性。这与多杀性巴氏杆菌多杀亚种培养特性和生化特征[7]相符合。
按照1.4.3节操作分别进行了分离菌株kmt1的PCR扩增、Pm荚膜血清型PCR鉴定和血清型Ⅰ型鉴定,结果如图4所示。分离菌株与Pm对照菌株P1059,C48-1的kmt1基因PCR和Pm荚膜血清型PCR均扩增出456 bp(图4泳道1,2,3)和1 044 bp(图4泳道5,6,7)预期长度的DNA条带,而鹅大肠埃希菌对照无特异性扩增(图4泳道4,8);分离菌株与C48-1的血清型Ⅰ型PCR扩增出303 bp(图4泳道9,10)预期大小条带。鹅大肠埃希菌和P1059菌株均无扩增(图4泳道11,12),因此鉴定该分离菌株为鹅源荚膜A型多杀性巴氏杆菌,血清型Ⅰ型,并将其命名为GHaiNPm2012株。
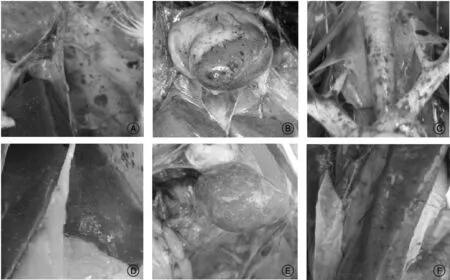
A, 气囊、浆膜出血;B, 心脏点状出血;C, 气管出血;D, 肝脏坏死点;E, 脾脏坏死结节;F, 十二指肠出血图1 病鹅的剖检病理变化Fig.1 The pathological anatomy changes of sick geese

A, 革兰染色结果; B, 瑞氏染色结果图2 染色镜检(1 000×)Fig.2 The morphological examination (1 000 ×)
按照1.4.4节操作进行Pm分离株的动物致病性试验,结果显示,攻菌试验组的雏鹅和小鼠都在2 d全部死亡,剖检以脏器出血性病变为主,取肝脏涂片镜检可以观察到两极浓染革兰阴性小杆菌,经过细菌分离鉴定重新获得该菌,对照组无异常表现。这表明该分离菌株GHaiNPm2012株对鹅和小鼠具有较强的致病性,也是该鹅场发生疫情的病原。
小鼠最小致死浓度(MLD)测定试验显示:生理盐水对照组小鼠正常,除25 cfu·mL-1攻菌组小鼠死亡2只外,其他攻菌剂量组小鼠均在2 d内全部死亡,且取病死小鼠脾脏样品又重新分离鉴定到该菌,因此,该菌的小鼠MLD为5 cfu。

A, 血平板培养特性; B, 血清平板菌落荧光图3 Pm分离株培养特性Fig.3 Cultured characteristics of the Pm isolate
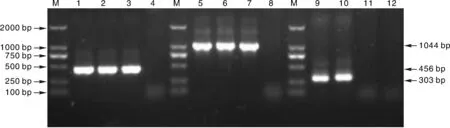
1,2,3,4分别为Pm isolate,C48-1,P1059和鹅大肠埃希菌的kmt1基因PCR产物;5,6,7,8分别为Pm isolate,C48-1,P1059和鹅大肠埃希菌的荚膜型PCR鉴定产物;9,10,11,12分别为Pm isolate,C48-1,P1059和鹅大肠埃希菌的血清型1型PCR鉴定产物图4 分离菌株kmt1基因、荚膜型和血清型Ⅰ型的PCR鉴定Fig.4 PCR identification of the kmt1 gene, capsular-serotype and serotype 1 for the Pm isolate
2.3 药敏试验
按照1.5节操作进行常用药物的敏感性试验,结果显示该Pm分离株仅对氟苯尼考、头孢三嗪、头孢他啶、头孢噻吩和头孢唑肟等5种药物敏感,对氟哌酸、优立新、头孢噻肟、先锋必素和先锋V中度敏感,对链霉素、强力霉素、复方新诺明、痢特灵、庆大霉素、复方阿莫西林、万古霉素和洁霉素等药物耐受。
2.4HyaD-hyaC基因的克隆分析
按照1.6.1节操作对A型荚膜生物合成相关基因HyaD-hyaC的PCR,结果见图5。扩增出2 147 bp(泳道1)、1 044 bp(泳道2)和998 bp(泳道3)预期大小的3段特异性DNA条带,通过序列测定,拼接为4 155 bp,包含软骨素合成酶(1—2 919 bp)与UDP-葡萄糖-6-脱氢酶(2 983—4 155 bp)2个开放阅读框。经BLAST分析显示与CP008918,CP003328,AF067175等已登录的基因同源性高达99%,表明成功克隆了GPmHaiN2012的hyaD-hyaC基因,测序结果已提交GenBank,登录号为KP0336621。
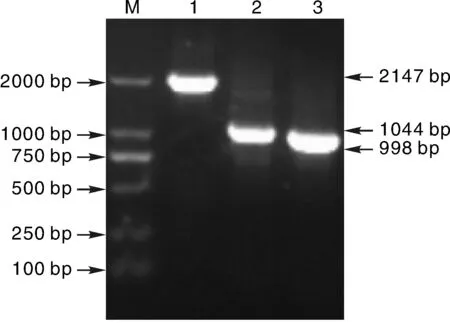
1, 引物A3/A4 PCR产物;2, 引物A1/A2 PCR 产物;3, 引物A5/A6 PCR产物图5 GHaiNPm2012分离株hyaD-hyaC基因的PCRFig.5 The hyaD-hyaC gene PCR results of GHaiNPm2012
采用MegAlign软件对克隆序列与CP008918,CP003328,AF067175等序列进行分析,显示在第49,72,531,1 017,1 089,1 620,1 803和1 908等位点出现18个核苷酸差异,其中第531(A→C),1 017(T→C),1 620(T→C),1 803(T→G)和1 908(T→C)位等5个为新出现变异。推导的氨基酸序列对比分析显示新出现的突变均在软骨素合成酶(1—2 919 bp)基因的开放阅读框内,531(A→C)的突变导致氨基酸的变异(L→F),其他均为同义突变。
2.5 血清型1型鉴定基因的克隆分析
按照1.6.2节操作分别纯化GHaiNPm2012株和C48-1株的血清型1型PCR鉴定产物,并进行测序,2株Pm测序结果完全一致(图6),同源性100%。BLAST同源性分析显示,目前GenBank中尚无该序列的提交,仅与GenBank中昏睡嗜血杆菌序列(登录号CP000947等)同源性最高(84%)。
图6 GHaiNPm2012血清型1型测序结果Fig.6 The sequencing result of GHaiNPm2012 serotype 1-specific PCR products
3 讨论
早期,我国关于禽霍乱的研究主要是在鸡霍乱防控方面,随着近些年我国养鹅业的发展,鹅霍乱诊治相关报道不断增加[3-4],但主要是集中在传统诊治方面,在鹅源多杀性巴氏杆菌(Pm)的基础性研究尤其是血清型检测等方面并不深入,这可能是受到了规模化养鹅业发展较晚、Pm血清型较多和血清学鉴定方法自身局限性的影响。本研究在剖检基础上,采用常规微生物学实验技术和PCR技术,成功分离鉴定到1株高致病性,并具有较强耐药性的鹅源多杀性巴氏杆菌多杀亚种菌株,深入进行了Pm荚膜型与血清型Ⅰ型的PCR鉴定,及其荚膜合成相关基因和血清型Ⅰ型鉴定基因的克隆分析,为鹅巴氏杆菌病的防控及相关研究提供了科学材料和参考。
目前,Pm血清型表示有2种方式:第1种是根据间接血凝试验方法,将Pm分为A,B,C,D,E和F等6个荚膜血清型(群),同时根据Pm菌体抗原不同又可以将同一荚膜群Pm分为不同菌体血清型[14]。因此,常用菌体抗原(O抗原,阿拉伯数字):荚膜抗原(K抗原,大写字母)来表示Pm的血清型。我国禽霍乱Pm主要属于荚膜A型(群),以5∶A和8∶A型为主[14]。第2种是用甲醛生理盐水处理细菌后提取Pm菌体热稳定抗原,利用琼脂扩散方法(AGP)将Pm分为16个不同血清型[14],即用菌体热稳定抗原型来表示Pm血清型。这就避免了无荚膜Pm株荚膜型检测困难、荚膜抗原制作过程复杂和普通菌体抗原有交叉反应等弱点。我国禽Pm血清型调查结果显示,我国流行的强毒禽霍乱Pm的血清型主要是血清型Ⅰ型[14]。有研究显示,2种血清型表示方式间存在一定对应关系,如Pm的5∶A型(X-73株、C48-1株)、8∶A型(P1059株)分别和血清型Ⅰ型(X-73株、C48-1株)、血清3型(P1059株)相对应[15]。本研究采用PCR技术鉴定Pm分离菌株GHaiNPm2012为荚膜型A型,血清型1型菌株,与文献[14]中2株鹅源Pm弱毒疫苗株PTR-780 (14型)、731(15型)的血清型不同。根据Pm参照菌株C48-1和P1059的PCR结果和文献[15]推测,GHaiNPm2012株应该是我国主要流行的Pm血清型(5∶A型),但这与鹅场进行过疫苗接种(常用市售Pm灭活苗疫苗株为5∶A型)相矛盾。然而与国内学者利用Pm自家苗进行免疫取得了理想的预防效果的报道[7]相一致的是,在进行确诊后利用组织灭活苗(自家苗)和综合措施对此次疫情进行了控制,并且随后连续2 a使用该菌株制备的自家苗均有效预防了该病发生(未报道)。因此,笔者分析认为鹅场发生鹅霍乱疫情前使用的灭活苗的疫苗株与GHaiNPm2012的血清型存在差异,考虑到血清型Ⅰ型菌株中可能有亚型存在[14],GHaiNPm2012的血清型更可能是血清型Ⅰ型菌株中的亚型,这一点还有待进一步血清学研究证实。
本研究在病原菌分离鉴定过程中发现,GHaiNPm2012菌株在血清平板菌落带蓝绿色荧光(Fg),同时发酵蕈糖和山梨醇,属于多杀亚种Pm,符合主要针对家畜致病的Pm特征[16],如果排除畜源Pm感染鹅的可能,就提示着该株禽源Pm可能出现了培养特性、生化特征等性状的改变,这也可能与本次疫情发生的免疫失败有着一定的关联,因为Pm的一些基因表达可能存在一定的宿主特异性[17]。本研究通过雏鹅致病性试验确定了疫情的病原为GHaiNPm2012,并测定了其对试验小鼠的MLD为5 cfu,试验中25 cfu·mL-1攻菌组小鼠死亡2只,可能与组内小鼠个体差异有关,也可能与细菌浓度太低、混合不匀,导致注射菌量差异有关,但通过多次重复,50 cfu·mL-1(10 cfu)组小鼠都在48 h全部致死,表明了GHaiNPm2012菌株具有极强的致病性。同时,对作为Pm重要毒力因子的荚膜的合成相关酶基因hyaD-hyaC进行了克隆分析,结果扩增出包含软骨素合成酶(1—2 919 bp)与UDP-葡萄糖-6-脱氢酶(2 983—4 155 bp)2个开放阅读框(ORFs) 全长4 155 bp的序列,与GenBank已提交基因同源性高达99%,遗传相对稳定,但MegAlign分析发现GHaiNPm2012扩增的DNA序列新出现了5处点突变,全部位于软骨素合成酶(1—2 919 bp)基因ORF内,除第531(A→C)位突变外,其他4处均为同义突变。这也可能与GHaiNPm2012菌株在长期宿主适应中一些性状改变具有一定相关性。另外,药敏试验显示,GHaiNPm2012出现了严重的耐药性,对复方新诺明、链霉素、强力霉素、庆大霉素、复方阿莫西林等10种以上受试药物耐受,仅对氟苯尼考、头孢三嗪、头孢他啶、头孢噻吩和头孢唑肟等5种药物敏感,这点在Pm病防治过程中应该引起重视,一定要科学合理用药。
值得一提的是,本研究在国内首次采用PCR方法[12]对GHaiNPm2012血清型(菌体热抗原)Ⅰ型鉴定后克隆了其扩增靶基因片段,测序后BLAST分析未检测到扩增的303 bp基因片段与GenBank中已提交Pm序列的同源性,与巴氏杆菌科相关的昏睡嗜血杆菌序列(登录号CP000947等)同源性最高的也仅有84%,其具体原因尚有待探究。同时试验中设立的对照菌株C48-1(Ⅰ型)和P1059(3型)扩增结果与报道的血清型相符合,且GHaiNPm2012株和C48-1株的血清型Ⅰ型PCR鉴定产物测序结果完全一致,表明研究中进行Pm血清Ⅰ型鉴定的PCR方法还是比较可靠的,这也为国内进行鹅Pm的血清型分析等相关研究提供了参考依据。
参考文献:
[1] 宋阳,王兆淼,鲁娜. 鹅霍乱多杀性巴氏杆菌分离鉴定及疫苗的制备[J]. 黑龙江畜牧兽医,2011(21):119-120.
[2] 高明燕,徐步,龚建森,等. 11株禽多杀性巴氏杆菌OmpA基因克隆测序及其序列分析[J]. 浙江农业学报,2013,25(5):951-956.
[3] 刘丹丹,王彦红,刘文博. 鹅感染多杀性巴氏杆菌的诊治[J]. 上海畜牧兽医通讯,2012(1):69.
[4] 杨泽晓,周香,王印,等. 肉鹅巴氏杆菌病的诊治[J]. 动物医学进展,2013,34(1):119-122.
[5] 陈溥言.兽医传染病学 [M].5版.北京:中国农业出版社,2008
[6] 刘丽颖,贺文琦,陆慧君,等. 鹅巴氏杆菌病的病原分离鉴定及其病理学观察[J]. 动物医学进展,2007,28(10):33-37
[7] 宋晓娜,刁有祥,高绪慧,等. 一株鹅源巴氏杆菌强毒株的分离及鉴定[J]. 山东农业大学学报(自然科学版) ,2012,43(4):522-528
[8] 赵卫东,张彦明. 伊犁地区水貂巴氏杆菌病的诊断与防治[J]. 动物医学进展,2005,26(9):108-109.
[9] 刘加波,谢芝勋,唐小飞,等. 应用RAPD技术分析禽多杀性巴氏杆菌广西分离株的DNA多态性[J]. 中国兽医科技,2004, 34(8):32-35.
[10] 林星宇,王印,杨泽晓,等. 猪源荚膜血清F型多杀性巴氏杆菌的分离鉴定[J]. 中国兽医科学,2015,45(6):567-571
[11] 李伟杰,赵耘,杜昕波,等. 产毒素多杀性巴氏杆菌菌落双重PCR检测方法的建立[J]. 中国预防兽医学报,2010,32(4):298-300.
[12] TOWNSEND K M, BOYCE J D, CHUNG J Y, et al. Genetic organization ofPasteurellamultocidacaploci and development of a multiplex capsular PCR typing system [J].JournalofClinicalMicrobiology, 2001,39(3): 924-929.
[13] ROCKE T E, SMITH S R, MIYAMOTO A, et al. A serotype-specific polymerase chain reaction for identification ofPasteurellamultocidaserotype 1 [J].AvianDiseases, 2002, 46(2): 370-377.
[14] 林锦鸿,韩有库,胡东良,等. 我国禽多杀性巴氏杆菌血清型调查研究[J]. 中国畜禽传染病,1987,32 (1):1-4.
[15] 郑明. 我国111株由家禽分离的多杀性巴氏杆菌的血清型[J]. 畜牧兽医学报,1984,15(2):51-55.
[16] 陆承平. 兽医微生物学[M]. 4版. 北京:中国农业出版社,2007.
[17] 李浩,刘阳,李长安. 多杀性巴氏杆菌病研究进展[J]. 畜牧兽医杂志,2011,30(2):31-33
(责任编辑 卢福庄)
Isolation, identification of a virulent strain goosePasteurellamultocidaand gene cloning of its serotype associated genes
YANG Ze-xiao1,2, LIU Chang-yu1, WANG Yin1,2, YAO Xue-ping1, WU Xu-long1, WANG Bo1, LI Gui-li1, MENG Zheng-qun1, LIU Ya-dong1
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Wenjiang611130,China; 2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,Wenjiang611130,China)
Goose pasteurellosis, caused by the bacteriumPasteurellamultocida(Pm), was a major infectious disease of goose in China in recent years. To identify the pathogen of goose disease in a goose-breeding farm, the causes of epidemic situation were investigated. A gram-negative bacillus was isolated and purified from the livers and hearts samples of the sick geese that preliminary diagnosed as pasteurellosis based on clinical symptoms and pathological changes, and it was identified as goosePasteurellamultocidaby morphological and cultured characteristics, biochemical tests, animal pathogenic tests, drug sensitivity tests, species and serotype PCRs and so on. Then its serotype associated genes for serotype PCRs were cloned and analysed. The results showed that the goose Pm isolate had typical morphology and biochemical characteristics ofP.multocidasubsp.multocida, and it belonged to capsular type A and serotype Ⅰ. This Pm isolate had a strong pathogenicity, and its minimus lethal dose (MLD) to mice was 5 cfu. Drug sensitivity tests showed that this isolate was only sensitive to cefatrizine, cefalotin, ceftazidime, ceftizoxime and florfenicol. A capsular biosynthesis associated genehyaD-hyaCabout 4 155 bp in this isolated Pm strain was amplified and sequenced, which shared a 99% homology with the published gene sequences. The serotype Ⅰ PCR target gene fragments about 303 bp of this goose Pm strain and the
train C48-1 were purified and sequenced, the sequencing results were exactly the same. All these results indicated that the goose Pm isolate which had a strong pathogenic and belonged to capsular type A and serotype Ⅰ, was the pathogen of goose disease to be diagnosed. And the amplifiedhyaD-hyaCgene sequences and serotype Ⅰ PCR target gene fragments of this Pm isolate both exhibited relative stability.
goose;Pasteurellamultocida; serotype; PCR
10.3969/j.issn.1004-1524.2016.06.06
2015-11-05
四川农业大学双支计划项目(00270401);“十二五”国家科技支撑计划项目(2013BAD12B04)
杨泽晓(1980—),男,河南南阳人,博士,副教授,从事动物疫病防治与兽医公共卫生研究。E-mail:yzxyang2003@126.com
S852.61+2
A
1004-1524(2016)06-0935-09
杨泽晓,刘常钰,王印,等. 一株鹅源多杀性巴氏杆菌强毒株的分离鉴定及其血清型鉴定相关基因的克隆[J].浙江农业学报,2016,28(6): 935-943.
