鱼腥草不同部位生物活性物质和抗氧化能力分析
2016-11-28刘泽静薛生玲田玉肖汤浩茹
刘泽静,薛生玲,夏 雪,田玉肖,张 芬,陈 清,汤浩茹,孙 勃
(四川农业大学 园艺学院,四川 成都611130)
鱼腥草不同部位生物活性物质和抗氧化能力分析
刘泽静,薛生玲,夏 雪,田玉肖,张 芬,陈 清,汤浩茹,孙 勃*
(四川农业大学 园艺学院,四川 成都611130)
为了全面了解鱼腥草的营养价值,以其叶片、地上茎和根状茎为材料,对不同部位的色度、生物活性物质和抗氧化能力进行分析。结果表明:不同部位间的色度、生物活性物质含量及抗氧化能力存在显著差异。叶片正面和地上茎a*值低,b*值高,而叶片背面恰好相反,根状茎亮度值L*最高。叶绿素、类胡萝卜素、维生素C、花青素、原花青素、类黄酮和总酚含量与抗氧化能力在部位分布上呈现叶片>地上茎>根状茎的趋势。相关性分析表明,7种生物活性物质与抗氧化能力间均呈极显著或显著正相关关系(P<0.05),且亚铁还原能力法(FRAP)对应的相关系数均高于总抗氧化能力检测法(ABTS)(原花青素除外)。进一步与8种常见蔬菜进行比较发现,鱼腥草,特别是叶片部分,含有更为丰富的生物活性物质和较高的抗氧化能力,开发潜力巨大。
鱼腥草;不同部位;生物活性物质;抗氧化能力
鱼腥草(HouttuyniacordataThunb.)又名蕺菜、折耳根、朱碧莲等,属三白草科蕺菜属多年生草本植物[1],主要生长在中国西南地区阴冷潮湿的山区,是当地常见的一种野生蔬菜,也是卫生部确定的药食两用植物资源之一[2]。鱼腥草全株均可入药, 《本草纲目》认为鱼腥草具有“散热毒痈肿,断疾解毒”的作用。现代医学研究也证实鱼腥草对金黄色葡萄球菌、肺炎双球菌、流感等均有明显的抑制作用,还有利尿、抗过敏、镇咳、止血等功效[1,3]。同时,鱼腥草也有很高的食用价值,其叶片、地上茎和根状茎均可作为食用部位。鱼腥草富含维生素C、蛋白质、可溶性糖等多种营养成分[1-2,4],此外,黄酮类物质和多酚类物质也广泛存在于鱼腥草中,既影响其风味,同时也与保健功能密切相关,因此是一种营养价值极高的野生蔬菜。
随着生活水平和健康意识的日益提高,人们对于蔬菜品质的认识已经逐渐从外观和常规营养品质转移到具有抗氧化和抗癌等保健功效的生物活性物质[5-10]。目前,国内外对鱼腥草的营养品质和保健价值的研究还较少,现有的研究多是以根状茎为研究对象[1,4],并且多局限于常规营养成分或单一活性物质的分析[2,4],对于鱼腥草不同部位的生物活性物质和抗氧化能力等的分析鲜有报道。为了系统了解其营养价值,本试验以鱼腥草的不同部位为对象,分析其主要色度、生物活性物质含量与抗氧化能力的差异,以期为鱼腥草资源开发和人们日常膳食提供科学依据。
1 材料与方法
1.1 试验材料
试验材料于2013年12月购于雅安雨城区田贸农产品种植有限公司,挑选处于收获期的生长健壮,无病虫害及机械损伤的整株鱼腥草4 kg,1 kg作为1个重复,共4个重复,迅速运回实验室。在实验室中,将鱼腥草表面进行清洗擦干,按照叶片、地上茎和根状茎等3个部位进行分割取样,各部分样品分别混匀后用于生物活性物质与抗氧化能力的测定。
1.2 测定方法
1.2.1 颜色测定
采用柯尼卡CR-10色差仪对鱼腥草叶片正面、背面、地上茎和根状茎进行测色,测定时将样品对准色差仪的集光孔后进行读数,记录其CIE色度系统的明度值(L*)、红/绿值(a*)、黄/蓝值(b*)、饱和度值(C*)值。其中,L*值从0至100表示亮度逐渐增加,a*值从小到大表示红色增强、绿色减退,b*值从小到大表示黄色增强、蓝色减退,C*代表色饱和度[11]。
1.2.2 叶绿素、类胡萝卜素和维生素C含量测定
叶绿素和类胡萝卜素用乙醇溶液提取,分光光度法测定,维生素C含量参照国标GB 6195—1986,采用2,6-二氯靛酚滴定法测定。
1.2.3 花青素含量测定
准确称取0.5 g样品,加入20 mL的含有l%盐酸的甲醇溶液在4 ℃条件下浸提24 h,将提取液稀释后,在535 nm下测定其吸光度,计算样品花青素含量[12]。
1.2.4 原花青素含量测定
称取1.0 g样品置入50 mL离心管中,室温条件加入20 mL提取液[V(丙酮)∶V(去离子水)∶V(醋酸)=150∶49∶1],振荡1 h。5 000 r·min-1离心10 min,吸取上清作为原花青素提取液。在酶标板上每孔加入DMACA溶液210 μL,样品70 μL,640 nm下进行吸光度扫描,以原花青素B2为标准品绘制回归曲线,进而计算各样品中原花青素的含量[13]。
1.2.5 类黄酮含量测定
称取1.0 g样品置入80%丙酮溶液中,室温下抽提1 h后,4 ℃ 5 000 r·min-1离心10 min,收集上清作为类黄酮提取液。在酶标板上每孔分别加入上清液30 μL,95%乙醇90 μL,10%三氯化铝6 μL,1 mol·L-1醋酸钾6 μL和去离子水168 μL,室温反应40 min。用酶标仪测定415 nm下的吸光度,计算类黄酮含量,以mg·kg-1的槲皮素为单位[14]。
1.2.6 总酚含量测定
将1.0 g样品在乙醇溶液中充分研磨后定容至25 mL,水浴1 h,7 000 r·min-1离心10 min,吸取上清作为总酚提取液。取提取液0.3 mL分别加入0.2 mol·L-1福林酚溶剂1.5 mL和碳酸钠溶液1.2 mL,室温下避光静置2 h,在760 nm下测量吸光值。用不同浓度的没食子酸标样做标准曲线,计算样品中总酚的含量[7]。
1.2.7 亚铁还原能力(FRAP)法测定抗氧化能力
将1.0 g样品在乙醇溶液中研磨后水浴1 h,7 000 r·min-1离心10 min,吸取上清作为提取液。提取液中加入FRAP工作液(pH 3.6的醋酸缓冲溶液250 mL中加入10 mmol·L-1TPTZ溶液10 mL,20 mmol·L-1三氯化铁溶液10 mL)2.7 mL,37 ℃水浴10 min,593 nm波长测吸光值。以硫酸亚铁溶液作为标样做标准曲线,计算样品的抗氧化能力[15]。
1.2.8 总抗氧化能力检测(ABTS)法测定抗氧化能力
将样品在乙醇溶液中研磨后水浴1 h,5 000 r·min-1离心10 min,吸取上清作为提取液。在酶标板上每孔加入上清液6 μL和ABTS工作液320 μL,室温反应30 s,734 nm下进行吸光度扫描,每3 min扫描记录1次,共30 min,计算样品的抗氧化能力[16]。
1.3 数据分析
试验数据以4次重复的平均值±标准差表示,数据处理采用Excel 2010软件进行,差异显著性分析和相关性分析采用SPSS 18.0软件进行。热图分析采用TIGR Mev 4.1软件完成[17]。
2 结果与分析
2.1 颜色参数分析
本试验中鱼腥草叶片正面、背面、地上茎和根状茎从外观上呈现绿色、紫红色、绿紫色和乳白色,进一步采用色差仪对其颜色参数进行测定。结果如表1所示:根状茎亮度值L*最高,显著高于其他部位,约为其他部位的2倍;叶片正面的a*值最小,其次是地上茎,两者均小于0,呈现较为明显的绿色,根状茎a*值接近于0,呈白色,而叶片背面a*值最高,呈现较强的红色色度;b*值趋势与a*值恰好相反,叶片背面的蓝色色度最深,其次是根状茎,叶片正面和地上茎最高,黄度最高;色饱和度C*值趋势与b*值基本一致。
表1 鱼腥草不同部位CIE色度测定值
Table 1 The CIE values in different tissues ofHouttuyniacordata

部位L*a*b*C*叶片正面34.96b-8.10d17.78ab19.58a叶片背面32.36b13.00a6.92c14.92b地上茎33.38b-3.07c20.35a20.63a根状茎62.13a-0.60b16.75b16.75b
注:同列不同行数据后没有相同小写字母者表示差异显著(P<0.05)。下同。
2.2 生物活性物质含量分析
本试验对鱼腥草不同部位中主要生物活性物质的含量进行了分析。结果表明:鱼腥草生物活性物质含量非常丰富,如叶片中的维生素C、花青素、类黄酮、总酚含量分别高达1 178.7 mg·kg-1,324.6 mg·kg-1,1 977.6 mg·kg-1和4 570.2 mg·kg-1。如表2所示:7种生物活性物质的含量在鱼腥草植株形态学从上到下呈现下降趋势,在不同部位间存在显著差异,叶片中的各项生物活性物质含量最为丰富,其次是地上茎,根状茎中含量最低。此外,不同生物活性物质在部位间含量差异倍数也明显不同,类黄酮在叶片中的含量达到根状茎的30.95倍,差异倍数最大,而总酚含量在叶片与根状茎中相差不足4倍,差异倍数最小。
各生物活性物质在不同部位中的分布情况可以分为3种类型。第1类为维生素C、花青素和总酚,其特点为3个部位间均存在显著差异;第2类为叶绿素、类胡萝卜素和类黄酮,其特点为叶片中的含量显著地高于地上茎和根状茎,但后两者间无显著差异;第3类为原花青素,其特点为叶片和地上茎含量显著高于根状茎,但叶片与地上茎间差异不显著。
2.3 抗氧化能力分析
鱼腥草的抗氧化能力采用FRAP法和ABTS法进行测定分析。结果如表2:鱼腥草不同部位间的抗氧化能力存在明显差异。采用FRAP法测定,结果表明:叶片的抗氧化能力最强,达到103.6 mmol·kg-1,根状茎最弱,仅为19.6 mmol·kg-1,叶片抗氧化能力是根状茎的5.29倍,且不同部位间均差异显著。采用ABTS法测定,结果表明:叶片和地上茎的ABTS清除率较高,分别达到74.46%和71.41%,两者间无显著差异,根状茎最低,仅为50.42%,约为叶片含量的2/3。
表2 鱼腥草不同部位生物活性物质含量与抗氧化能力
Table 2 The contents of bioactive compounds and antioxidant capacity in different tissues ofHouttuyniacordata
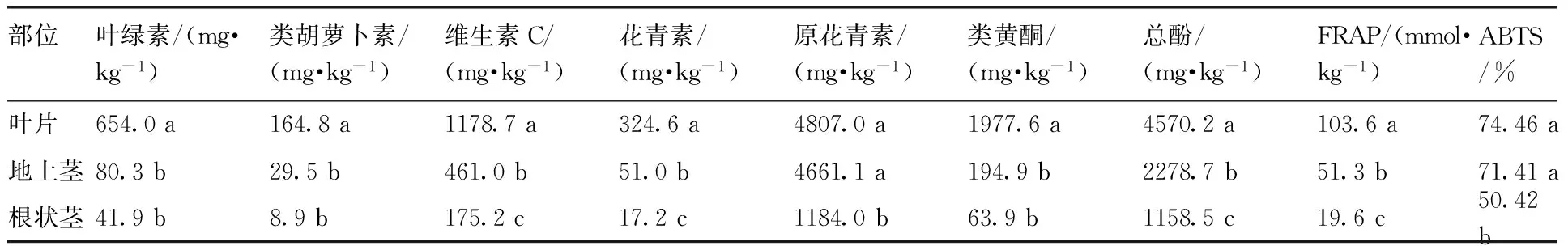
部位叶绿素/(mg·kg-1)类胡萝卜素/(mg·kg-1)维生素C/(mg·kg-1)花青素/(mg·kg-1)原花青素/(mg·kg-1)类黄酮/(mg·kg-1)总酚/(mg·kg-1)FRAP/(mmol·kg-1)ABTS/%叶片654.0a164.8a1178.7a324.6a4807.0a1977.6a4570.2a103.6a74.46a地上茎80.3b29.5b461.0b51.0b4661.1a194.9b2278.7b51.3b71.41a根状茎41.9b8.9b175.2c17.2c1184.0b63.9b1158.5c19.6c50.42b
2.4 相关性分析
鱼腥草生物活性物质与抗氧化能力间的相关性分析结果见表3。所有相关系数均为正值,其中叶绿素和类胡萝卜素的相关系数最高,达到0.994。绝大多数相关系数均呈显著或极显著水平,仅有的几个无显著相关系数均与原花青素有关。FRAP法和ABTS法测定抗氧化能力间相关系数为0.825,呈极显著正相关,此外,2种方法与各项生物活性物质均呈显著或极显著正相关关系。FRAP法测定对应的相关系数均大于0.800,均呈极显著相关性(原花青素除外),其中与维生素C相关系数最高,达到0.955。值得注意的是,除原花青素外,FRAP法则定与各项生物活性物质的相关系数均高于ABTS法。
2.5 与常见蔬菜比较分析
为了进一步揭示鱼腥草的营养价值,我们将文献中报道的番茄[18-19]、白菜[18]、结球甘蓝[18,20]、青花菜[21]、萝卜[22]、胡萝卜[18-19]、洋葱[18]和辣椒[18-19,23]等8种常见蔬菜的生物活性物质含量和抗氧化能力与鱼腥草的进行比较,并以热图形式直观反映(图1)。结果表明,不同蔬菜中的生物活性物质及抗氧化能力存在明显差异。辣椒中类胡萝卜素含量最高,其次是鱼腥草叶片、结球甘蓝、胡萝卜和青花菜,其余几种蔬菜的含量较低;青花菜、鱼腥草叶片和辣椒中维生素C含量较高,其次是鱼腥草地上茎和胡萝卜,其余几种蔬菜的含量较低;白菜、结球甘蓝、青花菜和鱼腥草叶片中叶绿素含量较高,其余几种蔬菜的含量较低;鱼腥草叶片中类黄酮含量最高,其次是白菜、洋葱、青花菜、辣椒和鱼腥草地上茎,其余几种蔬菜的含量较低;鱼腥草三部位中原花青素含量较高,其他蔬菜含量都较低;鱼腥草中总酚含量和FRAP值最高,其次是白菜、青花菜和洋葱,其余几种蔬菜较低。
表3 鱼腥草生物活性物质与抗氧化能力间的相关性
Table 3 Analysis of correlation coefficients among 7 bioactive compounds and 2 antioxidant capacity indexes inHouttuyniacordata
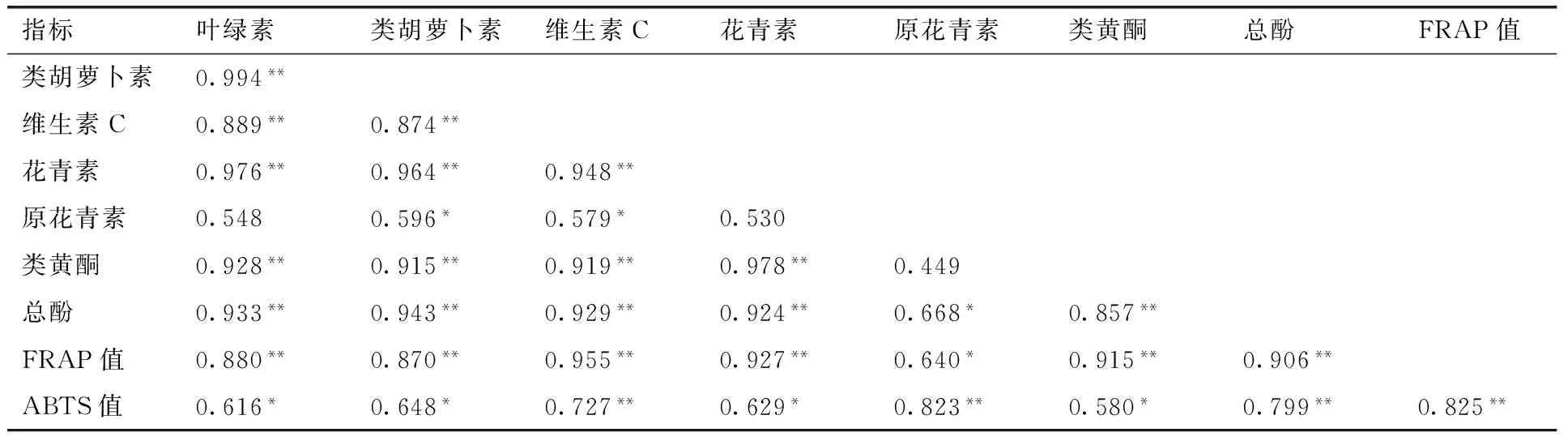
指标叶绿素类胡萝卜素维生素C花青素原花青素类黄酮总酚FRAP值类胡萝卜素0.994**维生素C0.889**0.874**花青素0.976**0.964**0.948**原花青素0.5480.596*0.579*0.530类黄酮0.928**0.915**0.919**0.978**0.449总酚0.933**0.943**0.929**0.924**0.668*0.857**FRAP值0.880**0.870**0.955**0.927**0.640*0.915**0.906**ABTS值0.616*0.648*0.727**0.629*0.823**0.580*0.799**0.825**
注: *和**分别表示差异达0.05显著水平和0.01极显著水平。

每行中颜色由浅到深表示含量从低到高,纯白色单元格表示未见文献报道图1 鱼腥草与几种常见蔬菜生物活性物质含量和抗氧化能力热图Fig.1 Heatmap of antioxidant capacity and bioactive compounds in Houttuynia cordata and several common vegetables
3 讨论
本试验测定了鱼腥草不同部位的生物活性物质含量与抗氧化能力,并与8种常见蔬菜进行了比较。结果表明,与8种常见蔬菜相比,鱼腥草的原花青素、类黄酮和总酚等生物活性物质含量极高,并具有很强的抗氧化能力。研究表明,蔬菜不同部位或组织间的生物活性物质和抗氧化能力存在明显差异。本试验中鱼腥草3个部位间在生物活性物质含量和抗氧化能力上均存在明显差异,叶片中的各项生物活性物质(原花青素除外)含量及FRAP值均显著高于地上茎和根状茎,而原花青素和ABTS值在叶片和地上茎之间无显著差异。类似的结果在其他蔬菜中也有报道,如青花菜花球中的可溶性蛋白、还原糖和可溶性固形物含量显著高于叶片、茎和根系等器官[21],而同为芸薹属蔬菜的青花菜、花椰菜和芥蓝等,其叶片的维生素C、叶绿素、类胡萝卜素和总酚等生物活性物质的含量和抗氧化能力均显著高于花球(花薹)和茎等器官[21,24-25]。
鱼腥草因其叶片正面碧色,背面朱色,喜生于阴凉潮湿之地,因此又名“朱碧莲”。本试验中对鱼腥草不同部位的CIE色度进行了测定,结果表明叶片正面a*值最小,b*值很高,呈现明显的绿色和黄色,而叶背正好相反,呈现明显的红色和蓝色,这种颜色的区别是由植物内部的色素分布不同造成的。不同色素呈现的颜色也不相同,如叶绿素呈现绿色,类胡萝卜素种类较多,叶片中的类胡萝卜素以叶黄素和β-胡萝卜素为主,颜色多为黄色[26],而花青素根据种类及环境的pH值不同,呈现红色、蓝色、紫色等多种颜色[27]。表2结果表明叶片中含有丰富的叶绿素、类胡萝卜素和花青素等有色色素,结合色度结果,推测叶片正面叶绿素和类胡萝卜素含量丰富,叶片背面则富集了花青素,除叶片外,地上茎也积累了较多有色色素。这种分布特点很可能是为了满足植物生长发育中的需要及对环境胁迫适应性的体现。叶片正面积累较多的叶绿素和类胡萝卜素可以保证植物的光合作用,为植株提供能量,叶片背面积累花青素,用以帮助植物适应不良环境。花青素、原花青素、类黄酮和总酚等物质已被证明能够参与植物对病虫害等生物胁迫和低温、水分等非生物胁迫的抗性反应[6,8,13,27]。而鱼腥草的生长环境阴凉潮湿,易产生各种生物和非生物胁迫,因此,地上部积累较多的生物活性物质既是环境条件的诱导所致,也是一种抗逆表现。
近年来,随着人们对饮食健康的日益关注,抗氧化性已成为评价蔬菜内在品质的一项重要指标。科学研究证明,叶绿素、类胡萝卜素、维生素C、花青素、原花青素、类黄酮和总酚等生物活性物质均具有较强的抗氧化性[5-8,13,27],而抗氧化能力是反映样品所有抗氧化物综合效果的指标。本试验中采用的FRAP法和ABTS法是果蔬类生物样品总抗氧化能力测定中常用的2种方法,其中FRAP法具有原理明确、操作简便、易于标准化、反应时间短等优点;ABTS法具有快速简便、与抗氧化剂的生物活性相关性强等优点[28]。本试验测定的7项生物活性物质含量均与2种抗氧化能力指标FRAP值及ABTS值间呈极显著或显著正相关关系(表3),结合前人关于抗氧化方面的文献报道结果,表明本试验中的7项生物活性物质均对鱼腥草的抗氧化能力有贡献。进一步比较2种方法的结果发现,ABTS值与原花青素的分布趋势相似,相关系数也很高,推测原花青素可能对ABTS值贡献较大,而除原花青素外,FRAP值与各指标的相关系数均高于ABTS值,这种现象在其他果蔬中也有报道[22,28],造成这种现象的原因可能是2种方法抗氧化的作用原理及果蔬种类不同。这一结果也表明,FRAP法更适用于鱼腥草抗氧化能力测定。
鱼腥草是我国西南地区常见的极具特色的野生蔬菜。本研究表明,鱼腥草含有丰富的生物活性物质和抗氧化能力,在部位分布上呈现形态学从上到下含量逐渐下降的趋势,即叶片>地上茎>根状茎。相关性分析结果表明,7种生物活性物质有助于提高鱼腥草的抗氧化能力,而且FRAP法可能更适合用于鱼腥草的抗氧化能力测定。通过与8种常见蔬菜的比较发现,鱼腥草,特别是鱼腥草叶片部分,含有更为丰富的多种生物活性物质和较高的抗氧化能力,是人们日常膳食摄取维生素C等活性物质的可靠来源。
[1] 齐迎春,田国政,牟利权. 不同季节鱼腥草营养成分的动态变化研究[J]. 湖北民族学院学报(自然科学版),2002, 20(4): 24-25.
[2] 蔡文国,吴卫,代沙,等. 不同种质鱼腥草总酚、黄酮含量及其抗氧化活性[J]. 食品科学,2013, 34(7): 42-46.
[3] 李式军,刘凤生. 珍稀名优蔬菜80种[M]. 北京:中国农业出版社,1995.
[4] 杨亚玲,周强,刘东辉,等. 固相萃取和高效液相色谱法测定鱼腥草中的黄酮[J]. 云南大学学报(自然科学版),2006, 28(2): 157-160.
[5] VOLDEN J, BENGTSSON G B, WICKLUND T. Glucosinolates, L-ascorbic acid, total phenols, anthocyanins, antioxidant capacities and colour in cauliflower (BrassicaoleraceaL. ssp.botrytis); effects of long-term freezer storage[J].FoodChemistry, 2009, 112(4): 967-976.
[6] IGNAT I, VOLF I, POPA V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J].FoodChemistry, 2011, 126(4): 1821-1835.
[7] SUN B, YAN H Z, LIU N, et al. Effect of 1-MCP treatment on postharvest quality characters, antioxidants and glucosinolates of Chinese kale[J].FoodChemistry, 2012, 131(2): 519-526.
[8] SUN B, YAN H Z, ZHANG F, et al. Effect of plant hormones on main health-promoting compounds and antioxidant capacity of Chinese kale[J].FoodResearchInternational, 2012, 48(2): 519-526.
[9] 郝艳玲,刘增,牟婷婷,等. 乌洋芋与紫薯营养成分比较[J]. 浙江农业学报,2014, 26(5): 1336-1340.
[10] 邵金华,李涛,杨佳. 微波辅助大蒜多糖的提取及其抗氧化活性的研究[J]. 浙江农业学报,2013, 25(4): 868-872.
[11] 程怡,张云婷,王清明,等. 月季花发育过程中花色变化的生理生化研究[J]. 西北植物学报,2014, 34(4): 733-739.
[12] 李云飞,李彦慧,王中华,等. 土壤干旱胁迫对紫叶矮樱叶片呈色的影响[J]. 生态学报,2009, 29(7): 3678-3684.
[13] PRIOR R L, FAN E, JI H P, et al. Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders[J].JournaloftheScienceofFoodandAgriculture, 2010, 90(9): 1473-1478.
[14] CHANG C C, YANG M H, WEN H M, et al. Estimation of total flavonoid content in propolis by two complementary colorimetric methods[J].JournalofFoodandDrugAnalysis, 2002, 10(3): 178-182.
[15] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay[J].AnalyticalBiochemistry, 1996, 239(1): 70-76.
[16] WOOTTON-BEARD P C, MORAN A, RYAN L. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and afterinvitrodigestion measured by FRAP, DPPH, ABTS and Folin-Ciocalteu methods[J].FoodResearchInternational, 2011, 44: 217-224.
[17] SUN B, ZHANG F, ZHOU G J, et al. Genetic variation in alkaloid accumulation in leaves ofNicotiana[J].JournalofZhejiangUniversitySCIENCEB, 2013, 14(12): 1100-1109.
[18] BAHORUN T, LUXIMON-RAMMA A, CROZIER A, et al. Total phenol, flavonoid, proanthocyanidin and vitamin C levels and antioxidant activities of Mauritian vegetables[J].JournaloftheIndianMedicalAssociation, 2004, 84(12): 1553-1561.
[21] 孙勃,许映君,徐铁峰,等. 青花菜不同器官生物活性物质和营养成分的研究[J]. 园艺学报,2010, 37(1): 59-64.
[22] 张皓月,吴益梅,夏雪,等. 青萝卜与红萝卜的生物活性物质及抗氧化能力分析[J]. 浙江大学学报(农业与生命科学版),2015, 41(1): 75-81.
[23] LEONG S Y, OEY I. Effects of processing on anthocyanins, carotenoids and vitamin C in summer fruits and vegetables[J].FoodChemistry, 2012, 133(4): 1577-1587.
[24] 孙勃,许映君,袁高峰,等. 花椰菜主要生物活性物质及抗氧化能力分析[J]. 核农学报,2010, 24(2): 330-335.
[25] 孙勃,方莉,刘娜,等. 芥蓝不同器官主要营养成分分析[J]. 园艺学报,2011, 38(3): 541-548.
[26] LEFSRUD M, KOPSELL D, WENZEL A, et al. Changes in kale (BrassicaoleraceaL. var.acephala) carotenoid and chlorophyll pigment concentrations during leaf ontogeny[J].ScientiaHorticulturae, 2007, 112(2): 136-141.
[27] PARK N, XU H, LI X H, et al. Anthocyanin accumulation and expression of anthocyanin biosynthetic genes in Radish (Raphanussativus)[J].JournalofAgriculturalandFoodChemistry, 2011, 59(11): 6034-6039.
[28] 朱玉昌,焦必宁. ABTS法体外测定果蔬类总抗氧化能力的研究进展[J]. 食品与发酵工业,2005, 31(8): 77-80.
(责任编辑 张 韵)
Analysis of bioactive compounds and antioxidant capacities inHouttuyniacordata
LIU Ze-jing, XUE Sheng-ling, XIA Xue, TIAN Yu-xiao, ZHANG Fen, CHEN Qing, TANG Hao-ru, SUN Bo*
(CollegeofHorticulture,SichuanAgriculturalUniversity,Chengdu611130,China)
In order to understand the nutritional values ofHouttuyniacordata, the CIE color values, bioactive compounds contents and antioxidant capacities among different organs (leaves, stems and rhizomes) inHouttuyniacordatawere investigated in the present study. The results showed that significant differences were found among different tissues. The adaxial leaf surface and stems owned lowera*value and higherb*value, while the abaxial leaf surface was on the contrary, and the rhizomes had the highestL*value. The levels of chlorophyll, carotenoids, vitamin C, anthocyanins, proanthocyanidins, flavonoids, total phenolics and antioxidant capacities were followed as the trends of leaves> stems > rhizomes. Moreover, significant or extremely significant(P<0.05) positive correlations were found between antioxidant capacities and each bioactive compound. In addition, all the correlation coefficients associated with FRAP were higher than the corresponding values with ABTS, except proanthocyanidins. Then the levels of bioactive compounds and antioxidant capacities were compared betweenHouttuyniacordatawith eight kinds of common vegetables. The results showed thatHouttuyniacordata, especially leaves, contained more abundant bioactive compounds and antioxidant capacity, indicatingHouttuyniacordatahas great potential for development of functional vegetable.
Houttuyniacordata; different tissues; bioactive compounds; antioxidant capacities
10.3969/j.issn.1004-1524.2016.06.14
2015-10-09
四川省教育厅重点项目(14ZA0016);四川农业大学本科质量工程项目(04052109);四川农业大学本科论文培育计划项目(06309007)
刘泽静(1984—),女,四川攀枝花人,硕士,讲师,从事园艺植物遗传育种研究。E-mail:liuzejing@sicau.edu.cn
*通信作者,孙勃,E-mail:14099@sicau.edu.cn
S647
A
1004-1524(2016)06-0992-07
刘泽静,薛生玲,夏雪,等. 鱼腥草不同部位生物活性物质和抗氧化能力分析[J].浙江农业学报,2016,28(6): 992-998.
