齐口裂腹鱼耳石早期生长发育与日轮特征研究
2016-11-24刘小帅智蔡跃平胡佳祥严太明
刘小帅 何 智蔡跃平 胡佳祥 熊 森 严太明
(四川农业大学动物科技学院, 雅安 625014)
齐口裂腹鱼耳石早期生长发育与日轮特征研究
刘小帅 何 智*蔡跃平 胡佳祥 熊 森 严太明
(四川农业大学动物科技学院, 雅安 625014)
文章研究了在实验室条件下齐口裂腹鱼仔稚鱼耳石早期形态发育与生长特点、第一轮纹出现时间和轮纹沉积规律。结果表明: 在13.5—17.2℃孵化条件下, 微耳石和矢耳石在出膜前形成, 而星耳石于出膜后第12天出现。在仔稚鱼生长过程中, 微耳石由近圆形发育成贻贝形, 矢耳石经历近圆形、锲形后发育为箭矢状,星耳石形状由近圆形发育为星芒状。微耳石的前区、背区和腹区及矢耳石的背区和腹区生长呈幂函数关系,而微耳石的后区、矢耳石前区和后区生长以及两对耳石的前后区半径之和与全长均呈线性相关。在(18.5±0.5)℃和(15.6±1.1)℃条件下, 50%矢耳石样本第一轮纹均在出膜后第 2 天形成(分别为出膜后18h和19h), 以后每天形成一轮。微耳石和矢耳石轮纹数均与日龄呈线性相关, 方程斜率均与1差异不显著(P>0.05),表明两对耳石的轮纹沉积均为日周期性。这些结果为研究齐口裂腹鱼野生种群繁殖期和早期生活史特征等生态学问题提供了重要依据。
耳石; 形态发育; 日轮; 生长; 齐口裂腹鱼
鱼类耳石记录了个体成长的大量信息[1—4], 广泛应用于年龄与种属鉴定、种群特征、生长研究[4,5]。尽管大多数淡水硬骨鱼类耳石早期形态变化具有很大的相似性, 轮纹沉积具有日周期性特点,但受遗传因素和环境因子的共同作用, 耳石的形态发育特征和轮纹沉积规律也表现出一定的物种特异性[1,6—9]。因此, 将耳石日轮技术应用于早期生活史特点、产卵期或产卵场位置推算等研究[10—12]之前, 还需要通过养殖实验对其耳石微结构特点等进行有效评估。
齐口裂腹鱼(Schizothorax prenanti)是裂腹鱼亚科的一种重要经济鱼类, 分布在水温较低、水流湍急的长江上游、金沙江、大渡河及岷江等水域[13]。由于水利水电工程建设导致大量适宜生境丧失[14], 加之过度捕捞和环境污染影响, 野生资源明显衰退[15]。目前, 人工增殖放流是补充和恢复资源群体的有效手段。借助耳石标记形成的独特的轮纹特征, 可较好地实现规模化群体标记和放流种群的有效监测。本文拟通过室内养殖的齐口裂腹鱼仔稚鱼研究其耳石形态变化、生长和轮纹沉积规律, 为研究其野外群体的生活史特点和标记放流等提供基础资料。
1 材料与方法
1.1 耳石形态发育及生长研究
2013年4月, 将在芦山宝剑渔业有限公司养殖场人工授精的齐口裂腹鱼受精卵带回四川农业大学实验室常温(13.5—17.2℃)静水孵化, 充氧泵增氧。选择1h内出膜的仔鱼置于白色塑料盆(36.0 cm× 28.0 cm×12.0 cm)内, 每日9:00时和21:00时分别置于20℃和12℃生化培养箱中培育, 进行常规饲养管理。
出膜后前12天(days post hatching, dph)每日随机取样10—15尾, 15—39 dph间隔2d—3d取样1次,45—88 dph间隔4—6d取样1次, 每次10尾。实验鱼用盐酸利多卡因(浓度为30 ml/L)麻醉后, 用游标卡尺测量鱼体全长(Total length, TL)(精确度0.02 mm)。仔稚鱼断头后, 在光学显微镜下挑取3对耳石, 无水乙醇清洗后用中性树胶固定于载玻片上, 备用。
用Olympus CKX41照相系统对耳石样本拍照观察耳石形态发育过程, 同时选取255 dph幼鱼耳石样本为对照, 以确定耳石形态发育稳定期。参考严太明等[16]测量微耳石和矢耳石各区半径。参照Song等[17]于光学显微镜下统计微耳石和矢耳石轮纹数, 以及微耳石和矢耳石的中心核和原基类型及比例。因星耳石的轮纹不清晰, 本实验只对其形态特征变化过程进行描述。
1.2 耳石轮间距研究
2014年4月, 将在雅安市大渡河黑马鱼类增殖放流站内人工授精的齐口裂腹鱼受精卵带回实验室, 参照2013年的研究方法(见1.1), 改变培育温度(18℃和12℃), 在研究耳石中心核类型及比例、轮纹数与日龄的关系以及耳石生长的基础上, 增加测量微耳石和矢耳石轮间距(测量起点为耳石原基中心位置), 测量方法参照Song等[17]。
1.3 第一日轮沉积规律研究
材料来源同1.2。1h内出膜的初孵仔鱼分别置于18℃和15℃的生化培养箱恒温孵化培育, 每隔1h随机取样30尾, 连续取样25h, 用于统计第一轮纹出现时间。
1.4 数据处理
2 结果
2.1 耳石形态发育
水温在13.5—17.2℃下, 2013年齐口裂腹鱼受精卵在受精后126h听囊出现, 呈椭圆形。受精后136h, 听囊中出现分散的细小颗粒, 即微耳石和矢耳石耳石前体。受精后146h, 细小颗粒聚集形成2—5个结晶, 随后(受精后166h)结晶融合发育为近圆形。受精卵历时173h出膜, 初孵仔鱼全长[(12.10±0.68) mm], 此时微耳石和矢耳石仍为近圆形。
耳石形态发育结果表明, 微耳石和矢耳石在出膜之前均已出现, 星耳石在出膜后12d开始出现,3对耳石形态随仔稚鱼发育逐渐变化(图 1)。微耳石在仔鱼开口摄食时[12 dph, TL=(15.14±0.75) mm],形态变化不大, 仍为近圆形。到臀鳍形成时[25 dph, TL=(19.70±1.97) mm)], 微耳石由近圆形发育为贻贝形。当微耳石发育成后区突出明显的肾形时[70 dph, TL=(32.78±1.48) mm], 稚鱼尾柄部侧线处开始出现鳞片。而当峡部鳞片出现时[88 dph,TL=(39.27±1.95) mm], 微耳石形态变化不明显。
矢耳石在仔鱼开口摄食时发育为锲形, 在臀鳍形成时, 发育为明显的箭矢状。在稚鱼尾柄部侧线处开始出现鳞片时, 矢耳石背区隆起。之后在峡部鳞片出现时, 除背部出现明显的凹陷外, 形态变化不明显。星耳石在发育过程中, 缺刻凹入数量有所增加, 但形态变化不明显。
到实验结束, 88 dph稚鱼微耳石形态与255日龄幼鱼接近, 但矢耳石形态与其差异较大, 主要表现在背区隆起不明显, 腹区翼叶未出现, 星耳石的差异主要表现在星芒状不明显。
2.2 耳石微结构
微耳石和矢耳石中心核及原基 统计结果表明, 微耳石(2013年, n=280; 2014年, n=517)和矢耳石(2013年, n=293; 2014年, n=485)中心核(N)及原基(P)类型基本一致, 主要为1N1P、1N2P、1N3P和2N2P(图 2)。其中, 微耳石1N1P和矢耳石1N2P类型所占比例最高。
耳石第一轮纹出现 耳石第一轮纹完成率(Completion rate, CR)与出膜时间(Hours post hatching, H)的关系如图 3所示。出膜时间为20:00—21:00的仔鱼在水温(15.6±1.1)℃条件下, 完成第一轮沉积需19.0h (理论值为18.49h, n=1050), 此后每天形成一轮。而出膜时间为08:00—09:30的仔鱼在水温(18.5±0.5)℃条件下, 第一轮纹形成需要18.0h (理论值为17.75h, n=1020), 以后每天形成一轮。经过计算, 50%耳石样本出现第一轮所需有效积温为1286.18 ℃ h。
耳石轮纹数与日龄 2013—2014年微耳石(n=280, n=517)和矢耳石(n=293, n=485)的轮纹数(微耳石, IL; 矢耳石, IS)与日龄差异不显著(P=0.124,P=0.053)。耳石轮纹数(IL, IS)与出膜天数(D)均呈线性相关(图 4), 方程斜率与1差异均不显著(P>0.05), 表明两对耳石的轮纹沉积均呈日周期性,生长轮为日轮。
轮间距 对40 dph仔鱼微耳石(n=35)和矢耳石(n=51)样本统计发现, 矢耳石的第一轮间距[(21.25±3.98) μm]大于微耳石[(18.90±2.04) μm], 但此后二者在第一个峰值处均出现同样的变化趋势[(5.70±0.80) μm, (4.63±0.72) μm]。此后, 微耳石轮纹间距呈持续缩小趋势, 而矢耳石间距呈现波动变化, 后期则趋于稳定。
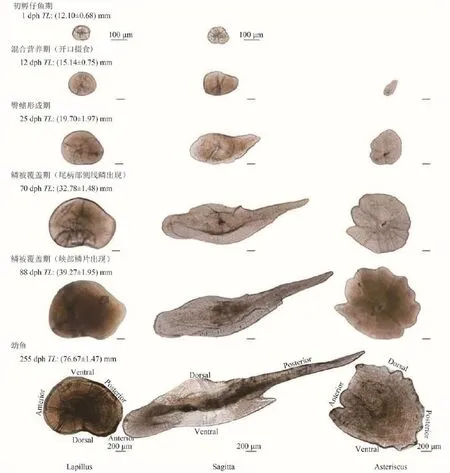
图 1 齐口裂腹鱼耳石形态发育Fig. 1 Otoliths development in Schizothorax prenanti
2.3 耳石生长特征
耳石生长 2013年(n=280)和2014年(n=517)齐口裂腹鱼微耳石样本前、后、背、腹的生长差异显著(P=0.000), 但各区域的生长趋势均一致, 前区、背区和腹区的生长为对数关系(图 6A、C和D), 后区的生长呈现线性相关(图 6B)。
矢耳石(2013年, n=293; 2014, n=485)的生长表现与微耳石相似(P=0.000)。但与微耳石不同, 矢耳石前、后区生长呈线性相关(图 7A、B), 背、腹区生长呈对数相关(图 7C、D)。
耳石长度与鱼体全长 2013年齐口裂腹鱼仔稚鱼微耳石(OLL)(图 8A)和矢耳石(OLS)(图8B)长度(前区和后区半径之和)与仔稚鱼全长(TL)呈线性相关, 方程分别为: OLL=0.01178TL-0.1109 (R2=0.9033, n=280, P<0.001), OLS= 0.02095TL-0.2272 (R2=0.9120, n=293, P<0.001)。
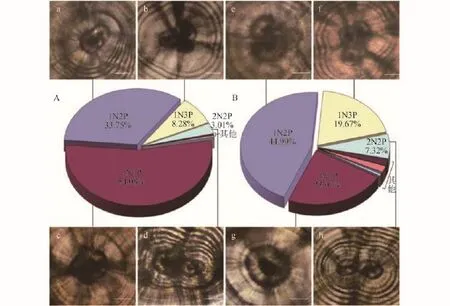
图 2 齐口裂腹鱼微耳石(A)和矢耳石(B)样本中不同中心核和原基类型比例Fig. 2 The proportions of otoliths with different numbers of nucleus and primordium in lapilli (A) and sagittae (B) of Schizothrax prenanti
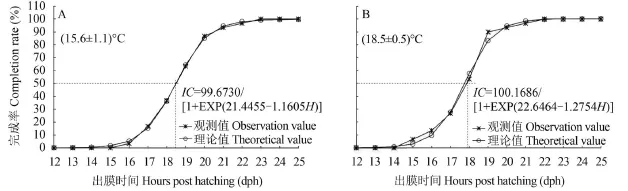
图 3 不同温度下齐口裂腹鱼仔鱼耳石第一轮纹完成率Fig. 3 Completion rates of the first increment in lapilli and sagittae of Schizothrax prenanti larvae at different temperatures
3 讨论
本研究表明, 齐口裂腹鱼仔稚鱼微耳石形态变化不大, 由近圆形发育成贻贝形, 但矢耳石变化最为剧烈, 由近圆形发育成箭矢状。耳石形态的变化过程总体上与已报道的淡水鱼类很相似, 如叉尾斗鱼(Macropodus opercularis)[18]、唐鱼(Tanichthys albonubes)[19]、鲢(Hypophthalmichthys molitrix)[20]、草鱼(Ctenopharynodon idellus)[20]、鳙(Aristichthys nobilis)[20]、胭脂鱼(Myxocyprinus asiaticus)[17]和骨唇黄河鱼(Chuanchia labiosa)[16]等。受遗传和环境因素影响, 不同鱼类耳石的形态发育特征也表现出一定的物种特异性。在本实验中, 齐口裂腹鱼微耳石经历的贻贝形和肾形发育时期, 与叉尾斗鱼的近椭圆形和菱形[18], 胭脂鱼的卵圆形、椭圆形和贻贝形[17]以及同属于裂腹鱼亚科的骨唇黄河鱼的椭圆形和扇形[16]等表现出一定的差异。此外, 齐口裂腹鱼矢耳石形态变化的典型特征与其他鱼类存在较大差别, 如胭脂鱼的中间发育过程包括纺锤形、后端梨形、前端钝圆等几个阶段[17], 唐鱼发育经历了前端较尖、后端圆钝、中间呈卡腰状的发育阶段[19], 骨唇黄河鱼经历了椭圆形、菱形以及长箭矢形[16]。这些结果表明, 在早期耳石形态发育过程中,耳石形态已表现出明显的物种特异性, 将有助于仔稚鱼的分类鉴定等。
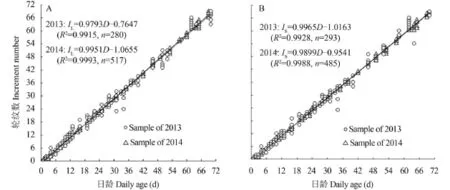
图 4 齐口裂腹鱼微耳石(A)和矢耳石(B)轮纹数与日龄的关系Fig. 4 The relationship between daily age and the number of increment of lapilli (A) and sagittae (B) in Schizothorax prenanti

图 5 齐口裂腹鱼微耳石(A)和矢耳石(B)上前40个生长轮纹宽度变化Fig. 5 Trajectory of the width of the first 40 daily increments in lapilli (A) and sagittae (B) of Schizothrax prenanti
研究表明, 小眼绿鳍鱼(Chelidonichthys spinosus)体长达到161—216 mm时, 形态才相对稳定, 可见耳石形态与个体大小关系密切[21]。在本研究中,88日龄稚鱼[TL=(39.27±1.95) mm]微耳石形态与255日龄幼鱼[TL=(76.67±1.47) mm]差异不大, 但是矢耳石因翼叶未出现和前区的突出不明显而表现出了较大的差异。这提示我们, 在应用早期耳石形态进行齐口裂腹鱼形态判别时, 将微耳石作为研究材料, 全长达到近40 mm个体可基本满足实验要求,若选择矢耳石则需要选择更大个体。
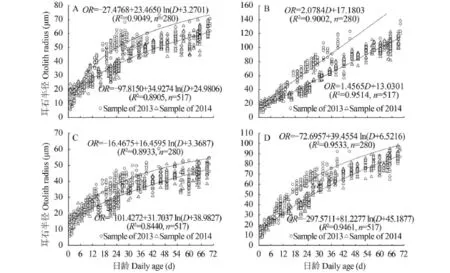
图 6 齐口裂腹鱼微耳石半径与日龄的关系Fig. 6 The relationship between daily age and otoliths radius of lapilli in Schizothorax prenanti
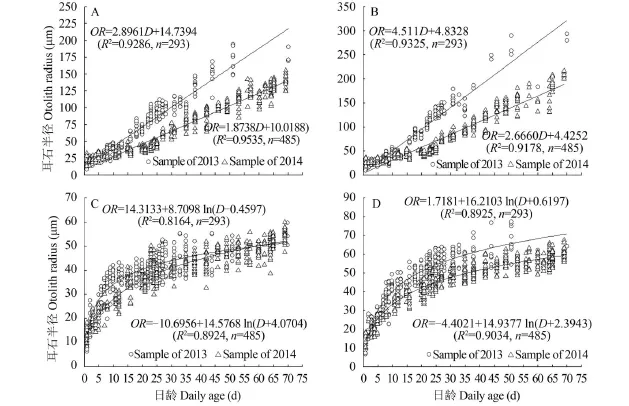
图 7 齐口裂腹鱼矢耳石半径与日龄的关系Fig. 7 The relationship between daily age and otoliths radius of sagittae in Schizothorax prenanti
在本研究中齐口裂腹鱼仔鱼在(15.6±1.1)℃水温条件下, 矢耳石第一轮纹出现需19.0h, 在水温(18.5±0.5)℃条件下, 则需要18.0h, 这与胭脂鱼[17]、唐鱼[19]等鱼类在出膜后第2天内形成第一轮的观察结果一致, 但与蓝罗非鱼(Oreochromis aureus)[22]和白鲑属(Coregonidae spp.)鱼类[23]孵化前形成, 黑鲷(Acanthopagrus schlegeli)[24]和狭鳕(Theragra chal-cogramma)[25]孵化时形成, 南方鲇(Silurus meridionalis)[26]和仔鳗(Anguilla japonica elvers)[27]于孵化后24h内出现, 梭鱼(Chelon haematocheilus)第3天出现的结果[28]不同。由此可以看出, 第一轮纹的形成时间存在物种差异, 这可能和环境条件与个体发育等因素相关。如裘氏鳄头冰鱼(Champsocephalus gunnari)和大西洋鲱(Clupea harengus)耳石第一日轮形成受摄食等因素的影响[29,30], 遮目鱼(Chanos chanos)[31]与内源性营养转换有关, 竹荚鱼(Trachurus japonicus)与开口摄食有关[32]。此外, 本研究对齐口裂腹鱼的微耳石和矢耳石轮纹数进行逐日取样观察发现, 耳石生长轮均为日轮, 故其日龄(N)可用日轮数D+1表示, 这与大部分鱼类[26,27,33]的报道一致, 研究结果可直接应用于繁殖期推算和早期生长等方面的研究。
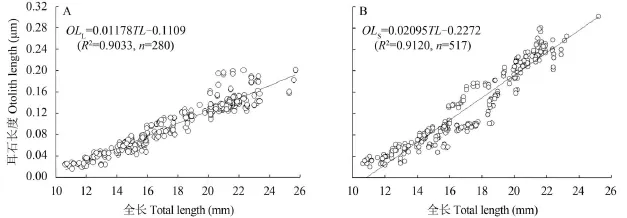
图 8 齐口裂腹鱼微耳石(A)和矢耳石(B)长度与全长的关系Fig. 8 The relationship between otoliths radius of lapilli (A) or sagittae (B) and the total length of Schizothorax prenanti
研究结果表明, 在养殖条件下的齐口裂腹鱼微耳石和矢耳石轮间距第2轮到第5轮为增宽的趋势,第5个轮纹处达到最大值, 此后微耳石呈逐渐变窄的趋势, 矢耳石波动变化, 二者在后期逐渐稳定。第2—5轮纹间距的增宽与仔鱼卵黄的快速吸收、全长和体重等生长变化显著关系密切(本实验室研究结果)。此后, 耳石轮间距的变化可能是其生长发育过程、环境因子如水温、饵料可获得性等综合影响的结果。长江口凤鲚(Coilia mystus)幼鱼矢耳石前20条轮纹间距有逐渐变窄的趋势, 20轮到第50个轮纹宽度显著升高, 之后生长较为平稳, 推测这种变化可能是个体发育和环境因子共同作用的结果[34]。香鱼(Plecoglossus altivelis)矢耳石轮纹间距经历了变窄、稳定到后期变宽的趋势, 这与其生活环境中饵料生物的丰度、自身的洄游以及繁殖活动关系密切[35]。太湖新银鱼(Neosalanx taihuensis)在110日龄之前, 由于饵料生物较丰富, 轮纹沉积速度加快, 之后因食性转变和食物可得性差日轮
[1]Huang Y F, Cheng F, Murphy B R, et al. Sagittal otolith microstructure, early growth and development of Coilia ectenes in the Yangtze Estuary, China [J]. Fisheries Science, 2014, 80(3): 436—443
[2]Joh M, Matsuda T, Satoh N, et al. Otolith microstructure of brown sole Pseudopleuronectes herzensteini: validation of daily ring formation and the occurrence of microstructure denoting metamorphosis [J]. Fisheries Science,2011, 77(5): 773—783
[3]Capoccioni F, Costa C, Aguzzi J. Ontogenetic and environmental effects on otolith shape variability in three Mediterranean European eel (Anguilla anguilla, L.) local stocks [J]. Journal of Experimental Marine Biology and Ecology, 2010, 397(1): 1—7
[4]Campana S E. Otolith science entering the 21st century[J]. Marine and Freshwater Research, 2005, 56(5): 485—495
[5]Lord C, Morat F, Lecomte-Finiger R, et al. Otolith shape analysis for three Sicyopterus (Teleostei: Gobioidei: Sicydiinae) species from New Caledonia and Vanuatu [J]. Environmental Biology of Fishes, 2012, 93(2): 209—222
[6]Yamada H, Chimura M, Asami K, et al. Otolith development and daily increment formation in laboratory-reared larval and juvenile black-spot tuskfish Choerodon schoenleinii [J]. Fisheries Science, 2009, 75(5): 1141—1146
[7]Xie Y H, Li B. Effects of starvation and photoperiod on the otolith deposition and increment formation in the larval big head Aristichthys nobilis [J]. Journal of Dalian Fisheries University, 1999, 14(3): 1—6 [解玉浩, 李勃.饥饿和光照对鳙仔鱼耳石沉积和日轮形成的影响. 大连水产学院学报, 1999, 14(3): 1—6]间距逐渐变窄[36]。可以看出, 耳石日轮宽度的变化特点反应了仔稚鱼早期生长中所经历的环境条件。
[8]Vignon M, Mora F. Environmental and genetic determinant of otolith shape revealed by a non-indigenous tropical fish [J]. Marine Ecology Progress Series, 2010, 411: 231—241
[9]Parmentier E, Vandewalle P, Lagardère F. Morphoanatomy of the otic region in carapid fishes: ecomorphological study of their otoliths [J]. Journal of Fish Biology,2001, 58(4): 1046—1061
[10]Otxotorena U, Díez G, Abechuco E, et al. Estimation of age and growth of juvenile hakes (Merluccius merluccius Linneaus, 1758) of the Bay of Biscay and Great Sole by means of the analysis of macro and microstructure of the otoliths [J]. Fisheries Research, 2010, 106(3): 337—343
[11]Gabriela S, Pristab N, Costab M J. Estimating meager(Argyrosomus regius) size from otoliths and vertebrae [J]. Journal of Archaeological Science, 2012, 39(9): 2859—2865
[12]Song Z B, Chang J B, Cao W X, et al. Otolith microstructure of hatchery-reared and wild juveniles of grass carp,(Ctenopharyngodon idellus) [J]. Acta Hydrobiologica Sinica, 2003, 27(1): 7—12 [宋昭彬, 常剑波, 曹文宣, 等.人工饲养和野生草鱼幼鱼耳石微结构的比较研究. 水生生物学报, 2003, 27(1): 7—12]
[13]Ding R H. The Fishes of Sichuan, China [M]. Chengdu: Sichuan Publishing House of Science & Technology. 1994. 370—371 [丁瑞华, 四川鱼类志. 成都: 四川科技出版社. 1994, 370—371]
[14]Xia J, Wang Y R, Tan Y P. Impaction analysis of hydropower project construction tohabitat of Schizothorax prenanti [J]. Sichuan Water Conservancy, 2010, (2): 59—62 [夏娟, 王玉蓉, 谭燕平. 水电工程建设对齐口裂腹鱼栖息地的影响分析. 四川水利, 2010, (2): 59—62]
[15]Xie J Y. Research advances on Schizothorax prenanti in China [J]. Journal of Anhui Agricultural Sciences, 2010,38(25): 13721—13722, 13726 [谢佳燕. 我国齐口裂腹鱼的研究现状. 安徽农业科学, 2010, 38(25): 13721—13722, 13726]
[16]Yan T M, Hu J X, Yang T, et al. Study on the otolith development and the formation of increments in larvae and juvenile of Chuanchuia labiosa [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 764—771 [严太明, 胡佳祥, 杨婷,等. [骨唇]黄河鱼耳石早期形态发育和轮纹特征研究.水生生物学报, 2014, 38(4): 764—771]
[17]Song Z B, Fu Z D, Li J, et al. Validation of daily otolith increments in larval and juvenile Chinese sucker, Myxocyprinus asiaticus [J]. Environmental Biology of Fishes,2008, 82(2): 165—171
[18]Zhao T, Chen G Z, Lin X T. Otolith ontogeny and increment formation of larval Macropodus opercularis [J]. Journal of Fishery Sciences of China, 2010, 17(6): 1364—1370 [赵天, 陈国柱, 林小涛. 叉尾斗鱼仔鱼耳石形态发育与日轮形成特征. 中国水产科学, 2010, 17(6): 1364—1370]
[19]Shi F, Sun J, Lin X T, et al. Otolith ontogeny and increment formation in larval Tanichthys albonubes [J]. Chinese Journal of Zoology, 2006, 41(4): 10—16 [史方,孙军, 林小涛, 等. 唐鱼仔鱼耳石的形态发育及日轮. 动物学杂志, 2006, 41(4): 10—16]
[20]Zeng X B. Studies on otolith mprphology in larval-young silver carp, bighead, and grass carp with the application in species discrimination [D]. Huazhong Agricultural University, Wuhan. 2001 [曾祥波. 鲢鳙和草鱼仔幼鱼耳石形态及种类鉴别中的应用. 2001. 武汉. 华中农业大学]
[21]Zhang X X, Ye Z J, Wang Y J, et al. Study on otolith morphology of Chelidonichthys spinosus in the Qingdao coastal waters [J]. Periodical of Ocean University of China, 2009, 39(4): 622—626 [张晓霞, 叶振江, 王英俊,等. 青岛海域小眼绿鳍鱼耳石形态的初步研究. 中国海洋大学学报, 2009, 39(4): 622—626]
[22]Karakiri M, Hammer C. Preliminary notes on the formation of daily increments in otoliths of Oreochromis aureus [J]. Journal of Applied Ichthyology, 1989, 5(2): 53—60
[23]Eckmann R, Rey P. Daily increments on the otoliths of larval and juvenile Coregonus spp., and their modification by environmental factors [J]. Hydrobiologia, 1987,148(2): 137—143
[24]Huang W B, Chiu T S. Daily increments in otoliths and growth equation of black porgy, Acanthopagrus schlegeli,larvae [J]. Acta Zoologica Taiwanica, 1997, 8(2): 121—131
[25]Nishimura A, Yamada J. Age and growth of larval and juvenile walleye pollock, Theragra chalcogramma (Pallas),as determined by otolith daily growth increments [J]. Journal of Experimental Marine Biology and Ecology,1984, 82(2): 191—205
[26]Yang F, Peng W H. A study of the daily growth increment of otolith in the larvae and juvenile of Silurus slidatovi meridionalls Chen [J]. Journal of Southwest Agricultural University, 2001, 23(4): 340—342 [杨帆, 彭文辉. 南方鲇仔幼鱼耳石日轮的研究. 西南农业大学学报,2001, 23(4): 340—342]
[27]Li C H, Sha X S. Periodicity of increment formation in the otolith of laboratory-reared Anguilla Japonica larvae[J]. Oceanologia et Limnologia Sinica, 1995, 26(4): 408—413 [李城华, 沙学绅. 日本鳗鲡早期阶段耳石日生长轮形成的周期. 海洋与湖沼, 1995, 26(4): 408—413]
[28]Li C H, Sha X S, You F, et al. Daily growth increment in otolith of Mullet larvae, Mugil soiuy Basilewsky and determination from field-collected ones [J]. Oceanologia et Limnologia Sinica, 1993, 24(4): 345—349 [李城华, 沙学绅, 尤锋, 等. 梭鱼仔耳石日轮形成及自然种群日龄的鉴定. 海洋与湖沼, 1993, 24(4): 345—349]
[29]Morley S A, Belchier M, Dickson J, et al. Daily otolith increment validation in larval mackerel icefish, Champso-cephalus gunnari [J]. Fisheries Research, 2005, 75(1): 200—203
[30]Høie H, Folkvord A, Johannessen A. Maternal, paternal and temperature effects on otolith size of young herring(Clupea harengus L.) larvae [J]. Journal of Experimental Marine Biology and Ecology, 1999, 234(2): 167—184
[31]Tzeng W N, Yu S Y. Effects of starvation on the formation of daily growth increments in the otoliths of milkfish,Chanos chanos (Forsskål), larvae [J]. Journal of Fish Biology, 1992, 40(1): 39—48
[32]Xie S, Watanabe Y. Transport-determined early growth and development of jack mackerel Trachurus japonicus juveniles immigrating into Sagami Bay, Japan [J]. Marine and Freshwater Research, 2007, 58(11): 1048—1055
[33]Zhu Q G, Wang J, Yang S R, et al. Studies on the otolith microstructure, the daily age and the growth of Culter alburnus juveniles at early developmental stages in the Mudong section of the Three Gorges Reservoir [J]. Acta Hydrobiologica Sinica, 2015, 39(5): 983—988 [朱其广,王健, 杨少荣, 等. 三峡库区木洞江段翘嘴鲌早期生长特征研究. 水生生物学报, 2015, 39(5): 983—988]
[34]He W P, Li Y X, Li Z J, et al. Sagittal otolith microstructure, daily age and early growth of Coilia mystus juveniles in the Yangtze Estuary [J]. Journal of Fisheries of China, 2013, 37(4): 496—501 [何文平, 黎雨轩, 李钟杰,等. 长江口凤鲚幼鱼的耳石微结构、日龄与生长. 水产学报, 2013, 37(4): 496—501]
[35]Xie Y H, Li B, Fu L J, et al. On daily-growth increment of otolith and growth of ayu fish from Yalujiang River[J]. Acta Zoologica Sinica, 1995, 41(2): 125—133 [谢玉浩, 李勃, 富丽静, 等. 鸭绿江香鱼耳石日轮与生长的研究. 动物学报, 1995, 41(2): 125—133]
[36]Yang Q R, Liu J H, Wu Q, et al. Salmoniformes studies on daily-growth increment of otolith and growth of Taihu Icefish, Neosalanx taihuensis [J]. Freshwater Fisheries,2007, 37(3): 59—62 [杨青瑞, 刘建虎, 吴强, 等. 三峡水库太湖新银鱼耳石日轮与生长的研究. 淡水渔业, 2007,37(3): 59—62]
STUDIES ON THE ONTOGENY, GROWTH AND DAILY INCREMENT OF OTOLITHS IN LARVAE AND JUVENILES OF SCHIZOTHORAX PRENANTI
LIU Xiao-Shuai, HE Zhi, CAI Yue-Ping, HU Jia-Xiang, XIONG Sen and YAN Tai-Ming
(College of Animal Science and Technology, Sichuan Agricultural University, Ya’an 625014, China)
We performed observation and analysis on the development of the otoliths of larvae and juveniles of Schizothorax prenanti in the laboratory from 2013 to 2014. The procedures were carried out at the hatching temperature 13.5—17.2℃. Lapilli and sagittae formed before hatching, and the asteriscus first appeared on the 12th day post hatching (DPH 12). Lapilli and sagittae had rounded shapes at hatching. As developed the shape of lapilli finally changed into reniform, whereas sagittae became wedge-shaped, the long ellipse shape, and eventually changed into long pointed posterior. The shape of the asteriscus remained mussel-like during the development. The growth of the anterior, dorsal and ventral areas of lapilli, and ventral and dorsal areas of sagittae showed an exponential pattern. The growth of the posterior area of lapilli, and the anterior and posterior areas of sagittae was linear. Furthermore, the summed length of anterior and posterior radius in sagittae and lapilli were linearly related to the total length of the larvae and juveniles. The first increment on the sagittae of larvae appeared on DPH 2 (18 hours post hatching and 19 hours post hatching) at(18.5±0.5)℃ and (15.6±1.1)℃. Then one more increment of lapilli and sagittae was formed each day. The number of increments on lapilli and sagittae was linearly related to the age, and the slopes of the equations were close to 1.0(P>0.05). These results demonstrated a daily formation of otoliths increments. Furthermore, our study provided more clues on the ecological characteristics of Schizothorax prenanti, including breeding seasons and the development at early stage.
Otoliths; Morphology development; Daily increment; Growth; Schizothorax prenanti
10.7541/2016.37
Q954.5
A
1000-3207(2016)02-0268-09
2015-05-24;
2015-08-13
国家自然科学基金资助项目(31402286); 四川农业大学学科建设双支计划(03570822)资助 [Supported by the National Natural Science Foundation of China (31402286); Double Support Plan of Discipline Construction of Sichuan Agricultural University(03570822)]
刘小帅 (1990—), 男, 山西省原平市人; 硕士研究生; 主要研究方向为鱼类生态学。E-mail: 414087828@qq.com *何智对本文的贡献等同于第一作者
严太明, E-mail: yantaiming@sina.com
