饲料中铜、钙水平对大黄鱼幼鱼生长、抗氧化酶及脂代谢酶活性的影响
2016-11-24谢奉军龚诗雁王日昕
来 杭 黎 明 陶 震 谢奉军 黎 庆 龚诗雁 王日昕
(宁波大学海洋学院, 宁波 315211)
饲料中铜、钙水平对大黄鱼幼鱼生长、抗氧化酶及脂代谢酶活性的影响
来 杭 黎 明 陶 震 谢奉军 黎 庆 龚诗雁 王日昕
(宁波大学海洋学院, 宁波 315211)
为研究钙对摄食高铜饲料的大黄鱼幼鱼生长性能、抗氧化酶类及脂代谢酶类活性的影响, 研究采用2×2双因子实验设计, 配制了4组实验饲料, 共包含2个铜水平(4和24 mg/kg)和2个钙水平(0.5%和3%), 分别命名为: -Cu-Ca、+Cu-Ca、-Cu+Ca和+Cu+Ca, 饲喂大黄鱼幼鱼[(4.05±0.31) g]10周, 每个处理组设置3个重复。结果表明, 高铜组(+Cu-Ca和+Cu+Ca)实验鱼的存活率、终末体质量和增重率显著低于低铜组(-Cu-Ca和-Cu+Ca)(P<0.05); 高铜组实验鱼肝脏和肌肉中的铜含量显著高于低铜组, 而高钙组(-Cu+Ca和+Cu+Ca)实验鱼肌肉中的铜含量却显著低于低钙组(-Cu-Ca和+Cu-Ca)(P<0.05); 高铜组实验鱼肝脏中的糖原含量显著低于低铜组(P<0.05); 实验鱼肝脏中的超氧化物歧化酶、过氧化物酶、谷胱甘肽过氧化物酶、6-磷酸葡糖酸脱氢酶、异柠檬酸脱氢酶和脂肪酸合成酶活性, 高铜组显著低于低铜组, 而高钙组却显著高于低钙组, 但硫代巴比妥酸反应物含量和脂蛋白脂肪酶活性正好相反(P<0.05); 饲料中铜和钙的交互作用显著影响了实验鱼肌肉中的铜含量、硫代巴比妥酸反应物含量、6-磷酸葡糖酸脱氢酶、脂肪酸合成酶和脂蛋白脂肪酶活性(P<0.05)。研究表明, 钙能够缓解摄食高铜饲料对大黄鱼幼鱼造成的伤害。
大黄鱼; 铜; 钙; 抗氧化酶; 脂代谢酶
铜(Copper, Cu)是生命活动中许多关键代谢酶类的重要组成部分, 鱼类从食物中摄入的铜达到适宜需求量的4—6倍时会导致铜中毒[1]。鱼类铜中毒的典型症状包括: 氧化损伤[2]、鳃和肝脏组织病变[3]、生长抑制, 甚至死亡等[4]。研究证实, 铜离子具有较强的底物竞争性抑制作用, 能够与血液中的清蛋白(Albumin)大量结合, 导致游离脂肪酸由于缺乏足够的载体而在肝细胞中大量积聚, 从而造成脂代谢失衡和氧化损伤, 这是造成鱼类体脂沉积和“脂肪肝”的重要原因之一[5]。受到全球环境问题的影响, 饲料原料(如鱼粉、肉骨粉、啤酒酵母及芝麻饼等)中铜含量超标已成为不可控因素。据不完全统计, 大多数鱼类对铜的适宜需求量为4—6 mg/ kg, 而市售的动物饲料中铜含量为18.2—119.4 mg/ kg, 是鱼类适宜需求量的4—20倍[6]。近年来, 由于饲料中重金属超标造成鱼类养殖业经济损失的状况日趋严重, 因此探寻鱼类铜中毒的缓释手段就成为亟待解决的重要问题[7]。
愈来愈多的研究发现, 营养素之间存在复杂的相互促进和抑制作用[8]。钙(Calcium, Ca)被认为是对铜毒性具有直接缓释作用的营养素[9]。研究发现, 向高铜含量的养殖水体中添加适宜(50 mg Ca/L)的钙后, 黄颡鱼(Pelteobagrus fulvidraco)肝脏中脂代谢相关酶类活性提高, 肝脏组织切片发现,肝细胞排列紧密, “脂肪肝”症状得到缓解[10]。然而,通过提高鱼类饲料中的钙水平, 能否对铜毒性造成的生理损伤起到缓释作用, 迄今尚不十分清楚。
大黄鱼(Larimichthys crocea)是我国传统的四大海水养殖鱼类之一, 素有“海水国鱼”的美誉。近年来, 养殖大黄鱼体脂沉积问题凸显, “脂肪肝”的高发生率严重影响了大黄鱼的生长速度和养殖的经济效益[11]。本研究通过测定摄食不同铜、钙水平饲料的大黄鱼幼鱼的生长性能、肝脏抗氧化酶类及脂代谢酶类活性, 分析高铜摄入对大黄鱼抗氧化体系和脂质代谢的不利影响, 并评估钙对鱼类铜中毒的缓释效果。
1 材料与方法
1.1 实验饲料
采用2×2双因子实验设计, 配制4组等氮(粗蛋白46%)、等脂(粗脂肪10%)的半精制饲料, 包含2个铜水平(4和24 mg/kg; 大黄鱼对铜的最适需求量为3.41 mg/kg[12]; 养殖海区海水中铜含量实测值为5.10 μg/L)和2个钙水平(0.5%和3%; 海水鱼对钙的最适需求量约为0.5%[13]; 养殖海区海水中钙含量实测值为4.01 mg/L), 4组饲料分别被命名为: -Cu-Ca、+Cu-Ca、-Cu+Ca和+Cu+Ca。所有原料经粉碎后过60目筛网, 按比例混合, 加入适量水揉匀, 经挤条机加工成直径2.0 mm的颗粒状饲料, 室温阴干至水分<10%, 置于封口袋中-20℃保存。实验饲料配方及营养成分见表 1。
1.2 养殖管理及取样
新购大黄鱼幼鱼(4.05±0.31) g经商业饲料驯化14d后, 随机投放到12个养殖网箱中(1.5 m×1.5 m× 2.0 m), 每个网箱60尾, 设置3个重复。饱食投喂每天两次(05:00—06:00, 17:00—18:00), 持续10周, 详细记录投喂量。在养殖过程中, 水温21—25℃, 盐度22‰—26‰, 溶解氧(6.8±0.15) mg/L。
在养殖结束后, 所有鱼禁食24h。采用MS-222麻醉后称重, 并记录存活数; 每个网箱随机挑选3尾鱼, -20℃保存, 用于测定全鱼体成分; 每个网箱另选5尾鱼, 解剖后分别称量内脏重和肝脏重, 计算肝体指数和脏体指数, 并将解剖获得的肝脏保存于-20℃, 用于测定肝脏粗成分、铜和肝糖原含量、抗氧化酶类和脂代谢酶类活性; 剥离背侧肌肉保存于-20℃, 用于测定肌肉中的铜含量。
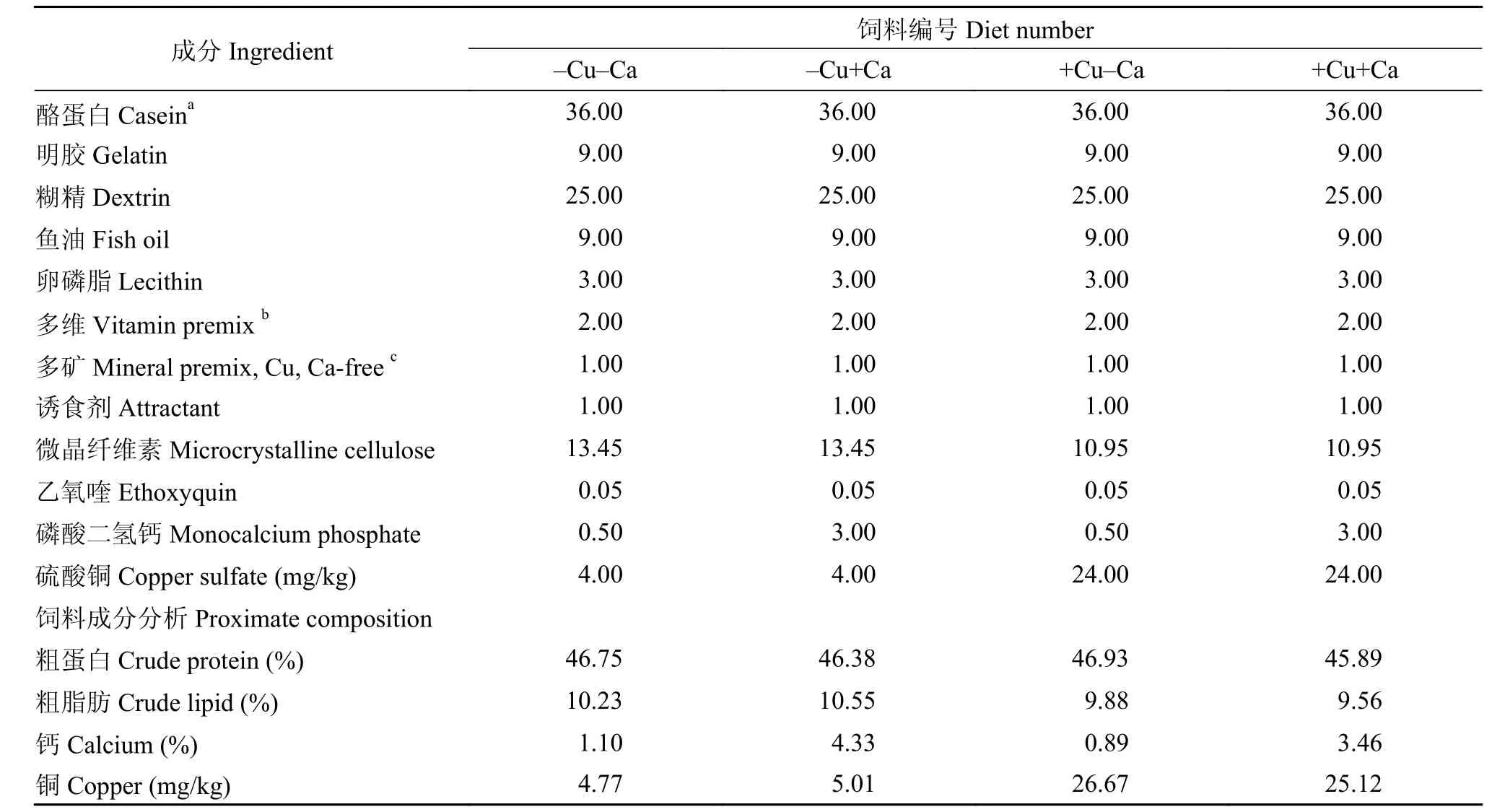
表 1 实验饲料配方以及营养组成Tab. 1 Ingredient and chemical proximate composition of the experimental diets (%)
1.3 成分分析
实验饲料及组织样品成分分析采用AOAC[14]的标准方法。样品于烘箱中105℃至恒重, 测定水分含量; 碳化后的样品置于马弗炉中600℃至恒重,测定灰分含量; 蛋白质含量测定采用FP-528全自动蛋白质分析仪(Leco公司, 美国密歇根); 脂肪含量测定采用2055全自动索氏抽提仪(Foss公司, 瑞典赫加奈斯)。铜、钙含量测定采用ICP-OES电感耦合等离子体原子发射光谱仪(瓦里安公司, 美国加州)。所有测试均设置3个重复, 下同。
1.4 肝脏抗氧化酶类活性和糖原含量测定
肝脏样品于预冷的磷酸缓冲液(50 mmol/L, pH 7.4)中匀浆, 匀浆液于4℃环境中2000×g离心15min分离上清液备测。所有测试均采用商业试剂盒(南京建成生物工程研究所, 中国南京), 严格按照说明书进行操作。上清液蛋白含量测定采用考马斯亮蓝法, 以牛血清白蛋白为对照品, 于595 nm处测定其吸光度; 超氧化物歧化酶活性(SOD)测定采用比色法, 于550 nm处测定其吸光度。酶活单位定义为每毫克蛋白每分钟抑制氯化硝基四氮唑蓝(NBT)自氧化速率达50%时的酶消耗量为1个酶活单位。过氧化物酶(CAT)活性测定采用比色法, 于 405 nm处测定其吸光度, 酶活单位定义为每毫克蛋白每分钟使反应体系中吸光度减少0.1的酶消耗量为1个酶活单位。谷胱甘肽过氧化物酶(GPX)活性测定采用比色法, 于412 nm处测定其吸光度, 酶活单位定义为每毫克蛋白每分钟使反应体系中GSH浓度降低1 μmol/L为1个酶活单位。硫代巴比妥酸反应物(TBARS)含量的测定采用比色法, 于532 nm处测定其吸光度。按肝脏样品质量︰碱液体积= 1︰3混合, 沸水浴20 min备测, 采用蒽酮比色法于620 nm处测定吸光度, 计算获得肝脏中糖原(Gn)含量。
1.5 肝脏脂代谢酶类活性测定
肝脏样品于预冷的缓冲液(0.02 mol/L Tris-HCl, 0.25 mol/L蔗糖, 2 mmol/L EDTA, 0.1 mol/L NaCl, 0.5 mmol/L PMSF, 0.01 mol/L β-巯基乙醇,pH 7.4)中匀浆, 匀浆液于4℃环境中20000×g离心30min分离上清液备测[6]。所有测试均采用商业试剂盒(南京建成生物工程研究所, 中国南京), 严格按照说明书进行操作。6-磷酸葡糖酸脱氢酶(6PGD)、苹果酸酶(ME)、异柠檬酸脱氢酶(ICDH)和脂肪酸合成酶(FAS)活性的测定采用比色法, 于340 nm处测定其吸光度, 酶活单位定义为每毫克蛋白每分钟使反应体系中底物浓度降低1 μmol/L为1个酶活单位。脂蛋白脂肪酶(LPL)活性的测定采用比色法,于340 nm处测定其吸光度, 酶活单位定义为每毫克蛋白每小时消耗1 μmol游离脂肪酸时的酶消耗量为1个酶活单位。
1.6 计算方法和统计分析
存活率(Survival rate, %)=100×存活尾数/初始尾数;
增重率(Weight gain rate, %)=100×(末体质量-初体质量)/初体质量;
饲料效率(Feed efficiency)=(末体质量-初体质量)/干饲料消耗量;
肝体指数(Hepatosomatic index, %)=100×肝脏重/末体质量;
脏体指数(Viscerosomatic index, %)=100×内脏重/末体质量。
实验数据采用双因素方差分析(Two-way ANOVA)进行统计学处理, 结果以平均值±标准差(mean±SD)表示, 显著性水平设置为P<0.05。所有分析均采用SPSS 18.0.0在Windows操作系统中进行。
2 结果
2.1 生长性能和体成分
为期10周的养殖实验结束后, 实验鱼的存活率>66.11%, 其中, 高铜组(+Cu-Ca和+Cu+Ca)实验鱼的存活率显著低于低铜组(-Cu-Ca和-Cu+Ca)(P<0.05),而饲料中钙水平并未对存活率造成显著影响(P>0.05)(表 2); 饲料中铜水平显著影响了实验鱼的生长性能, 高铜组实验鱼的终末体质量和增重率显著低于低铜组(P<0.05), 而饲料中钙水平并未显著影响终末体质量和增重率(P>0.05); 饲料效率、肝体指数和脏体指数未受到饲料中铜和钙水平的影响(P>0.05); 饲料中铜和钙的交互作用未对实验鱼的终末体质量、增重率、饲料效率、肝体指数、脏体指数及存活率造成显著影响(P>0.05)。
饲料中铜和钙水平并未显著影响实验鱼全鱼和肝脏中的水分、粗蛋白、粗脂肪和灰分含量, 上述指标也未受到饲料中铜和钙交互作用的显著影响(P>0.05, 表 3)。实验鱼肝脏和肌肉中的铜含量受到饲料中铜水平的影响, 高铜组显著高于低铜组,而肌肉中的铜含量还受到饲料中钙水平的影响, 高钙组(-Cu+Ca和+Cu+Ca)显著低于低钙组(-Cu-Ca和+Cu-Ca)(P<0.05), 但肝脏中的铜含量却未受到饲料中钙水平的显著影响(P>0.05); 实验鱼肝脏中糖原含量受到饲料中铜水平的影响, 高铜组显著低于低铜组(P<0.05), 但饲料中钙水平并未对糖原含量造成显著影响(P>0.05)。饲料中铜和钙的交互作用显著影响了实验鱼肌肉中的铜含量(P<0.05), 却未对肝脏中的铜和糖原含量造成影响(P>0.05, 表 4)。
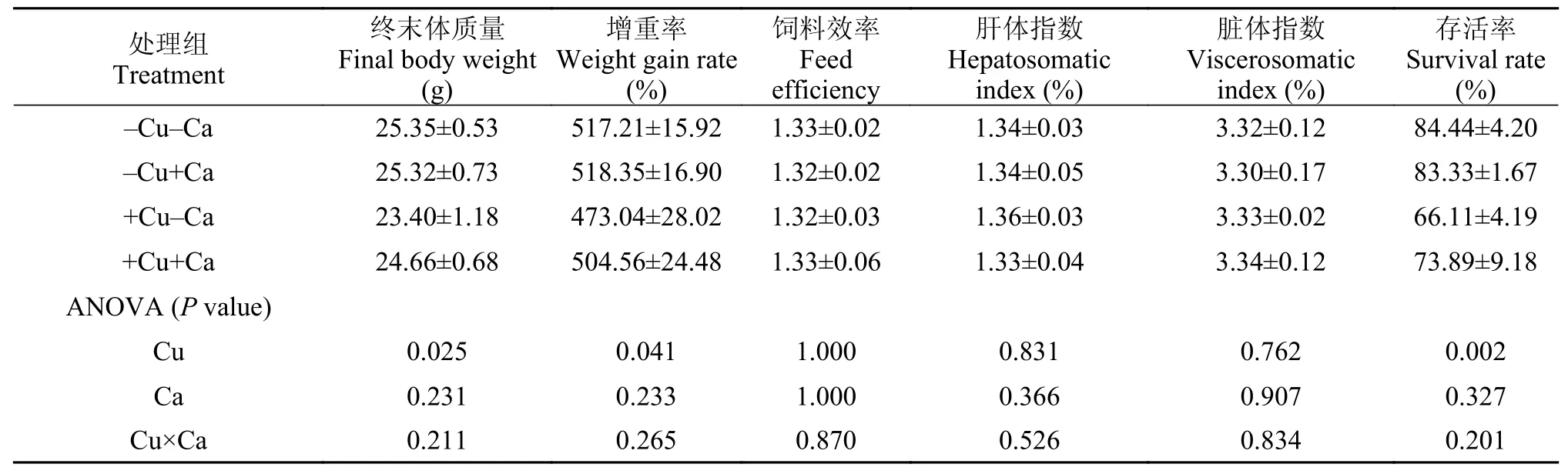
表 2 大黄鱼幼鱼的存活率和生长性能Tab. 2 The survival and growth performance of juvenile large yellow croaker

表 3 大黄鱼幼鱼的全鱼和肝脏成分Tab. 3 The whole-body and liver compositions of juvenile large yellow croaker (%)
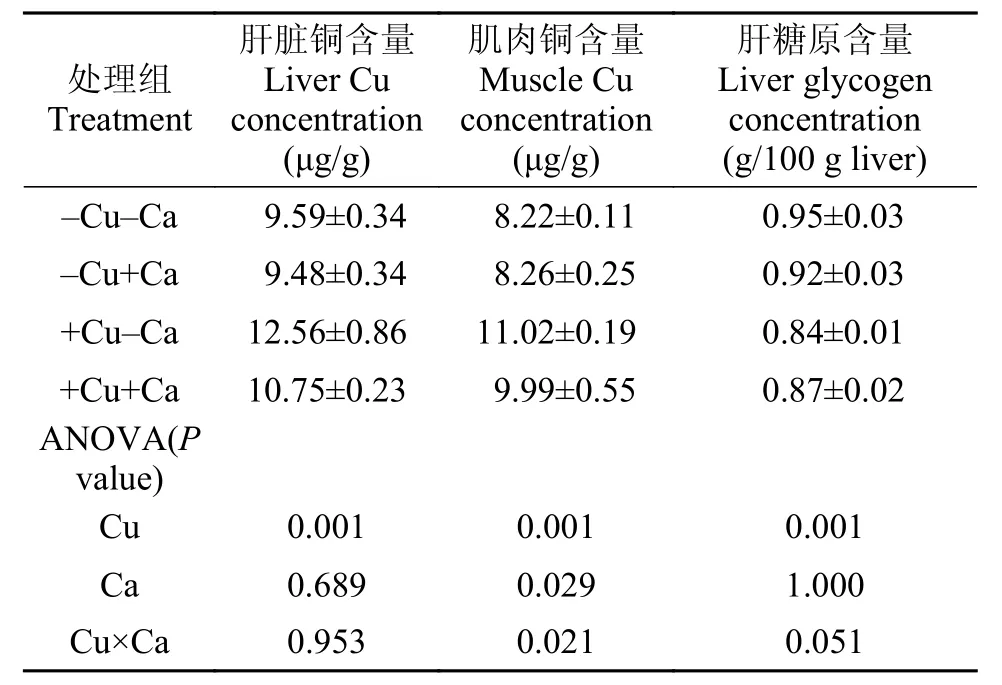
表 4 大黄鱼幼鱼肝脏和肌肉中的铜及肝糖原含量Tab. 4 The concentrations of liver and muscle Cu and liver glycogen of juvenile large yellow croaker
2.2 肝脏抗氧化酶类活性及过氧化程度
实验鱼肝脏中的超氧化物歧化酶、过氧化物酶和谷胱甘肽过氧化物酶活性受到饲料中铜和钙水平的影响, 高铜组显著低于低铜组, 而高钙组显著高于低钙组(P<0.05, 表 5); 高铜组实验鱼肝脏中的硫代巴比妥酸反应物含量显著高于低铜组, 而高钙组则显著低于低钙组(P<0.05); 实验鱼肝脏中的超氧化物歧化酶、过氧化物酶和谷胱甘肽过氧化物酶活性未受到饲料中铜和钙交互作用的显著影响(P>0.05), 但交互作用显著影响了肝脏中硫代巴比妥酸反应物含量(P<0.05)。
2.3 肝脏脂代谢酶类活性
饲料中铜和钙水平显著影响了实验鱼肝脏中6-磷酸葡糖酸脱氢酶、异柠檬酸脱氢酶和脂肪酸合成酶活性, 高铜组显著低于低铜组, 高钙组显著高于低钙组(P<0.05, 表 6); 脂蛋白脂肪酶活性也受到饲料中铜和钙水平的显著影响, 但趋势正好相反(P<0.05); 实验鱼肝脏中的苹果酸酶活性仅受到饲料中铜水平的影响, 高铜组显著低于低铜组(P<0.05),而饲料中钙水平并未对其活性造成显著影响(P>0.05); 实验鱼肝脏中的6-磷酸葡糖酸脱氢酶、脂肪酸合成酶和脂蛋白脂肪酶活性受到饲料中铜和钙交互作用的显著影响(P<0.05), 而苹果酸酶和异柠檬酸脱氢酶却未受到交互作用的影响(P>0.05)。

表 5 大黄鱼幼鱼肝脏中抗氧化酶活性Tab. 5 Liver antioxidant enzyme activities of juvenile large yellow croaker

表 6 大黄鱼幼鱼肝脏中脂肪酸代谢酶活性Tab. 6 Liver fatty acid metabolism enzyme activities of juvenile large yellow croaker (mIU/mg protein)
3 讨论
3.1 生长性能和体成分
鱼类从食物中摄入铜的含量超过生理耐受上限会影响存活率[15]。在本研究中, 为期10周的养殖实验结束后, 摄食适宜铜含量饲料(低铜组)的大黄鱼存活率保持在较高的水平(>83.33%), 而摄食高铜含量饲料(高铜组饲料中铜含量为适宜需求量的6倍)的大黄鱼存活率仅为66.11%—73.89%, 表明大黄鱼对饲料中铜含量超标较为敏感。过量的铜摄入不仅会导致鱼类死亡, 还会影响其生长性能, 原因可能与机体的解毒耗能有关: 食物中过量的铜会导致鱼体血液中游离脂肪酸含量升高, 继而诱发生理紊乱, 机体为了维持内稳态, 往往会启动一系列生理适应性反应进行调节, 而代谢支出的提高, 会影响生长对能量的需求[16]。在本研究中, 高铜含量饲料的摄入明显抑制了大黄鱼的生长性能(如增重,-Cu+Ca组>+Cu+Ca组; -Cu-Ca组>+Cu-Ca组)。类似的发现在其他鱼类研究中也有报道, 如罗非鱼(Oreochromis niloticus×Oreochromis aureus)[17]、石斑鱼(Epinephelus malabaricus)[18]、黄颡鱼[19]和草鱼(Ctenopharyngodon idellus)[20]等。前人的研究提出, 营养素之间存在复杂的相互促进和抑制作用。在正常生理条件下, 食物中的铜进入动物消化道后,在氨基酸络合剂协助下被运输到肠黏膜上, 与超氧化物歧化酶或金属硫蛋白相结合, 通过磷酸化ATP酶介导的铜离子通道转运进入血液, 载体蛋白在整个过程发挥极其重要的作用。然而, 其他金属元素如钙、铁、锌等的转运过程与铜相似, 因此相互间存在着竞争性抑制作用[21]。Wurts和Perschbacher[9]发现, 外源补充钙对急性铜胁迫下的斑点叉尾(Ictalurus punctatus)具有明显的毒性缓释作用。在本研究中, 尽管提高了高铜饲料中钙的含量, 却未对大黄鱼的生长性能造成影响, 但发现实验鱼的增重指标+Cu+Ca组(20.69 g)>+Cu-Ca组(19.39 g), 基于这个发现, 能否通过进一步提高饲料中的钙含量或延长养殖周期, 达到缓解鱼类生长抑制的目的,尚需进一步研究。
本研究发现, 受到饲料中铜水平的影响, 高铜组实验鱼肝脏和肌肉中的铜含量显著高于低铜组,而肝脏中的铜含量明显高于肌肉, 这与前人的研究结果是一致的: Chen等[10]检测发现, 铜在黄颡鱼组织中积累的浓度顺序为: 肝脏>鳃>肾脏>脊椎>肠道>肌肉; Tekin-Ozan和Kir[22]报道, 鲤(Cyprinus carpio)肝脏和鳃组织中重金属含量最高, 而肌肉中重金属含量最低; Arellano等[23]发现, 铜在塞内加尔鳎(Solea senegalensis)肝脏组织中的含量显著高于鳃组织。此外, 本研究通过提高高铜饲料中的钙水平,显著降低了实验鱼肌肉中的铜含量, 并检测到饲料中铜和钙对实验鱼肌肉中的铜含量变化具有显著的交互作用(P=0.021)。这可能与铜和钙在动物体内存在竞争性抑制作用有关, 而钙更容易与载体蛋白相结合[24]。虽然大黄鱼肝脏中的铜含量并没有因为钙水平的提高发生显著的变化, 但肌肉作为鱼类主要的可食用部分, 铜含量的显著降低, 从食品安全角度来看是有利的。本研究还发现, 高铜组实验鱼肝脏中糖原含量显著低于低铜组, 这个发现进一步验证了前面论述中提到的解毒耗能造成生长性能下降的推测。糖类是生物体的主要能量物质,葡萄糖聚合物通常以糖原的形式储存于动物体的肝脏和肌肉中, 当能量需求发生时(如饥饿、胁迫等), 糖原能够快速分解成葡萄糖, 继而进行氧化供能[25]。
3.2 肝脏抗氧化酶类活性及过氧化程度
鱼类摄入过量的铜与载体蛋白结合, 引起血液中游离脂肪酸含量升高, 阻断β氧化, 大量游离脂肪酸进入非氧化代谢通路生成神经酰胺, 产生大量有毒的自由基(ROS), 导致醛酮类物质过度积累, 通过与蛋白和核酸等发生交联聚合, 诱发细胞毒性和器官衰竭[26]。在本研究中, 高铜组大黄鱼肝脏中的超氧化物歧化酶、过氧化物酶及谷胱甘肽过氧化物酶活性显著低于低铜组, 而硫代巴比妥酸反应物含量显著高于低铜组, 表明过量摄入铜会抑制大黄鱼抗氧化酶活性, 可能造成醛酮类物质积累, 该发现与前人的研究结果是一致的。姚志峰等[27]发现, 过量铜摄入能够显著抑制中华鲟(Acipenser sinensis Gray)幼鱼肝脏中超氧化物歧化酶、过氧化氢酶和谷胱甘肽抗氧化酶活性。聂志娟等[28]发现高浓度的铜能够对刀鲚(Coilia nasus)幼鱼肝脏中超氧化物歧化酶和过氧化氢酶活性造成抑制。在本研究中,通过提高高铜饲料中的钙水平, 发现+Cu+Ca组实验鱼肝脏中抗氧化酶活性显著高于+Cu-Ca组, 而硫代巴比妥酸反应物的含量显著低于+Cu-Ca组,提示通过提高饲料中的钙水平, 能够对抗氧化酶活
[1]Watanabe T, Kiron V, Satoh S. Trace minerals in fish nutrition [J]. Aquaculture, 1997, 151(1—4): 185—207
[2]Wendelaar Bonga S E. The stress response in fish [J]. Physiological Reviews, 1997, 77(3): 591—625
[3]Monteiro S, Rocha E, Mancera J, et al. A stereological study of copper toxicity in gills of Oreochromis niloticus[J]. Ecotoxicology and Environmental Safety, 2009, 72(1): 213—223
[4]Liu X, Luo Z, Xiong B, et al. Effect of waterborne copper exposure on growth, hepatic enzymatic activities and histology in Synechogobius hasta [J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1286—1291
[5]Chen Q L, Luo Z, Pan Y X, et al. Differential induction of enzymes and genes involved in lipid metabolism in liver and visceral adipose tissue of juvenile yellow catfish性受到抑制的状况起到缓释作用, 并可能降低醛酮类物质的积累。
3.3 肝脏脂代谢酶类活性
鱼类应对铜毒性的生理解毒过程会消耗大量的代谢能, 机体往往会通过激活一些重要酶类来参与能量的调节。其中, 肝脏脂蛋白脂肪酶被认为是脂代谢过程中关键的限速酶, 能够催化三酰甘油分解为脂肪酸和单酸甘油酯, 以供组织分解氧化供能[29]。本研究发现, 高铜组实验鱼肝脏中脂蛋白脂肪酶的活性显著高于低铜饲料组, 表明高铜摄入加速了大黄鱼对能量的需求。前人的研究发现, 鱼类能够通过自身的生理适应性调节维持机体的脂稳态, 当机体提出能量需求时, 合成代谢途径将受到抑制[30]。在本研究中, 高铜组实验鱼肝脏中参与NADPH或脂肪生成的酶类, 如6-磷酸葡糖酸脱氢酶、苹果酸酶、异柠檬酸脱氢酶和脂肪酸合成酶的活性受到代谢耗能的影响显著降低(高铜组<低铜组)。然而, 通过提高高铜饲料中的钙水平,+Cu+Ca组实验鱼肝脏中6-磷酸葡糖酸脱氢酶、异柠檬酸脱氢酶和脂肪酸合成酶的活性显著高于+Cu-Ca组, 而脂蛋白脂肪酶活性却显著低于+Cu-Ca组, 提示高铜饲料中添加适宜的钙, 能够缓解机体在解毒过程中对能量的过度需求。
综上, 饲料中铜水平过高, 会降低大黄鱼幼鱼的存活率; 摄入过量的铜会抑制大黄鱼幼鱼肝脏中抗氧化酶类及脂肪合成酶类的活性, 机体通过激活脂肪分解酶类进行供能; 通过提高高铜饲料中的钙水平, 能够增强大黄鱼幼鱼的抗氧化能力, 降低醛酮类物质的积累, 减少代谢耗能。然而, 要彻底弄清钙对鱼类铜中毒的毒性缓释机制, 尚需开展进一步具体而深入的研究。Pelteobagrus fulvidraco exposed to copper [J]. Aquatic Toxicology, 2013, 136—137: 72—78
[6]Yao L X, Huang L X, Jiang Z Y, et al. Investigation of As, Cu and Zn species and concentrations in animal feeds[J]. Environment Science, 2013, 34(2): 722—739 [姚丽贤, 黄连喜, 蒋宗勇, 等. 动物饲料中砷、铜和锌调查及分析. 环境科学, 2013, 34(2): 722—739]
[7]Zhao Y J, Jiang M, Gao P, et al. Effects of elevated dietary copper levels on growth performance and copper,iron, zinc concentrations in muscle and hepatopancreas of grass carp Ctenopharyngodon idella [J]. Journal of Yunnan Agricultural University, 2008, 23(6): 798—825 [赵宇江, 蒋明, 高攀, 等. 饲料中高水平铜对草鱼生长、肝胰脏和肌肉中铜铁锌含量的影响. 云南农业大学学报,2008, 23(6): 798—825]
[8]Lall S P. Nutrition and health of fish [A]. In: Cruz-Suárez L, Ricque-Marie D, Tapia-Salazar M (Eds.), Advances en Nutrición Acuicola V [C]. Mexico: Memorias del V Simposium Internacional de Nutrición Acuícola. 2000,13—23
[9]Wurts W A, Perschbacher P W. Effects of bicarbonate alkalinity and calcium on the acute toxicity of copper to juvenile channel catfish (Ictalurus punctatus) [J]. Aquaculture, 1994, 125: 73—79
[10]Chen Q L, Luo Z, Zheng J L, et al. Protective effects of calcium on copper toxicity in Pelteobagrus fulvidraco: copper accumulation, enzymatic activities, histology [J]. Ecotoxicology and Environment Safety, 2012, 76(2): 126—134
[11]Liu Z Y, Xie Y Q, Lin X J. Histopathological observation of pathological changes in the liver of Pseudosciaena crocea [J]. Marine Fisheries Research, 2007, 28(5): 7—11 [刘振勇, 谢友佺, 林小金. 大黄鱼肝脏病变组织病理学观察. 海洋水产研究, 2007, 28(5): 7—11]
[12]Cao J J, Miao X, Xu W, et al. Dietary copper requirements of juvenile large yellow croaker Larimichthys croceus [J]. Aquaculture, 2014, 432: 346—350
[13]National Research Council (NRC). Nutrient Requirements of Fish and Shrimp [M]. Washington: National Academy Press. 2011, 378
[14]Association of Official Analytical Chemists (AOAC) [M]. Official Methods of Analysis, 17th ed, Association of Official Analytical Chemists, Arlington, VA. 2000, 1-12
[15]Wang W L, Cui X, Li C C, et al. Effect of dietary copper exposure on micronucleus of erythrocyte and accumulation in different tissues of juvenile GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicolog,2014, 9(4): 757—764 [王文龙, 崔欣, 李成成, 等. 饲料中铜暴露对吉富罗非鱼幼鱼血红细胞微核和组织中铜蓄积的影响. 生态毒理学报, 2014, 9(4): 757—764]
[16]McGeer J C, Szebedinszky C, McDonald D G, et al. Effects of chronic sublethal exposure to waterborne Cu, Cd or Zn in rainbow trout 1: ionoregulatory disturbance and metabolic costs [J]. Aquatic Toxicology, 2000, 50(3): 231—243
[17]Shiau S Y, Ning Y C. Estimating of dietary copper requirements for juvenile tilapia, Oreochromis niloticus×O. aureus [J]. Journal of Animal Science, 2003, 77(2): 287—292
[18]Lin Y, Shih C, Kent M, et al. Dietary copper requirement reevaluation for juvenile grouper, Epinephelus malabaricus, with an organic copper source [J]. Aquaculture,2010, 310(1—2): 173—177
[19]Tan X Y, Luo Z, Liu X, et al. Dietary copper requirement of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Aquaculture Nutrition, 2011, 17(2): 170—176
[20]Tang Q Q, Feng L, Jiang W D, et al. Effects of dietary copper on growth, digestive, and brush border enzyme activities and antioxidant defense of hepatopancreas and intestine for young grass carp (Ctenopharyngodon idella)[J]. Biological Trace Element Research, 2013, 155(3): 370—380
[21]Qian J, Wang Z, Liu G W. Advance of copper metabolism in animal body [J]. Progress in Veterinary Medicine,2003, 24(2): 55—57 [钱剑, 王哲, 刘国文. 铜在动物体内代谢的研究进展. 动物医学进展, 2003, 24(2): 55—57]
[22]Tekin-Ozan S, Kir I. Seasonal variations of heavy metals in some organs of carp (Cyprinus carpio L., 1758) from Beysehir Lake (Turkey) [J]. Environmental Monitoring and Assessment, 2008, 138(1—3): 201—206
[23]Arellano J M, Storch V, Sarasquete C. Histological changes and copper accumulation in liver and gills of the Senegalese sole, Solea senegalensis [J]. Ecotoxicology and Environment Safety, 1999, 44(1): 62—72
[24]Santore R C, DiToro D M, Paquin P R, et al. Biotic ligand model of the acute toxicity of metals. 2. Application to acute copper toxicity in freshwater fish and Daphnia[J]. Environmental Toxicology and Chemistry, 2001,20(10): 2397—2402
[25]Wang Y R, Li E C, Chen L Q, et al. Effect of acute salinity stress on soluble protein, hemocyanin, haemolymph glucose and hepatopancreas glycogen of Eriocheir sinensis [J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1056—1062 [王悦如, 李二超, 陈立侨, 等. 急性高渗胁迫对中华绒螯蟹雄蟹组织中可溶性蛋白质、血蓝蛋白、血糖与肝糖原含量的影响. 水生生物学报, 2012,36(6): 1056—1062]
[26]Savary S, Trompier D, Andréoletti P, et al. Fatty acids induced lipotoxicity and inflammation [J]. Current Drug Metabolism, 2012, 13(10): 1358—1370
[27]Yao Z F, Zhang L Z, Zhuang P, et al. Effects of antioxidant enzyme in liver and acute toxicity of Cu2+on juvenile Chinese sturgeon [J]. Journal of Fishery Sciences of China, 2010, 17(4): 731—738 [姚志峰, 章龙珍, 庄平,等. 铜对中华鲟幼鱼的急性毒性及对肝脏抗氧化酶活性的影响. 中国水产科学, 2010, 17(4) :731—738]
[28]Nie Z J, Xu G C, Zhang S L, et al. Acute effects of copper on survival of fingerlings, antioxidant enzyme activities in liver and structure of gill and liver of Coilia nasus[J]. Journal of Fishery Sciences of China, 2014, 21(1): 161—16 [聂志娟, 徐钢春, 张守领, 等. 铜对刀鲚幼鱼的急性毒性及对肝抗氧化酶活性与组织结构的影响. 中国水产科学, 2014, 21(1): 161—168]
[29]Saera-Vila A, Calduch-Giner J A, Gomez-Requeni P, et al. Molecular characterization of gilthead sea bream(Sparus aurata) lipoprotein lipase. Transcriptional regulation by season and nutritional condition in skeletal muscle and fat storage tissues [J]. Comparative Biochemistry and Physiology B, 2005, 142(2): 224—232
[30]Nanton D A, Vegusdal A, Rørå A M B, et al. Muscle lipid storage pattern, composition, and adipocyte distribution in different parts of Atlantic salmon (Salmo salar)fed fish oil and vegetable oil [J]. Aquaculture, 2007,265(1—4): 230—243
EFFECTS OF DIETARY COPPER AND CALCIUM LEVELS ON GROWTH,ANTIOXIDANT ENZYME AND LIPID METABOLISM ENZYME ACTIVITIES OF JUVENILE LARGER YELLOW CROAKER LARIMICHTHYS CROCEA
LAI Hang, LI Ming, TAO Zhen, XIE Feng-Jun, LI Qing, GONG Shi-Yan and WANG Ri-Xin
(School of Marine Science, Ningbo University, Ningbo 315211, China)
To evaluate effects of dietary copper and calcium on juvenile larger yellow croaker Larimichthys crocea,four experimental diets (-Cu-Ca, +Cu-Ca, -Cu+Ca and +Cu+Ca) were formulated containing two different levels of copper (4 and 24 mg/kg) and of cadmium (0.5% and 3%) to feed juvenile large yellow croaker (4.05±0.31) g in triplicate for 10 weeks. The results indicated that the addition of Cu decreased fish survival rate, final body weight and weight gain (P<0.05). As expected, the Cu diets enhanced liver and muscle Cu concentrations, Interestingly, the Ca diets diminished muscle Cu concentration (P<0.05). The supplement of Cu decreased liver glycogen concentration, liver superoxide dismutase, catalase, glutathione peroxidase, 6-phosphogluconate dehydrogenase, isocitrate dehydrogenase, and fatty acid synthase activities, but it it enhanced thiobarbituric acid reactive substance content and lipoprotein lipase activity (P<0.05). The interaction between Cu and Ca on muscle Cu concentration, thiobarbituric acid reactive substance content, 6-phosphogluconate dehydrogenase, fatty acid synthase and lipoprotein lipase activities was identified (P<0.05). This study indicated that calcium supplement mitigated injuries in fish by high copper intake.
Larger yellow croaker; Copper; Calcium; Antioxidant enzyme; Lipid metabolism enzyme
10.7541/2016.31
S965.3
A
1000-3207(2016)02-0217-08
2015-04-23;
2015-09-14
宁波大学“水产”浙江省重中之重开放基金(xkzsc1401, xkzsc1403); 国家自然科学基金(31272661)资助 [Supported by the Open Fund of Zhejiang Provincial Top Key Discipline of Aquaculture in Ningbo University (xkzsc1401, xkzsc1403); the National Natural Science Foundation of China (31272661)]
来杭(1996—), 男, 浙江萧山人; 本科; 宁波大学海洋人才创新班。E-mail: 1141488669@qq.com
黎明, E-mail: liming1@nbu.edu.cn
