滇池沉积物中厌氧氨氧化细菌分布的时空差异
2016-11-24陈泽斌夏体渊王定康徐胜光何峰任
陈泽斌夏体渊王定康徐胜光何 峰任 禛
(1. 昆明学院农学院, 昆明 650214; 2. 云南省都市特色农业工程技术研究中心, 昆明 650214; 3. 昆明学院生命科学与技术系, 昆明 650214; 4. 昆明市滇池生态研究所, 昆明 650228)
研究简报
滇池沉积物中厌氧氨氧化细菌分布的时空差异
陈泽斌1,2夏体渊1王定康3徐胜光1何 峰4任 禛1
(1. 昆明学院农学院, 昆明 650214; 2. 云南省都市特色农业工程技术研究中心, 昆明 650214; 3. 昆明学院生命科学与技术系, 昆明 650214; 4. 昆明市滇池生态研究所, 昆明 650228)
厌氧氨氧化作用(Anaerobic Ammonia Oxidation,Anammox)是细菌在厌氧条件下, 以NO2-为电子受体, 以铵离子为电子供体的氧化还原反应[1]。厌氧氨氧化细菌的生长极为缓慢, 只能在高菌体浓度时才显示其氨氧化活性, 且对氧的存在十分敏感, 所以传统的微生物纯化、分离和培养的方法并不适用于厌氧氨氧化细菌。由于微生物可培养技术的局限性, 因此实时荧光定量PCR技术成为定量描述难培养微生物分布和丰度的有力手段[2]。宋亚娜等[3]利用荧光定量PCR方法对土壤中厌氧氨氧化细菌进行了检测, 但对于高原湖泊底泥中厌氧氨氧化细菌的时空分布, 尚未有相关文献报道。目前对厌氧氨氧化细菌的研究只能通过其16S rDNA进行, Strous等[4]首先研究了一株厌氧氨氧化细菌的16S rDNA序列, 表明厌氧氨氧化细菌是一群分支很深的浮霉状菌, 并将其命名为Candidatus Brocadiaan ammoxidans。目前厌氧氨氧化细菌共分为5个属, 8个种[5]。Schmidt 等[6]证实好氧与厌氧氨氧化细菌可以共处于兼性环境中。
底泥是支流带入湖泊的沉积物的汇集, 由于表层水的存在, 加之底泥中含水量较高, 因而具备适合两种氨氧化细菌共存的兼性环境。Thamdrup等[7]和Dalsgaard等[8]的研究均表明在水环境底泥中, 厌氧氨氧化作用是氮素损失的主要因素。滇池是云南著名的高原淡水湖泊, 应用分子生物学手段对滇池底泥中的厌氧氨氧化细菌的时空分布进行研究, 有助于为高原淡水湖泊中氮素循环的研究提供依据。
1 研究区域概况
滇池位于昆明市西南(24°40′N-25°02′N, 102°02′E-102°47′E), 面积306.3 km2, 平均水深5.12 m, 最大水深11.3 m, 平均库容量为1.57×109m3, 属于浅水湖泊。湖面平均海拔为1886 m, 属于典型的高原淡水湖泊。湖体略为弓形, 南北走向, 靠近北部的海埂将滇池分为南北两部分, 分别称为草海与外海, 其中外海是滇池的主体, 由20余条支流携带泥沙、富营养物和污染物汇入。滇池东部与北部与人口密集的生活区相邻, 有大量生活污水排入, 为污染较为严重的区域; 西邻山脉, 位于西南部的海口镇螳螂川是滇池唯一天然出水口。昆明市春夏季白昼较长, 日照强烈, 一日内温差较大, 适合水生植物与微生物的繁殖代谢; 秋冬季白昼变短, 日照充足, 气温偏低, 水生植物与微生物的代谢减缓。
2 材料与方法
2.1 采样点设置与样品处理
根据滇池的地形, 分别在北部草海、草海与外海交界处、东部生活区、西部沿山地区以及西南部出水口等地设置8个采样点, 分别于春夏之交的5月和秋冬之交的11月, 在每个采样点首先记录该位置水温, 并使用抓斗和管式采集器分别采集浅层底泥(0—10 cm)与深层底泥(40—50 cm)样品各两份, 每个采样点利用GPS定位系统记录经纬度。采样点位置与GPS坐标见表 1。采集的底泥样品迅速用密封袋密封, 装入低温保存箱中带回实验室。一份用于测定样品间隙水的溶氧量(DO)、有机碳(OC)、氨氮总量(NH4+-N)、总磷以及pH等, 另一份等分为3份重复, 置于-80℃冰箱中, 用于对厌氧氨氧化细菌数量的分析。
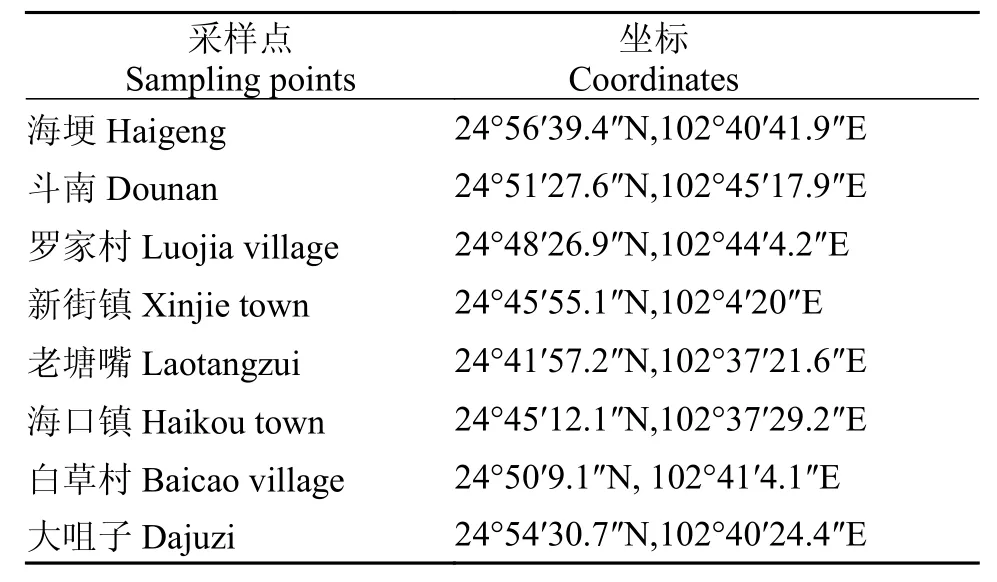
表 1 采样点GPS坐标Tab. 1 GPS coordinates of sample points
2.2 样品理化性质测定
碘量法[9]测定样品间隙水中的含氧量(DO), 重铬酸钾氧化-硫酸亚铁滴定法[10]测定样品中OC含量, 靛酚蓝分光光度法[11]测定样品中NH4+-N含量, 过硫酸钾氧化法[12]测定样品中总磷含量, 并使用电子pH计测定pH。结合细菌数量测定结果, 采用SPSS 19.0软件对细菌数量与样品中各环境因子含量相关性进行分析。
2.3 实时荧光定量PCR标准曲线制作及样品测定
用试剂盒提取底泥样品细菌总DNA, 采用厌氧氨氧化细菌特异性的16S rDNA引物[13]进行扩增, 引物序列为: 上游引物Anammox (Pla46): 5′-GGATTAGGCAT GCAAGTC-3′, 下游引物Anammox2: 5′-TCTGTATTAC CGCGGCT-3′。反应体系为: 上下游引物各0.5 μL,10×buffer 2.5 μL, ExTaq 0.5 μL (5 U/μL), 总DNA 0.5 μL,2.5 mmol/L dNTPs 2 μL, 用去离子水补至体积25 μL。PCR扩增条件为: 95℃预变性5min; 94℃变性45s, 50℃退火60s, 72℃延伸50s, 30次循环; 72℃延伸15min。将各采样点样品中扩增出的产物连接到载体质粒上并转化入大肠杆菌DH-5α感受态细胞中, 筛选阳性克隆, 对插入片段测序, 并提取质粒, 测定质粒DNA浓度, 计算质粒的拷贝数约为3.28×109cell/μL。从3.28×102—3.28×109cell/μL以每10倍作为梯度稀释, 制作用于荧光定量PCR检测的标准曲线。
对由上述构建标准曲线的重组质粒和底泥样品中的样本DNA进行荧光定量PCR检测。每个样本重复3次。反应体系为: FastStart Universal SYBR Green Master(ROX) 25 μL, 上下游引物各0.5 μL, 稀释10倍的DNA模板5 μL, 去离子水19 μL, 共50 μL。反应于Applied Biosystems 7500 Real-Time PCR System(Life Technologies)上进行。反应条件为: 95℃预变性5min; 95℃变性45s, 60℃退火1min, 72℃延伸1min, 40次循环。根据循环数及标准曲线, 测定样品中厌氧氨氧化细菌的数量。
2.4 数据分析
使用SPSS 19.0与Excel 2010软件进行。
3 结果
3.1 样品理化性质
相比浅层底泥的理化性质, 深层底泥中DO、OC和总磷均较低, NH4+-N和pH则较高; 靠近居民区的C、E、F等采样点的DO、NH4+-N和总磷比其他点均较高(表2)。
3.2 厌氧氨氧化细菌16S rDNA的PCR扩增与克隆
利用厌氧氨氧化细菌16S rRNA基因引物对其进行PCR, 产物经琼脂糖凝胶电泳后显示(图 1), 每个样品中均得到目的条带, 大小约500 bp, 且均为单一条带。回收PCR产物, 重组至pMD18-T载体上, 提取质粒后对该片段进行扩增、测序, 结果表明扩增的条带大小均为502—510 bp, 与厌氧氨氧化细菌16S rDNA序列相当。经Blast比对, 表明所扩增的样品均与已公布的厌氧氨氧化细菌同属浮霉菌类 Planctomyces。以上结果表明该重组质粒可以用作厌氧氨氧化细菌的荧光定量PCR检测。
3.3 厌氧氨氧化细菌的荧光定量PCR检测
采用SYBR染料法荧光定量PCR对滇池底泥样品中的厌氧氨氧化细菌数量进行检测。图 2显示了根据重组质粒DNA所构建的标准曲线, 其回归方程为y = -3.32x + 39.74, R2=0.997, 其中y为Ct值, x为log C0。
3.4 厌氧氨氧化细菌数量时间分布
图 3显示的是根据样品的荧光定量PCR结果, 绘制了每个采样点在不同采样时间下的厌氧氨氧化细菌平均数量对比结果。根据实验结果, 厌氧氨氧化细菌在5月的数量介于 (2.83—8.64)×107(个/g样品), 而11月的样品中细菌数量为 (1.30—4.50)×107(个/g样品)。通过统计分析,P<0.01, 同一深度不同时期的厌氧氨氧化细菌数量具有极显著性差异; 以不同采样点进行分析, P>0.05, 不同采样点的细菌数量不具有显著性差异。
3.5 厌氧氨氧化细菌数量空间分布
图 4显示了厌氧氨氧化细菌平均数量空间分布的对比结果。浅层底泥中的厌氧氨氧化数量为(2.95—6.50)× 107(个/g样品), 而深层底泥细菌数量为6.51×107—2.34× 108(个/g样品)。深层底泥中的厌氧氨氧化细菌数量明显高于浅层底泥。通过统计分析, P<0.01, 同一时期不同深度的厌氧氨氧化细菌数量具有极显著性差异; 以不同采样点进行分析, P>0.05, 不同采样点的细菌数量不具有显著性差异。
3.6 厌氧氨氧化细菌数量时空分布差异
将每个采样时间与深度的样品结合对比, 图 5显示了底泥中厌氧氨氧化细菌数量的时空分布。在每个采样点, 11月所采的浅层样品中厌氧氨氧化细菌数量相对最少, 可能的原因是此时水温及底泥温度较低, 同时由于接近上层水, 该区域氧含量较高, 因此该空间内的厌氧氨氧化细菌数量最少; 反之, 5月份的深层样品中厌氧氨氧化细菌数量最多。通过统计分析, 不同时期不同深度的厌氧氨氧化细菌数量具有极显著性差异(P<0.01); 以不同采样点进行分析, 不同采样点的细菌数量不具有显著性差异(P>0.05)。
3.7 厌氧氨氧化细菌数量与环境因子相关性分析
使用SPSS软件对厌氧氨氧化细菌数量与底泥样品中环境因子的相关性进行分析。表 3-6分别是不同时空中的典型性相关分析矩阵。典型性相关分析矩阵表明, 在不同时空的底泥中, 厌氧氨氧化细菌的数量与水温、DO和NH4+-N含量均具有相关性。在浅层底泥中厌氧氨氧化细菌的数量与DO的相关性大于深层底泥, 而深层底泥中其与NH4+-N含量的相关性大于浅层底泥, 说明在浅层底泥中, 制约厌氧氨氧化细菌生长的主要因素是DO, 而在深层底泥中, 该因素主要是NH4+-N含量。

图 1 厌氧氨氧化细菌16S rRNA基因PCR结果Fig. 1 16S rRNA gene PCR results of Anammox bacteria.
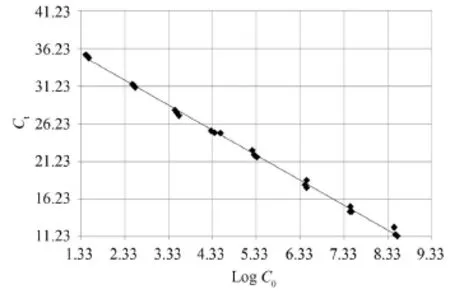
图 2 重组质粒实时荧光定量PCR标准曲线Fig. 2 Real-time fluorescen quantitative PCR standard curve of recombinant plasmids
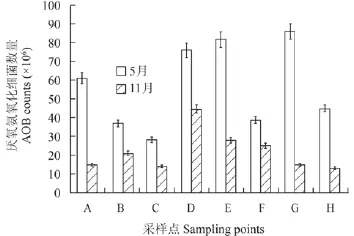
图 3 厌氧氨氧化细菌数量的时间分布Fig. 3 Time distribution of numbers of Anammox bacteria
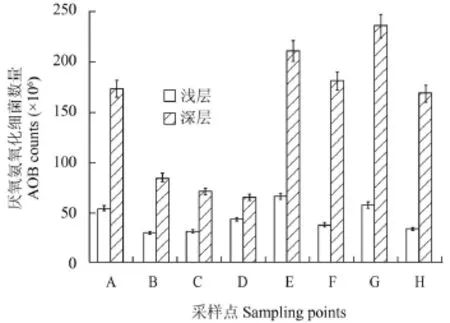
图 4 厌氧氨氧化细菌数量的空间分布Fig. 4 Spatial distribution of number of Anammox bacteria
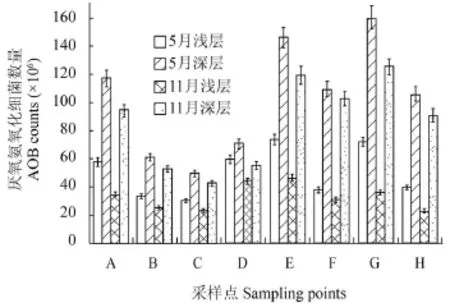
图 5 厌氧氨氧化细菌数量的时空分布Fig. 5 Spatial and temporal distribution of number of Anammox bacteria
4 讨论
通过对不同时间与深度的滇池底泥样品的分析, 滇池中厌氧氨氧化细菌数量可达1.30×107—2.34×108(个/ g样品), 比土壤中厌氧氨氧化细菌数量略少[3]。从时间上比较, 春夏季底泥中厌氧氨氧化细菌数量高于秋冬季, 而从空间上比较, 则深层底泥多于浅层底泥。从时空上比较, 春夏季深层底泥中细菌数量最多, 而秋冬季浅层底泥则最少。同时研究中发现, 靠近人类生活区以及进出水口等水流影响较大的位置, 其数量相对较少。
从时间上来看, 由于5月份日照时间长, 水温及底泥温度都相对较高, 水中动植物以及微生物的代谢强度大,氨氮水平较11月高, 有益于厌氧氨氧化细菌的繁殖。总体比较而言, 处于春夏交接的5月份, 厌氧氨氧化细菌数量明显多于秋冬之交的11月。
从垂直空间分析, 浅层底泥中的氧含量要明显高于深层, 厌氧氨氧化细菌对氧的存在十分敏感, 上层水与底泥的交界处存在大量水生植物, 导致浅层底泥中氧含量较高, 为好氧细菌主要分布的区域。而深层底泥中氧含量大幅减少, 同时由于少量好氧细菌与兼性细菌的存在,使得微环境中的氧分子进一步减少, 为厌氧氨氧化细菌的生存提供了条件。总体比较而言, 深层底泥的厌氧氨氧化细菌数量高于浅层底泥。
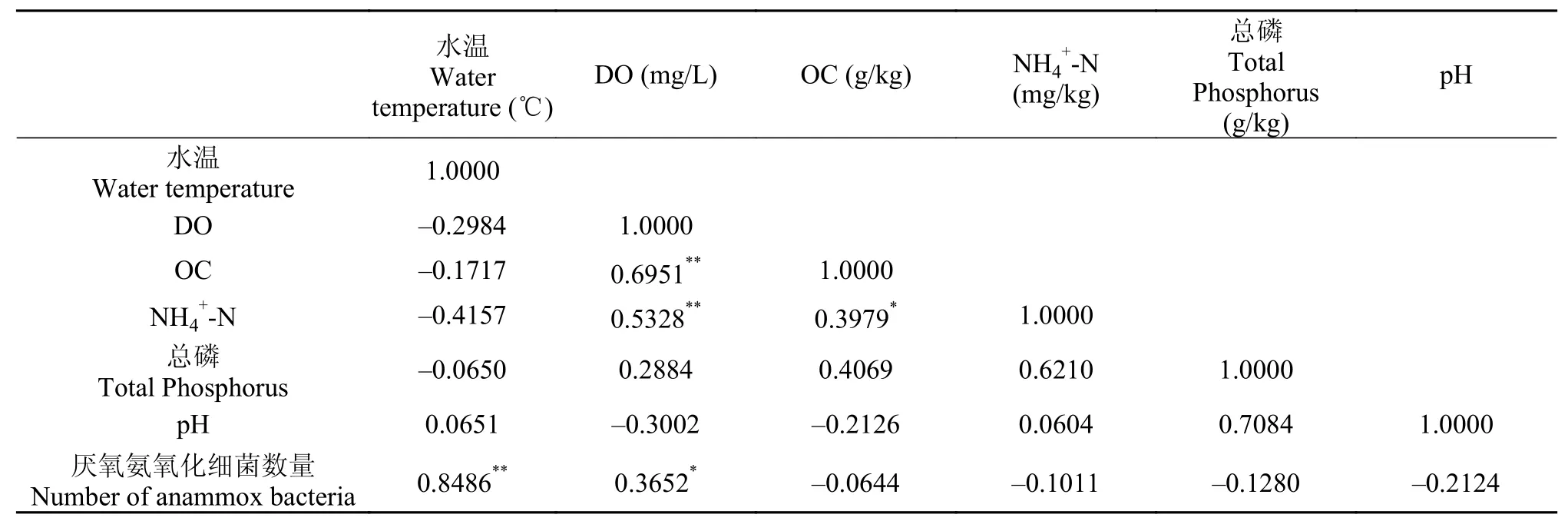
表 3 5月浅层底泥典型性相关分析矩阵Tab. 3 Typical correlation matrix of shallow sediments sample in May
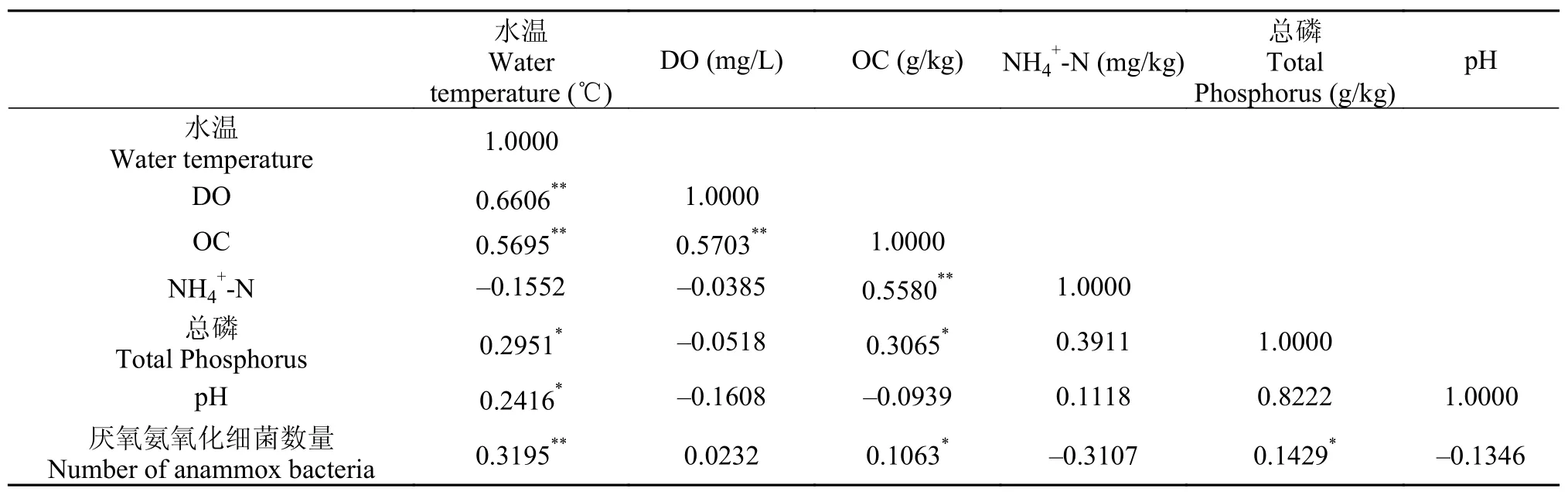
表 4 5月深层底泥典型性相关分析矩阵Tab. 4 Typical correlation matrix of deep sediments sample in May
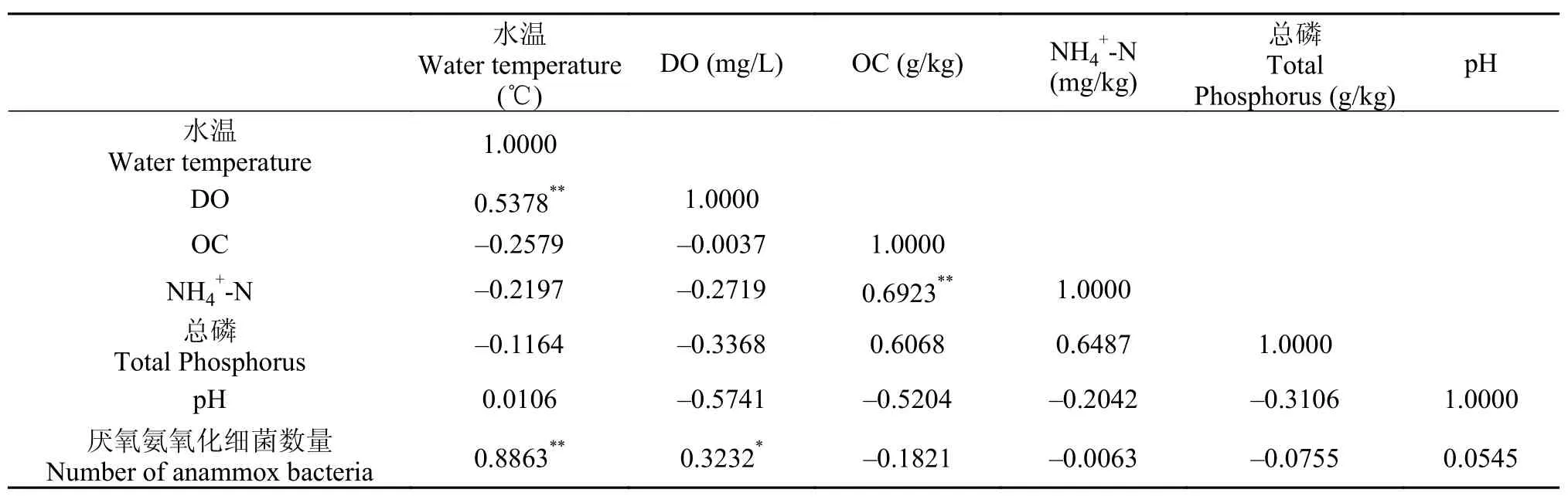
表 5 11月浅层底泥典型性相关分析矩阵Tab. 5 Typical correlation matrix of shallow sediments sample in November
从水平空间分析, 厌氧氨氧化细菌数量在不同采样点之间没有显著性差异, 可能的原因是同一深度的底泥成分差异不明显, 对其数量的影响不如时间与深度的影响显著。
通过对厌氧氨氧化细菌数量与环境因子的相关性分析, 结果显示其与水温、DO和NH4+-N含量均具有相关性, 在浅层底泥中, 制约厌氧氨氧化细菌生长的主要因素是DO, 而深层底泥中, 该因素主要是NH4+-N含量。
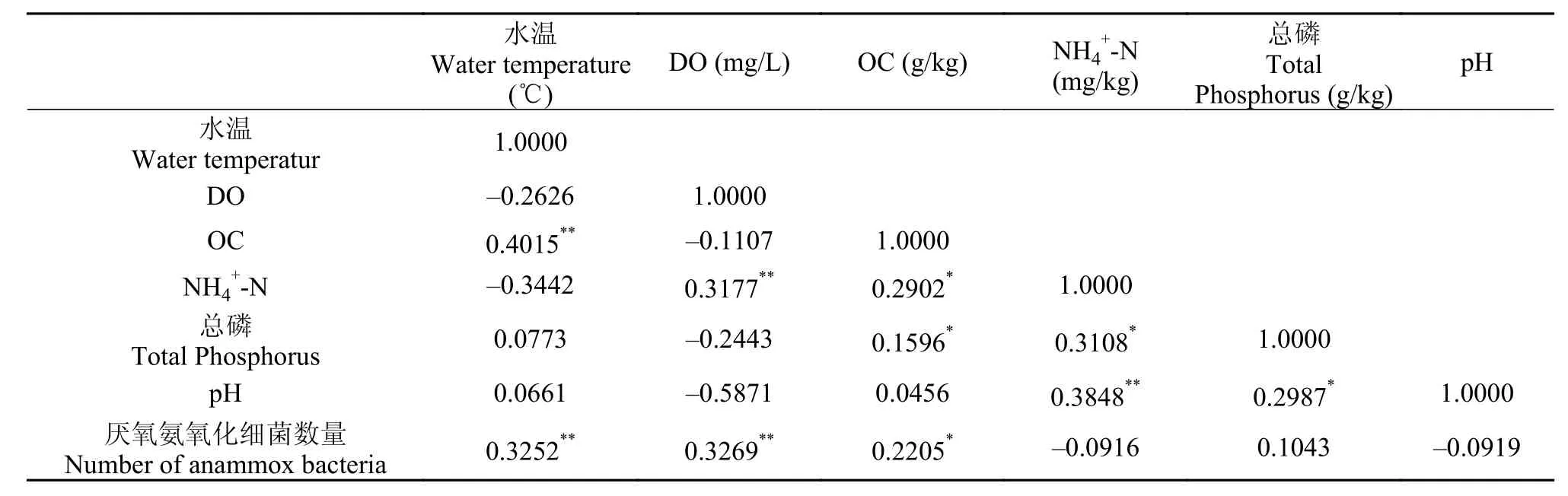
表 6 11月深层底泥典型性相关分析矩阵Tab. 6 Typical correlation matrix of deep sediments sample in November
水环境中的氮循环, 很大一部分来自于厌氧氨氧化细菌的作用。由于国内对高原淡水湖泊底泥中厌氧氨氧化细菌的研究较少, 因此对高原淡水湖泊的典型代表滇池沉积物的厌氧氨氧化细菌数量与时空分布的研究具有代表性的意义, 为将来对高原淡水湖泊的氮循环研究提供了一条新的思路。
[ 1 ]Ettenmsm J, Strous M, Van De Pas - Schoonenk T, et al. The anaerobic oxidation of ammonium [J]. FEMS Microbiology Reviews, 1998, 22(5): 421—437
[ 2 ]Zhang J, Zhang H W, Zhang C G. Real-time fluorescent quantitative PCR and its application in microbialecology[J]. Acta Ecologica Sinica, 2005, 25(6): 1445—1450 [张晶, 张惠文, 张成刚. 实时荧光定量PCR及其在微生物生态学中的应用. 生态学报, 2005, 25(6): 1445—1450]
[ 3 ]Song Y N, Lin Z M, Chen Z J, et al. Real-time PCR quantification of anaerobic ammonia-oxidizing micoorganisms in red paddy soil [J]. Fujian Journal of Agricultural Sciences, 2010, 25(1): 85—85 [宋亚娜, 林智敏, 陈在杰, 等. 荧光定量PCR技术检测红壤稻田土壤厌氧氨氧化细菌. 福建农业学报, 2010, 25(1): 82—85]
[ 4 ]Strous M, Fuerst J A, Kramer E H M, et al. Missing litotroph identified as new planctomycete [J]. Nature, 1999,400: 446—449
[ 5 ]Shen L D, Zheng P, Hu B L, et al. Anaerobic ammonium oxidation in natural ecosystem [J]. Acta Ecologica Sinica,2011, 31(15): 4447—4454 [沈李东, 郑平, 胡宝兰. 自然生态系统中的厌氧氨氧化. 生态学报, 2011, 31(15): 4447—4454]
[ 6 ]Schmidt I, Sliekers O, Schmid M, et al. New concepts of microbial treatment processes for the nitrogen removal in wastewater [J]. FEMS Microbiology Reviews, 2003,27(4): 481—492
[ 7 ]Thamdrup B, Dalsgaard T. Production of N2through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments [J]. Applied and Environmental Microbiology, 2002, 68(3): 1312—1318
[ 8 ]Dalsgaard T, Canfield D E, Petersen J, et al. N2production by the anammox reaction in the anoxic water column of Golfo Dulce, Costa Rica [J]. Nature, 2003, 422(6932): 606—608
[ 9 ]Wang C H. Determination of dissolved oxygen with iodometric method [J]. Liaoning Chemical Industry, 2012,41(1): 107—108 [王璀虹. 碘量法测定溶解氧. 辽宁化工, 2012, 41(1): 107—108]
[10]Liu C L, Zhu Z G, He X L, et al. Rapid determination of organic carbon in marine sediment samples by potassium dichromate oxidation-ferrous sulphate titrimetry [J]. Rock and Mineral Analysis, 2007, 26(3): 205—208 [刘昌岭,朱志刚, 贺行良, 等. 重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中有机碳. 岩矿测试, 2007, 26(3): 205—208]
[11]Wei H F, Liu C F, Zhang J X. Improvement of NH4+-N determination in water by indophenol blue [J]. Research and Exploration in Laboratory, 2013, 32(7): 17—19 [魏海峰, 刘长发, 张俊新. 靛酚蓝法测定水中氨氮方法的改进. 实验室研究与探索, 2013, 32(7): 17—19]
[12]Zhao Y Y, Pan S Y, Chen Y, et al. Rapid determination method of total phosphorus in water [J]. Fujian Analysis & Testing, 2008, 7(4): 64—66 [赵洋甬, 潘双叶, 陈元,等. 水中总磷快速测定法研究. 福建分析测试, 2008,7(4): 64—66]
[13]Ren H Y, Zhang D J, Cong L Y, et al. Identification of an unknown ANAMMOX bacterium by molecular biology[J]. Chinese Journal of Environmental Engineering, 2008,2(3): 314—318 [任宏洋, 张代钧, 丛丽影, 等. 一种未见报道的厌氧氨氧化菌分子生物学鉴定. 环境工程学报,2008, 2(3): 314—318]
SPATIAL AND TEMPORAL DIFFERENCES OF ANAMMOX BACTERIAL DISTRIBUTION IN DIANCHI LAKE SEDIMENTS
CHEN Ze-Bin1,2, XIA Ti-Yuan1, WANG Ding-Kang3, XU Sheng-Guang1, HE Feng4and REN Zhen1
(1. Agriculture College, Kunming University, Kunming 650214, China; 2. Engineering Research Center for Characteristics Agriculture of Yunnan Province, Kunming 650214, China; 3. Life Science and Technology Department, Kunming University, Kunming 650214, China;4. Kunming Institute of Ecology of Dianchi Lake, Kunming 650228, China)
厌氧氨氧化细菌; 滇池沉积物; 实时荧光定量PCR; 季节变化; 空间分布
Anaerobic ammonia-oxidizing bacteria; Sediments of Dianchi Lake; Real-time fluorescent quantitative PCR; Seasonal changes; Spatial distribution
10.7541/2016.57
Q938.1
A
1000-3207(2016)02-0425-06
2015-03-18;
2015-07-28
云南省应用基础研究项目(2013FD040); 昆明学院科学研究项目(XJL13018); 国家自然科学基金项目(41361056); 云南省高校优势特色重点学科(生态学)建设项目资助; 昆明学院人才引进项目(YJL14005) [Supported by Applied Basci Research Projects of Yunnan (2013FD040); Science Research Project of Kunming University (XJL13018); National Natural Science Foundation of China(41361056); Key Disciplines (Ecology) Project of Yunnan Education Department; Talent-Recruiting Program of Kunming University (YJL14005)]
陈泽斌(1985—), 男, 云南昆明人; 博士, 副教授; 主要从事微生物生态学方面的研究。 E-mail: zbchenkmu@163.com
夏体渊(1978—), E-mail: xiatiyuan@sohu.com
