超声造影在前列腺常规声像图阴性患者中的临床意义
2016-11-21夏建国李凤华文小丹蒋姝菲
夏建国 李凤华 柳 怿 文小丹 蒋姝菲
上海交通大学医学院附属仁济医院南院超声医学科(上海 201112)
超声造影在前列腺常规声像图阴性患者中的临床意义
夏建国 李凤华 柳 怿 文小丹 蒋姝菲
上海交通大学医学院附属仁济医院南院超声医学科(上海 201112)
目的 探讨超声造影(CEUS)在前列腺血清特异抗原(PSA)升高而常规超声检查未见可疑病灶的患者穿刺活检中的应用价值和局限性。方法 对56例因PSA升高而常规超声未见可疑病灶的患者在穿刺前行经直肠前列腺CEUS检查,统计和分析穿刺点活检结果和造影剂异常分布区(CAD)之间的关系。结果 56例患者中11例(共35个穿刺点)病理诊断为前列腺癌(PCa),其中7例患者部分阳性穿刺点落在CAD区域(共20个穿刺点阳性其中15个点位于CAD区域,另外5个点不在CAD区域);有4例患者共15个阳性穿刺点均不在CAD区域。56例患者,CAD区域共有99个穿刺活检点,其中15个点穿刺病理证实为PCa,CAD区域的敏感性42.86%(15/35),特异性84.00%(441/525),阳性预测值15.15%(15/99),阴性预测值95.66%(441/461)。在所有造影的病例中CAD区域检出PCa的阳性率是非CAD区域的3.9倍(15.15% vs 3.9%,P<0.05),两者差异有统计学意义。阳性穿刺点分布与CAD分布有相关性(r =0.661)。PCa与CAD的体积有明显的相关性,与良性组相比,PCa组有更大的CAD体积(1.01±0.13mL vs 0.37±0.14mL,P<0.05)。PCa与PSA呈正相关(r =0.961),与前列腺的体积呈负相关(r = -0.842)。结论 对于血清PSA升高但常规超声未发现明确的前列腺异常病灶的患者,超声造影检查有助于PCa可疑病灶的检出。但是,要完整的显示PCa的微血管特征需要更多次数的超声造影。
前列腺肿瘤; 活组织检查, 针吸; 超声造影
前列腺癌(prostate cancer,PCa)的发病率逐年上升,经直肠超声(transrectal ultrasound, TRUS)引导下前列腺穿刺活检是获得术前病理诊断的最常用方法。如何提高超声引导下穿刺活检的恶性肿瘤的检出率,同时又减少不必要的穿刺针数,一直是超声工作者努力的目标。近年来,超声造影(contrastenhanced ultrasound,CEUS)技术在我国的应用日益普及,也被用于靶向引导前列腺穿刺活检[1,2],但是如何解读前列腺的CEUS的图像,存在诸多争议及不规范之处[3]。与正常前列腺组织相比,PCa血供明显增多[4],超声造影技术能显示组织的微小血管,因而也显示了其在PCa病灶检出中的潜力[5]。目前前列腺癌的CEUS研究主要集中在灰阶超声、彩色多普勒超声或能量多普勒超声已经发现的可疑病变区,而PCa的特点是散在和多灶分布,早期往往是无明显结节形成的,常规超声检测对PCa的早期病灶检出率均较低,尤其PSA在4~10ng/mL时。因此,如何提高超声引导下在常规超声检测时没有发现异常病灶的病人中PCa活检检出率以减少不必要的穿刺针数,一直是超声工作者努力的目标。本研究回顾性分析PSA增高,常规超声检测未发现可疑病变而超声造影发现有造影剂异常分布(Contrast anomalous distribution,CAD)的患者前列腺活检结果,探讨超声造影在常规超声检测阴性患者中检出前列腺癌的临床价值和存在的问题。
资料与方法
一、研究对象
收集2014年1月到2015年9月PSA升高、经2位高年资医师常规超声检查均未发现前列腺有明显的PCa可疑病灶,然而超声造影时发现造影剂有异常分布区的患者(CAD组)共56例。血清PSA浓度在(4.45~50.98)ng/mL,平均(14.25±2.67)ng/mL。对照组35例,PSA浓度在(5.6~11.5)ng/mL,平均(7.25±1.67)ng/mL。在常规超声检查没有发现异常病灶的病人中,前列腺穿刺活检的主要依据是PSA升高。
二、仪器和方法
使用Esaote Mylab90和Philip IU22超声诊断仪,直肠探头频率3-9MHz和3-10MHz,机械指数0.06-0.07。超声造影剂为bracoo公司的SonoVue,每次用量为2.4mL,经肘静脉团注,同时启动超声造影成像,造影剂到达前列腺后开始连续扫查前列腺的横断面,实时图像存储,观察时间约90s,特别要注意的是前面30s,不漏掉快进快退的部位。
三、图像分析
造影剂注射间歇,采用盲法由2名具7年以上造影工作经验的医师判断有无CAD。如果2名医师的判定结果不一致,则另由1名高年资医师参与读图,3名医师各自阐明判断依据,最终达成一致的判断结果。CAD的判断标准为:(1)外腺高灌注区 (图1);(2)外腺不对称异常血管分布区,根据微血管成像(microvascular imaging,MVI)判断(图2)。穿刺结束后再测定CAD左右径及上下径以及前后径,并画出其在冠状面的解剖位置。常规超声测定前列腺的三个径线。体积计算公式V=D1×D2×D3×0.52mL。
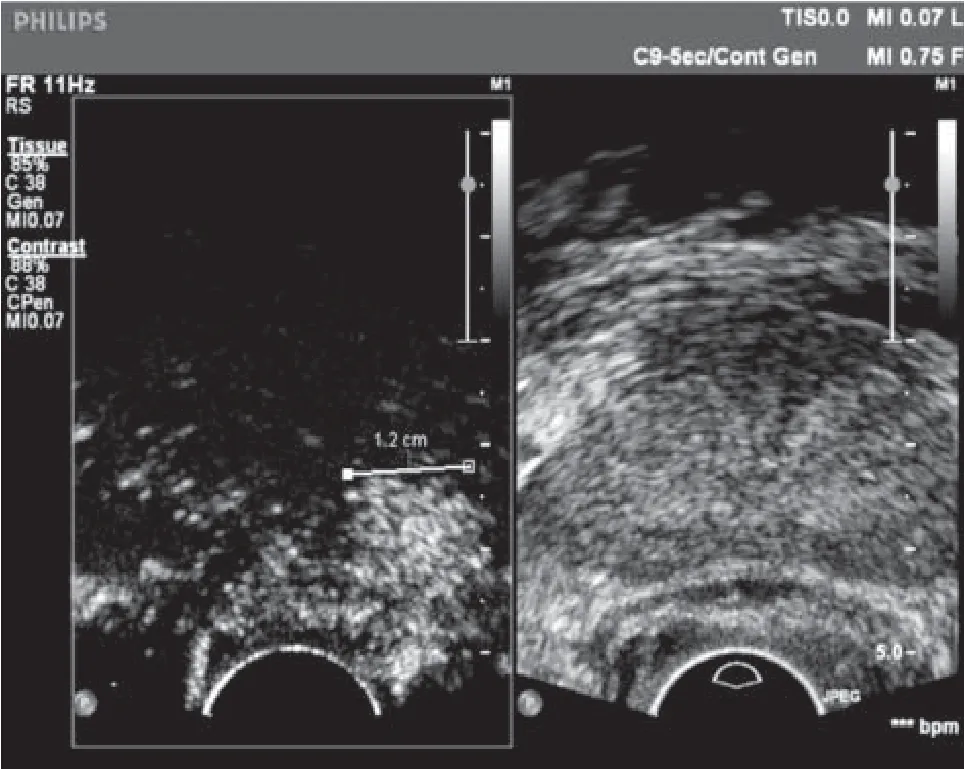
图1 前列腺左侧外周带可见造影剂增强区域

图 22 前列腺左侧外周带见微气泡异常走行区
四、前列腺穿刺活检
采用超声引导下经直肠穿刺活检(图3),OptiMed自动活检枪,配18G20cm穿刺活检针。穿刺点共10个,分别位于两侧底部2个,两侧中部2个及尖部各1个,如果那个点落在CAD区域,那么该点再补穿1~2针,该点的组织放在同一个福尔马林小瓶内,以增加可疑组织的数量,提高病理诊断的准确性,每个点的平均直径约0.5~0.8cm。对照组常规穿刺10针,穿刺点的分布与CAD组一致。将前列腺上皮内瘤、前列腺增生伴炎症细胞浸润、前列腺增生等非癌性结果统称为前列腺良性病变。

图3 CAD区域的穿刺活检
五、统计学分析
SPSS13.0统计软件,采用Spearman 相关分析,相关系数 r 绝对值在0.8以上为相关性良好。计量资料统计用均数±标准差表示。计量资料用 t 检验,计数资料用x2检验,P<0.05为有明显的统计学差异。
结 果
一、56例560个活检点的穿刺结果
56例患者中11例(共35个穿刺点)病理诊断为PCa,其中7例患者部分阳性穿刺点落在CAD区域(共20个穿刺点阳性,其中15个点位于CAD区域,另外5个点不在CAD区域);有4例患者共15个阳性穿刺点均不在CAD区域。56例患者中,CAD区域共穿刺了99个点,其中15点穿刺病理证实为PCa(真阳性),有84个点穿刺为阴性(假阳性);不在CAD区域穿刺了461个点,其中有20个穿刺点是阳性(假阴性),441个穿刺点为阴性(真阴性),CAD区域的敏感性42.86%(15/35),特异性84.00%(441/525),阳性预测值15.15%(15/99),阴性预测值95.66%(441/461)。56例穿刺活检点和CAD之间的关系见表1。

表1 56例穿刺活检点和CAD之间的关系
二、对照组与CAD组,以及CAD区域与非CAD区域活检阳性率的比较
对照组35例(超声造影未见CAD,同时二维灰阶超声及彩色多普勒超声都未见异常病灶),有4例为PCa,活检的阳性率11.43%(4/35)。CAD组活检的阳性率19.64%(11/56)是对照组的1.7倍(P<0.05),差异有统计学意义。35例对照组共计有350个穿刺点,有12个穿刺点穿刺阳性,两组病例共910个穿刺点,超声造影发现CAD区域活检阳性率是非CAD区域的3.9倍,两者差异具统计学意义(P<0.05),见表2。

表2 CAD区域和非CAD区域活检的阳性率比较
三、造影剂高灌注区与不对称异常血管分布区的活检阳性率的比较
CAD包含外腺高灌注区和外腺不对称异常血管分布区,56例中有17例发现外腺高灌注区,39例发现外腺不对称异常血管。17例中有5个CAD区域11个点活检证实为前列腺癌,39例中有2个CAD区域4个点检出前列腺癌。造影剂增强区域活检的阳性率29.41%(5/17),微气泡异常走行区域活检的阳性率5.13%(2/39),差异有统计学意义(P<0.05)。
四、7例PCa患者的20个穿刺活检阳性点分布与CAD范围之间的关系
7例PCa20个穿刺活检阳性点的分布与CAD的分布有相关性(r=0.661)(图4),CAD的大小与PCa的发生有明显的关系,11例PCa组CAD的大小为(1.01±0.13)mL,45例非PCa组CAD的大小在(0.37±0.14)mL,两者相比差异具统计学意义(P<0.05)。
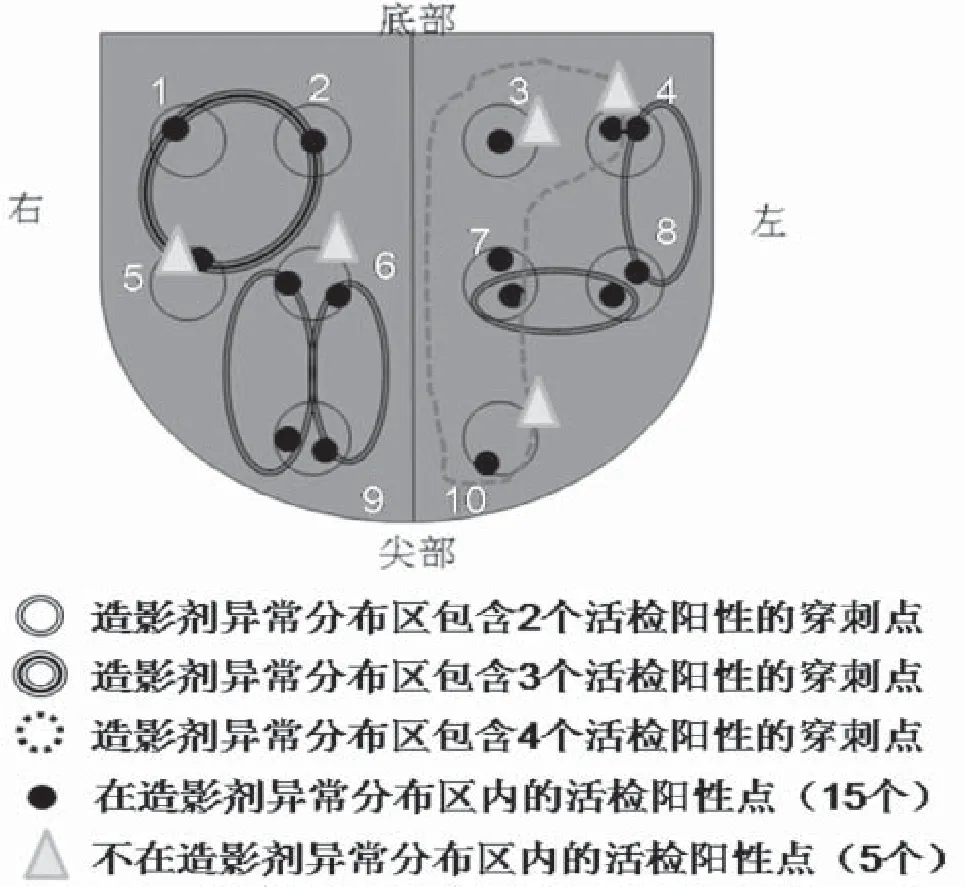
图4 7例CAD区及20个活检阳性穿刺点分布示意图
五、PCa与前列腺体积以及PSA之间的关系
本组11例PCa患者平均PSA(15.81±0.64)ng/ mL,45例良性组平均PSA(8.23±0.36)ng/mL,两者相比,差异具统计学意义(P<0.05)。PCa患者与非PCa患者的前列腺体积分别为(31.64±0.57)mL和(38.64±4.67)mL,差异有统计学意义(P<0.05)。PCa的发生率与PSA呈正相关(r = 0.961),与前列腺的体积呈负相关(r = -0.842)。
讨 论
一、前列腺癌的病理学特征及超声引导下穿刺活检的概况
由于前列腺癌尤其是早期前列腺癌的生长特点是病灶体积小且呈多灶性、分散性生长[6,7],因此,早期的PCa在常规超声图像上并不表现为一个明显的肿块或局限性病灶,在穿刺活检时常难以确定穿刺的“靶区”。国内唐杰等总结了550例经直肠超声引导下前列腺穿刺活检结果,在189例PCa中有39例常规超声图像上未发现病灶,占20.6%[8]。与此相反,汪娜等对59例前列腺外腺低回声结节穿刺活检,其中有22例为前列腺增生,占37.28%[9]。PCa并不表现为一个局灶性病变,而局灶性病变也并不一定是PCa。Slonim等提出了前列腺随机多点穿刺,即除可疑病灶部位穿刺之外,再在前列腺底、中、尖部分别穿刺,该作者报道19%似正常的前列腺声像图穿刺证实为PCa[10]。 可以肯定,常规超声检测前列腺未见明显异常病灶者,并不等于没有PCa,如果PSA超过正常范围,这样的病人还是要选择系统穿刺。超声造影是一项应用微泡造影剂增强前列腺肿瘤血管显像的新技术。作为血管血池性增强剂,造影剂微泡能较为客观地反映肿瘤微循环情况,继而提高PCa的检出率。最近有研究报道显示,在超声造影成像技术的引导下进行穿刺活检,可提高前列腺癌检出率并减少活检穿刺针数[11,12]。但是,在一项正在进行的前瞻性研究即关于超声弹性成像和超声造影联合诊断PCa的研究中,34例怀疑前列腺癌患者,对超声弹性成像和超声造影怀疑的区域进行靶向穿刺,再进行系统12针穿刺,结果发现,通过超声造影可减少穿刺针数达到与系统穿刺相当的穿刺准确率,但并不能提高PCa的检出率[13]。 另一项意大利的研究发现,在对样本量为300例志愿者进行研究时,超声造影的穿刺准确率并无显著提高[14]。 超声造影的可靠性有赖于技术的发展,还需要通过大规模和高质量前瞻性研究,制订相对规范和统一的操作方法、造影剂使用和诊断标准,以提高早期诊断率。
二、前列腺癌超声造影的病理学基础
PCa的生长依赖于肿瘤血管的生成,其组织内微血管的数量较前列腺良性组织显著增多[15],故检测前列腺内微血管密度的变化是发现PCa的可行方法,以上病理表现为通过超声检查检测微血管诊断PCa提供了基础。CEUS可以显示微循环的灌注,理论上可以提高PCa诊断的敏感度和特异度[16,17]。
三、常规前列腺超声检测未见异常病灶而超声造影发现有CAD的活检结果分析
本组资料为56例PSA升高、常规超声检查阴性而经超声造影发现CAD的病例,采用十点定位穿刺法,其中7例患者部分阳性穿刺点落在CAD区域(共20个穿刺点阳性,其中15个点位于CAD区域,另外5个点不在CAD区域);有4例患者共15个阳性穿刺点均不在CAD区域。56例患者中,CAD区域共穿刺了99个点,其中15点穿刺病理证实为PCa(真阳性),有84个点穿刺为阴性(假阳性),不在CAD区域穿刺了461个点,其中有20个穿刺点是阳性(假阴性),441个穿刺点为阴性(真阴性),CAD区域的敏感性42.86%(15/35),特异性84.00%(441/525),阳性预测值15.15%(15/99),阴性预测值95.66%(441/461)。 56例患者CAD区域的活检阳性率12.5%(7/56),在所有造影的病例中,CAD区域活检的阳性率是非CAD区域的3.9倍(15.15% vs 3.9%),两者间有明显的统计学差异(P<0.05)。这里有两个重叠的阳性穿刺点,即在CAD区域检测PCa的病例,同时在非CAD区域也检出PCa,另一方面,同一个CAD区域同时又有几个阳性的穿刺点,但是这不影响CAD区域PCa阳性的统计,PCa区域的血管密度明显高于非PCa区域,超声造影是有意义的。
四、前列腺癌的微血管分布与超声造影的局限性
正常前列腺为少血流器官,PCa时新生血管增加,支持恶性细胞的生长发育,当弥漫性或区域性血流分布明显增多时,则癌发生的可能性明显增高,本组CAD区域的大小与PCa有相关性,证实PCa的分布范围较广,或呈散在分布,而非PCa的CAD区域范围较小(图4)。经直肠彩色多普勒超声不仅可以直观地显示前列腺整体血流分布情况,更可以显示某异常结节的血流特征,从而有助于可疑肿瘤病灶的显示[18]。但是并不仅仅PCa的病灶血流增加,前列腺炎、前列腺增生等疾病的血流也会增加,仅仅通过微血管的增多来判断病灶的性质显然是偏颇的。与此同时,超声造影强调的是时间-强度的改变,强调的是一个过程,那个过程有快有慢;而二维灰阶超声注重的是回声强度的改变,是根据回声强度来判断有无微血管的异常分布,如果有些病灶的超声造影是快进快退,或一闪而过(散在分布的PCa存在这个现象),那么这些病灶就来不及捕捉,这就是根据超声造影来寻找可能的PCa病灶的局限性,除非每一个灰阶层面都做时间-强度记录,然后把所有的层面叠加起来,形成整个前列腺的时间-强度声像图改变。只做两次前列腺超声造影,一定会存在漏检的问题,这就是本次试验的局限性,如果要在每一个层面都做时间强度分析,必须要有伦理委员会的论证和基础实验验证可能存在的风险。这些因素都影响了超声造影对PCa的阳性预测值。本组病例中有17例发现造影剂快进快退,这些病灶相对来说容易判断,而39例微血管异常分布的是根据微气泡的走行可能存在异常来判断,主观性非常大,因此后者活检的阳性率也明显低于前者。如果只是根据微气泡走行异常判断CAD,其活检阳性率仅4.87%(2/41)稍高于未见异常CAD区域的4.34%(20/461),没有统计学差异。很明显,根据微血管叠加成像判断微血管的异常分布有主观方面的局限性。
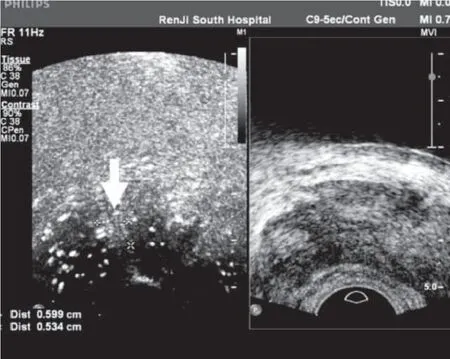
图5 前列腺右侧外周带见微气泡异常走行区
五、超声造影在前列腺常规检测未见异常但PSA升高的患者中指导穿刺活检的临床意义
本组资料中,PCa组的前列腺体积明显比良性组小,PSA高于良性组,与文献报道的结果一致[19],同时CAD的体积大于前列腺活检良性组,说明PCa组确实存在着微血管增多的现象,而良性组中较小体积的CAD存在着解读方面的原因,或者良性组中本身就是正常的微血管分布被解读为异常。在17例外腺高灌注区中,回顾分析12例活检良性患者的超声造影图像,发现这些CAD体积明显小于恶性患者,在(0.43±0.11)mL左右(图5)。PCa的微血管密度增加不只在肿瘤组织内,肿瘤组织周围的微血管密度就已经开始增加,而CAD区域体积在0.5mL以下者与PCa没有明显关系,可能这些区域在活检时漏检,也有可能探头频率较低,对小病灶CEUS增强表现的细节观察造成一定程度影响。同时本组56例患者每例只发现1个CAD区域,这本身也是个问题,与我们的主观分析有关,因为PCa是散在分布的,微血管的异常分布理论上讲也是散在分布的,从理论上讲,CAD的分布与前列腺阳性穿刺点的分布有一定的相关性,本组7例PCa患者的20个阳性穿刺点的分布与CAD的分布有一定的相关性,可能我们把PCa的多个微血管异常区域当成一个区域有关。

图6 前列腺癌与前列腺良性组织的病理学所见
如果只是为了明确诊断前列腺内是否有PCa,超声造影的阳性率在19.64%(11/56),可以部分发现常规超声没有发现的PCa;如果进一步要发现前列腺内多个CAD区域,以明确PCa的微血管增多区域在前列腺内的分布,以指导穿刺活检,那么增加超声造影的次数是必须的。
本组资料不同于既往国内外研究中只对前列腺有可疑病变的区域行相对固定的、有针对性的CEUS检测,第一次是动态的实时的扫查,不受切面选择的限制,第二次是根据第一次造影的声像图表现,再有针对性的观察可疑病灶区域的造影剂的进退和微血管的走行。这样做确实有利于可疑PCa病灶的检出,但也有一定的主观性,特别是那些快进快退的CAD区域,或者范围较小的CAD区域可能会漏掉或误认。本研究结果表明,对血清PSA升高但常规超声未发现可疑PCa病灶的患者,经直肠前列腺超声造影实时扫查有助于检出可疑的PCa病灶,并指导前列腺穿刺活检。
1 Xie SW, Li HL, Du J, Xia JG, et al. Infl uence of serum prostate-specific antigen (PSA) level, prostate volume, and PSA density on prostate Cancer detection with contrast-enhanced sonography using Contrast-tuned imaging technology. J Ultrasound Med 2013; 32(5):741-748
2 郭祎芬, 李凤华 , 谢少伟, 等. 不同血清前列腺特异抗原水平前列腺癌超声造影微血管成像与常规超声靶向引导穿刺活检的对比. 中国医学影像技术 2010; 26(7):1304-1307
3 徐辉雄, 郭乐杭. 前列腺超声造影临床应用指南 (2012)解读. 中华医学超声杂志·电子版 2014; 11(2): 12-14
4 Jiang J, Chen Y, Zhu Y, et a1. Contrast-enhanced ultrasonography for the detection and characterization of prostate cancer: correlation with microvessel density and Gleason score. Clin Radio1 2011; 66(8): 732-737
5 Lee HJ, Hwang SI, Chung JH, et a1. Evaluation of tumor angiogenesis in a mouse PC-3 prostate cancer model usingdynamic contrast-enhanced sonography. J Ultrasound Med 2012; 31(8): 1223-1231
6 Dvorak T, Chen MH, Renshaw AA, et a1. Maximal tumor diameter and the risk of PSA failure in men with specimen-confi ned prostate cancer. Urology 2005; 66(5):1024-1028
7 Zellweger T, Günther S, Zlobec I, et a1. Tumour growth fraction measured by immunohistochemical staining of Ki67 is an independent prognostic factor in preoperative prostate biopsies with small-volume or low-grade prostate cancer. Int J Cancer 2009; 124(9): 2116-2123
8 唐杰, 李颂, 李俊来, 等. 550例经直肠超声引导下前列腺穿刺活检的临床总结. 生物医学工程与临床 2002;6(1): 29-31
9 汪娜, 唐杰, 李欣, 等. 超声结合尸检对前列腺外腺良性增生性低回声结节的研究. 中华泌尿外科杂志 2005;26(5): 312-314
10 Slonim SM, Cuttino JT Jr, Johmson CJ, et al. Diagnosis of prostatic carcinoma: value of random transrectal sonographically guided biopsies. AJR 1993; 161(5):1003-1006
11 Halpern EJ, M cCue PA, Aksnes AK, et a1. Contrastenhanced US of the prostate with Sonazoid: comparison with whole-mount prostatectomy specimens in 12 patients. Radiology 2002; 222(2): 361-366
12 Halpern EJ, Verkh L, Forsberg F, et a1. Initial experience with contrast-enhanced sonography of the prostate. AJR Am J Roentgenol 2000; 174(6): 1575-1580
13 Sharma S. Imaging and intervention in prostate cancer:current perspectives and future trends. Indian J Radiol Imaging 2014; 24(2): 139-148
14 Taverna G, Morandi G, Seveso M, et a1. Colour Doppler and microbubble contrast agent ultrasonography do not improve cancer detection rate in transrectal systematic prostate biopsy sampling. BJU Int 2014; 108(11) : 1723-1727
15 Kaygusuz G, Tulunay O, Baltaci S, et al. Microvessel density and regulators of angiogenesis in malignant and nonmalignant prostate tissue. Int Urol Nephrol 2007;39(3): 841-850
16 Zhao HW, Luo JH, Xu HX, et al. The value of contrastenhanced transrectal ultrasound in predicting the nature of prostate diseases and the Gleason score of prostate cancer by a subjective blood fl ow grading scale. Urol Int 201l;87(2): 165-170
17 Fillon M. Contrast-enhanced ultrasound may aid prostate cancer detection. J Natl Cancer Inst 2013; 105(7): 444-446
18 陈亚青, 周永昌, 黄慕箴. 经直肠超声检查对前列腺癌穿刺点选择的价值. 中国超声医学杂志 2003; 8(6): 624-626
19 李秋洋, 唐杰, 李岩密, 等. 经直肠超声引导下前列腺穿刺活检临床分析. 中华医学超声杂志·电子版 2014;11(11): 13-16
(2016-06-08收稿)
The clinic value and problems of the contrast-enhanced ultrasound in the patients with negative finding in conventional prostate sonography
Xia Jianguo, Li Fenghua, Liu Yi, Wen Xiaodan, Jiang Shufei
Department of Ultrasound, South Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 201112, China
Objectivee To discuss the clinical value and the limitations of contrast-enhanced ultrasound (CEUS) in prostate biopsy of the patients with high level of serum prostate-specifi c antigen (PSA), but no abnormal sonography focus in prostate. Metthhooddss Total of 56 patients with high level of serum PSA but no specifi c sonography focus underwent an examination of trans-rectal CEUS before needle biopsy. The relationships of the biopsy results in each site and the contrast anomalous distribution in CEUS were observed and analyzed. Ressuullttss Eleven cases were diagnosed as PCA in 56 patients by pathological doctor. Seven patients had some positive puncture point in CAD area (A total of 20 puncture point is positive,including 15 points in CAD area, the other fi ve points not in CAD area), a total of 15 positive puncture point in 4 patients were not in CAD area. The sensitivity, specificity, positive predictive value, negative predictive value of the CAD were 42.86%(15/35), 84.00% (441/525), 15.15% (15/99),95.66% (441/461), respectively. The detection probability of PCA in CAD areas is 3.9 times of non-CAD areas in all patients (15.15% vs 3.9%,P<0.05),there was statistical signifi cance between the two areas. There was a relationship between the positive puncture point and the CAD area (r = 0.661). There was a signifi cantrelationship between the PCA and the CAD volume, Compared with the benign groups, the PCA groups had larger CAD volumes (1.01±0.13mL vs. 0.37±0.14mL, P<0.05). PCA and PSA level showed a positively correlation (r = 0.961), PCA and the prostate volume showed a negative correlation (r = -0.842). Conclusionusion CEUS can be used to fi nd prostate cancer in suspicious patients whose conventional prostate sonography examination was negative and PSA level was over normal range. However, to completely display PCA microvascular characteristics still need to do contrast-enhanced ultrasound more time.
prostatic neoplasms; Biopsy, Needle; contrast-enhanced ultrasound
10.3969/j.issn.1008-0848.2016.07.004
R 737.25
