对高危局限性前列腺癌患者个体化综合治疗的体会(附1例报道并文献复习)
2016-11-21军温海东俊肖远松张小明胡卫列
吕 军温海东,刘 俊肖远松张小明胡卫列
1.广州军区广州总医院泌尿外科/全军泌尿外科中心(广州 510010); 2.广东医科大学
对高危局限性前列腺癌患者个体化综合治疗的体会(附1例报道并文献复习)
吕 军1温海东1,2*刘 俊1肖远松1张小明1胡卫列1
1.广州军区广州总医院泌尿外科/全军泌尿外科中心(广州 510010); 2.广东医科大学
目的 提高对高危局限性前列腺癌个体化综合诊疗方式的认识。方法 对1例高危局限型前列腺癌患者的临床资料及诊疗方案进行回顾、分析,并进行相关文献复习。此患者先后经历了最大限度雄激素阻断治疗、高强度聚焦超声前列腺消融、三维适型调强放疗、经直肠穿刺125I粒子植入、多西他赛联合强的松、口服磷酸雌莫司汀化疗和阿比特龙抗雄等综合治疗方式。结果 患者于2006年9月查PSA 158.69ng/mL,经直肠前列腺穿刺病理确诊为前列腺低分化腺癌,Gleason评分5+4=9分,经综合治疗后,目前已进展为去势抵抗性前列腺癌,伴全身多发骨转移,予再次多西他赛联合强的松3周化疗方案,目前PSA较化疗前显著降低,体能状态较好,骨痛不适症状明显好转,仍在随访治疗中。结论 对高危局限性前列腺癌患者采用个体化综合治疗策略,能推迟肿瘤的进展,提高患者的生存质量,值得临床进一步探讨。
综合疗法; 前列腺肿瘤
近年来,前列腺癌发病率呈现逐年上升趋势,且部分患者就诊时已为局部晚期,全身基础疾病较多,多采用以内分泌治疗为基础的综合治疗。高危前列腺癌由于发生转移的风险较高,行根治性前列腺切除和外放射治疗一直存在争论,以内分泌治疗为核心的综合治疗方式在临床上取得了较理想的疗效,但大部分病例最终仍转变为去势抵抗性前列癌(castration-resistant prostate cancer CRPC),化疗为转移性CRPC(metastatic mCRPC)的主要治疗方式。本研究回顾性分析1例高危局限型前列腺癌患者临床资料,采用了以内分泌治疗为基础的个体化综合治疗,并结合我科近10年来的诊疗经验及文献回顾,报告如下。
临床资料
患者77岁,主诉尿痛、排尿无力1年余,加重伴排尿中断、尿不尽感6月余,于2006年9月8日入住我科。入院时查PSA158.69ng/mL,直肠指诊:前列腺增大,约5cm×4cm,质地硬,中央沟消失,左侧叶可触及大小约3cm×2cm结节,表面不平整,轻触痛,指套无血染。既往有慢性支气管炎40年,因反复感染间断服用抗生素治疗,无高血压、糖尿病、冠心病病史。
经直肠前列腺彩超检查:全腺59mm×42mm× 47mm,左侧内外腺之间可见31mm×21mm低回声。CT:左侧前列腺呈结节样向膀胱内突出,平扫CT值约48.5Hu,呈均匀等密度,增强后扫描CT值约为85.0Hu,稍不均匀明显强化,双侧精囊腺增大,与前列腺分界欠清。全身核素骨显像(ECT)和胸片检查均未见异常。
经直肠前列腺穿刺活检病理:前列腺左底部符合前列腺低分化腺癌,Gleason评分为5+4=9分。
方法与结果
对该例患者的综合治疗分5个阶段,每个阶段均进行复查,现将各阶段的治疗方法与结果分述如下。
患者依从性好,自发病至今已9年余,一直在我院诊治,并遵嘱监测相关生化及影像学指标, 采用实体瘤疗效评价标准RECIST(1.1版)对肿瘤发展进行评估,客观反应根据经直肠前列腺B 超检查前列腺低回声结节大小、PSA 水平、ECT骨扫描等将疗效分为完全反应(CR)、部分反应(PR)、病情稳定(SD)、病情恶化(PD)。主观反应根据骨痛、排尿异常等症状的变化分为症状消失、症状改善、症状平稳、症状加剧。
第一阶段(2006年9月至2010年3月) 经病理明确诊断后,考虑临床分期为T1aN0Mx,在充分告知的前提下,患者最终拒绝行前列腺癌根治性切除术,要求行手术去势。于2006年9月26日行双侧睾丸白膜下切除术,术后服用抗雄激素类药物(比卡鲁胺50mg,1/d)行最大限度限度雄激素阻断(maximal androgn blockade, MAB)治疗,期间复查病情稳定,排尿情况可,术后复查最大尿流率在18 mL/s,血清PSA维持0.26~2.66ng/mL,睾酮为0.0001nmol/L,期间疗效完全反应,症状平稳。
第二阶段(2010年3月至2011年11月) 在符合各项治疗指征的情况下,由于治疗初期Gleason评分为9分,CT提示前列腺包膜外有侵犯,无全身转移征象,符合近距离照射联合外放疗指征。此治疗期间采用试验性前列腺癌局部治疗[经直肠高强度聚焦超声系统(highintensity focused ultrasound, HIFU)]、前列腺外放射治疗38次(三维适型调强放射治疗)、前列腺近距离放射治疗(经直肠穿刺125I 粒子植入),此阶段仍配合内分泌治疗。
此期间PSA持续升高,2010年3月患者入院复查PSA为7.255ng/ml,睾酮仍维持在去势水平,2010年7月复查彩超:前列腺体积较前增大。此后PSA呈逐步上升趋势,2011年9月 PSA为16.862ng/ml,复查CT提示前列腺癌骶骨转移,期间病情恶化,症状平稳。
第三阶段(2011年11月至2013年5月) 患者确诊为去势抵抗性前列腺癌,此阶段主要采用多西他赛联合激素(多西他赛140mg+强的松5mg×3次/d)化疗,每3周1疗程化疗方案,共10个疗程。2012年7月开始口服小剂量磷酸雌莫司汀(140mg,2/d)化疗。2011年11月PSA升高至27.8ng/mL,于2012年2月第5次化疗后复查PSA降至0.656ng/mL,停药观察1个月(期间出现粒细胞减少导致肺部感染)。2012年3月PSA升至12.69 ng/ mL,2014年4月PSA为40.526ng/mL,再次采用多西他赛化疗5个疗程,2012年7月复查PSA降至0.628ng/ mL。2012.8出现尿线变细,排尿不出,行尿流动力学检查提示前尿道狭窄,膀胱收缩力减弱,行尿道膀胱镜检和后尿道前列腺部狭窄段扩张,术后复查最大尿流率16.4 mL/s。2012年9月至2013年5月因泌尿系感染多次住院治疗,因化疗副作用较大,再次停化疗并口服小剂量磷酸雌莫司汀(140mg,2/d),2012年10月 ECT提示肿瘤骨转移,盆腔MRI提示S3~5椎体、右侧髂骨及尾骨骨质破坏、周围软组织受侵,此期间未诉骨痛等不适,此后复查时常规予唑来膦酸(4mg)预防和治疗骨相关事件,期间疗效部分反应,症状加剧。
第四阶段(2013年5月至2015年9月) 醋酸阿比特龙(4片/次,1/d)联合强的松片(10mg,1/ d)治疗。
2013年5月查PSA15.33ng/mL,自行购得醋酸阿比特龙(商品标号:3JJHK412831L01/0913),开始调整用药为阿比特龙联合强的松(10mg,1/d)维持。2013年7月PSA 4.963ng/ml,2013年9月查ECT提示骶、尾骨骨代谢异常活跃,考虑肿瘤骨转移进展,2015年2月再次复查ECT提示骨转移进展,周围软组织受侵,直至2015年8月,复查PSA 71.101ng/mL。
第五阶段(2015年9月至今) 此阶段继续采用多西他赛联合强的松化疗方案,期间病情恶化,症状平稳。
2015年8月采用抗雄激素撤退治疗1个月后复查PSA升至79.269 ng/ml,阿比特龙出现药物抵抗,且此时伴4、5腰椎及双侧坐骨处疼痛不适,MRI提示骶尾椎及右侧髂骨骨质破坏范围较前增大。考虑到既往患者接受多西他赛化疗有反应,身体状况良好,再次行多西他赛标准化疗方案,目前已予化疗5疗程,骨痛症状予芬太尼透皮贴对症处理后效果良好,且有逐渐减轻趋势,患者依从性好,目前仍在随访治疗中,此期间病情恶化,症状加剧。
讨 论
前列腺癌病程是一个渐进性发展的过程,如患者在接受长期去势治疗后,最终将不可避免进入CRPC 阶段,此时往往已伴有骨转移,全身一般情况较差,可供选择的治疗方案已不多,如何选择合适有效的方案来推迟前列腺癌进展,提高患者的生存质量成为当前国内外研究关注的热点话题。而局部高危前列腺癌是具有显著进展性、有临床症状并最终导致患者死亡的类型。Grimm等[1]发现,在高危前列腺癌患者中,与单一使用外科手术、外放疗或近距离放射治疗相比,以内分泌治疗为基础的联合治疗,患者的无生化进展生存率更高,多模式个体化的综合治疗是目前高危前列腺癌治疗主要模式。
一、定时追踪生化及影像学进展
穿刺病理作为确诊前列腺癌的重要依据,而Gleason评分是判断预后和指导治疗的重要指标。行前列腺穿刺活检时,必须足量取材、穿刺点分布广泛, 前列腺体积较大时,应均匀增加穿刺点, 对直肠指检可疑之处也应当增加穿刺点,提高穿刺针数阳性百分比[2]。PSA是判断前列腺癌疗效和预后最有价值的标志物,联合直肠指检也是目前公认的早期疑似前列腺癌最佳方式,且治疗后PSA最低值、下降时间、缓解幅度与预后直接相关[3]。PSA绝对值与影像学表现存在一定的相关性,PSA较高值时,并不一定出现影像学进展(图1),或者患者出现临床进展,其PSA水平可正常,说明了PSA水平并非是一个可靠的逃逸标记物。仅仅PSA进展不足成为停药的标准,还应该根据影像及临床进展进一步确认。以本研究患者诊断和治疗方案的选择均依据PSA、睾酮水平、生化及影像学检查确立,但仅仅依靠PSA值评估患者预后敏感性和特异性不足,如在查体或临床出现可疑症状时,尽早行ECT或其他影像学检查排除早期骨转移(图2)。经直肠指检发现结节或超声检查发现肿瘤复发、再发低回声结节等,就有必要进一步行MRI或者PET /CT,近年来MRI凭借着无创性及多参数多序列成像能力被认为是前列腺癌最佳影像学诊断技术[4]。作者认为,联合多种影像学检查有助于早期发现肿瘤局部复发或远处转移,依此决定下一步的治疗方式。本研究患者ECT及CT提示骨转移明显早于临床症状,及早给予唑来膦酸抑制骨吸收,其作为骨转移综合治疗的基础药物,可降低骨相关事件的发生率和延缓骨痛发生时间。监测PSA、乳酸脱氢酶、碱性磷酸酶及影像学进展作为高危前列腺癌诊疗的首要依据,应该首先纳入综合治疗方式之一。
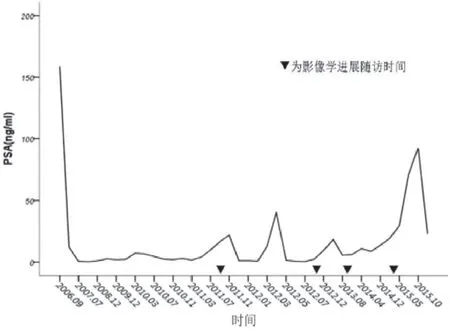
图1 患者复查PSA结果趋势图
二、探讨以内分泌治疗为基础的综合诊疗方式
根治性手术和外放射治疗是目前治愈局限性前列腺癌最有效的方法之一,也是提高前列腺癌无瘤生存率的重要基础,这一观点已经得到了专家的认可[5]。查阅患者9年前相关资料,当时诊断确立后,考虑癌肿较为局限,预期寿命大于10年,影像学无转移证据,应行标准的前列腺癌根治性切除治疗,Gleason评分为高危,在术后可给予其他辅助治疗[1]。除手术外,内分泌治疗作为目前临床首选的积极治疗方法,与单用抗雄激素药物治疗相比,对于局限性前列腺患者应用MAB治疗,雄激素阻断更完全,且治疗时间越长,PSA复发率越低,可降低死亡风险和延长肿瘤无生化进展生存期[1]。因此,在进展为CRPC之前,内分泌治疗应该作为主要的基础治疗方案,亦是手术、放疗等前列腺局部治疗的主要辅助治疗方式。前列腺局部治疗是目前有望根治局限性前列腺癌和晚期姑息性减瘤的方法,包括外放射治疗、粒子植入、以及冷冻、HIFU和射频消融等治疗。局部治疗与内分泌治疗联合应用,可明显提高肿瘤控制率和生存率。HIFU原理为用高能超声波对肿瘤组织进行脉冲式烧灼,可根据术中实时显示前列腺治疗的切面图像进行相关调整,使得肿瘤组织发生凝固坏死。具有微创、患者容易接受、可重复应用及手术简单易行的特点[6],近年来国外报道HIFU治疗高危前列腺癌术后5年生化无疾病生存率为45%~62%,对于合并良性前列腺增生,能对深部前列腺组织进行选择性破坏,同时达到解除梗阻和杀伤肿瘤细胞的目的。而对于PSA>20ng/mL局限性前列腺癌,经直肠HIFU 治疗肿瘤控制效果不理想[7],此患者术后出现的尿道狭窄主要考虑为局部放疗和HIFU的远期并发症。
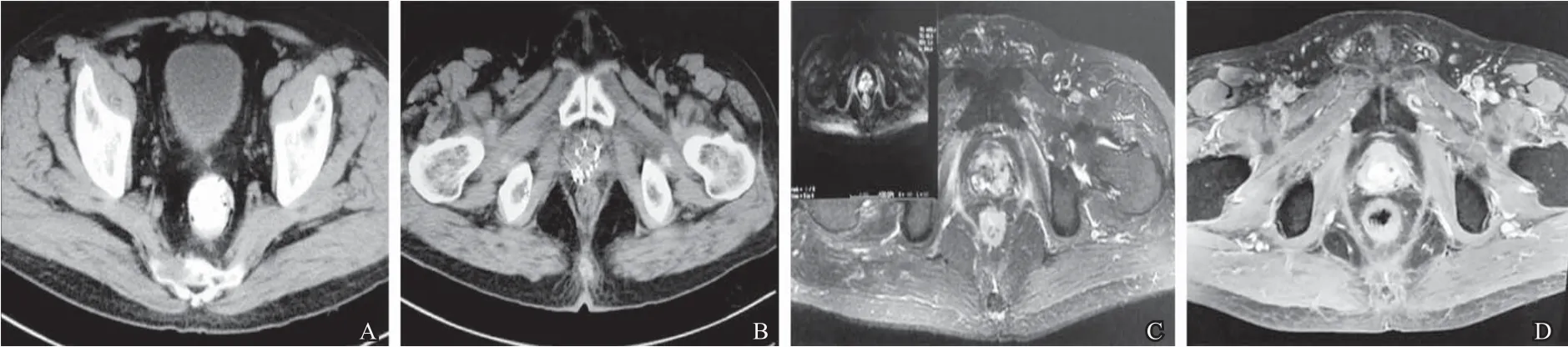
图2 患者复查CT/MRI影像学进展资料
近距离放射治疗可作为局限性前列腺癌外放疗后生化复发的挽救性治疗方案,联合内分泌治疗疗效优于单一治疗方案[8],作者等[9]对中高危前列腺癌患者行经直肠途径穿刺125I 粒子植入联合内分泌治疗,临床疗效满意,手术安全、微创,可有效延缓疾病进程,且没有严重并发症发生。由于局部放射治疗靶点更精确,减少直肠和膀胱的放疗剂量,降低生化进展率,性功能影响小,显著提高了患者的生活质量,是除前列腺癌根治术及外放射外又一种有效控制局限性前列腺癌的有效方式[10]。患者行HIFU、放疗及经直肠穿刺125I 粒子植入后,PSA仍持续升高,再次复查CT后提示考虑骶骨转移,确诊为晚期前列腺癌,此时局部治疗虽可杀灭肿瘤原发灶癌细胞,起到减瘤效果,应属于挽救性治疗,对远处转移的患者治疗效果不佳。局部治疗期间,患者仍在维持MAB治疗,总体生活质量满意。综合治疗在一定程度上延缓了肿瘤的进展,明显提高肿瘤控制率和生存率,术后PSA升高主要为疾病进展所致。因此,有必要在行局部治疗前评估有无远处转移,以免延误最佳的化疗时机。
三、多西他赛联合泼尼松3周治疗方案仍是mCRPC重要治疗选择
多西他赛是一种紫杉烷类抗癌药物,由于其药动学呈时间和剂量依赖性的特点,因此选择最佳的给药剂量和给药方案很有必要。长期的随访研究证明,多西他赛联合强的松3 周方案有较好的疗效,其在延长患者中位生存期和改善患者的生活质量方面优于米托蒽醌,降低患者的死亡危险,有助于缓解晚期骨痛。以其为核心的化疗方案已取代传统的米托蒽醌成为目前治疗mCRPC的一线方案,也是目前联合用药中比较稳定的组合,得到了美国FDA的批准[11]。患者确诊为CRPC后,采用以多西他赛为主的化疗方案,经过5个疗程的化疗后,患者由化疗前27.8ng/mL降至0.6ng/mL,表现出对药物较好的敏感性,但停药后出现了生化复发。已有相关研究报道认为化疗前基线Hb浓度及化疗周期数是影响患者总生存期的预后因素,Gleason评分、PSA水平及倍增时间、碱性磷酸酶和乳酸脱氢酶也是重要的风险因素[12]。因此化疗前均加强营养并及时给予升白细胞治疗,同时应根据患者的具体耐受情况,足量、足周期化疗,以期达到最佳的化疗效果。
CRPC 患者对多西他赛一线治疗初始反应较为良好,出现疾病进展后再次复治显示出潜在的持续抗肿瘤活性,可作为一线治疗的延伸[13]。目前还没有在Ⅲ期临床试验中直接研究,也是患者再次行此方案化疗的基础,但即便初始治疗有效最终也会产生耐药,而且多西他赛所带来的细胞毒效应,并非所有患者都适合或愿意接受化疗,此患者在化疗后出现了严重骨髓抑制,恶心、呕吐、全身乏力较为明显,多次化疗后出现粒细胞严重下降问题亦不可忽视。对于多西他赛耐药或不适合使用该药治疗的患者如何选择其他治疗方案显得尤为重要。自2010年以来,很多新的疗法,如二线化疗药物卡巴它赛、分子靶向药物地诺单抗、免疫制剂sipuleucel-T、新型的口服抗雄激素类药物阿比特龙、恩杂鲁胺、MDV3100,以及作用于前列腺癌骨转移灶的镭-223等新药物均能延长CRPC患者中位生存期,都取得了较满意的疗效。磷酸雌莫司汀与多西他赛均为细胞M期特异性药物治疗,可裂解肿瘤细胞骨架,专一性破坏癌细胞,对单纯激素疗法疗效差的mCRPC患者有较好的疗效,磷酸雌莫司汀联合多西他赛安全有效,可使PSA降幅超过50%,转移灶缩小,临床症状得到有效缓解。Petrioli等[14]通过临床发现单用小剂量磷酸雌莫司汀治疗晚期去势抵抗性前列腺癌,10%~48%患者PSA显著降低,中位生存时间为40个月,而对于已行多西他赛等化疗的患者,小剂量的磷酸雌莫司汀联合阿司匹林治疗晚期抵抗性前列腺癌能达到3.6个月的肿瘤无进展生存率,总的生存时间为7.6个月,同时减少心血管并发症的风险。虽然不同组合方式的全身化疗能不同程度降低PSA、控制疾病进展及缓解疼痛。患者行艾去适治疗8个月,PSA呈逐渐上升趋势,考虑到既往曾行多西他赛化疗,同一类药物或单使用一种可能并不能取得理想的疗效,结合文献分析,磷酸雌莫司汀联合多西他赛可能是CRPC患者较好的化疗组合方式。
四、阿比特龙可使mCRPC患者生存获益,未来多中心研究值得期待
近年来,以阿比特龙为代表的新一代强效内分泌治疗药物显示出良好的治疗效果,其不仅能缩小肿瘤,降低PSA水平,减轻晚期骨痛症状,同时适用于过去接受过化疗晚期肿瘤患者。与替代性CYP17抑制剂酮康唑相比,阿比特龙的有效性、安全性和诱导临床反应更具优势[15],尤其适合身体状况差的mCRPC患者的治疗,是继卡巴他赛后CRPC治疗的又一突破[16],一项Ⅲ期临床研究证明,阿比特龙联合强的松治疗多西紫杉醇治疗失败的mCRPC患者,PSA进展时间和总生存期分别为8.5、15.8个月,进一步证明了雄激素信号通路在CRPC的进展中仍然发挥着重要作用[17]。由于阿比特龙临床疗效确切,毒性较小,口服方便,耐受性好,多数学者推荐在多西他赛失败后首选阿比特龙治疗,圣加伦共识上,绝大部分学者认为,阿比特龙或恩杂鲁胺是无症状或轻微mCRPC的一线方案。因此在药品可及的情况下,应该使用有明确生存获益的新型内分泌药物(阿比特龙或恩杂鲁胺),而不是传统的二线内分泌治疗。也有研究证明阿比特龙联合强的松用于初治CRPC,无论在疾病无进展生存时间还是总生存时间上都会明显获益,副作用轻微,患者生存质量高,推迟行化疗的时间[18]。副作用主要为盐皮质激素生成过多,需定期监测血压和电解质指标。由于阿比特龙刚上市,多中心研究较少,本患者服用阿比特龙联合强的松治疗2年,与文献报道相比[17,18],减缓了PSA的进展,降低了死亡风险,增加了患者影像学无进展生存时间,即便阿比特龙出现耐药,也可以根据患者的具体情况试用其他机制的抗雄药物以及启用目前较新的靶向治疗药物,值得进一步探索研究。
本研究对1例患者进行长期的跟踪随访,仅仅是个案,难以形成有效的代表性,目前患者治疗还未完成,但从PSA反应及骨痛症状缓解来看,已初见反应,更远期的疗效仍待观察;在同一患者身上先后采用了多种治疗方式,可能的最优用药顺序以及最佳的启动治疗时间,目前依然未知。但是在没有明确药物使用顺序的循证医学证据前提下,mCRPC分类治疗(根据患者症状、是否转移、体能评分、是否接受过多西他赛化疗)策略是一个可选择的方案[5]。本研究充分显示了依据影像学及生化监测结果采用个体化综合治疗策略可使前列腺癌患者受益,延缓了前列腺癌进展,是安全可行的,也是国际上前列腺癌诊断和治疗指南所提倡的治疗方式[19]。国内对晚期CRPC的化疗及阿比特龙联合泼尼松治疗方案与其他联合治疗方式的对比,鲜见相关的研究报道,需要进一步的临床研究。应该重视前列腺的终身管理和随访,及时根据每个患者的具体特征以及监测的数据形成序贯疗法,对晚期骨痛采用个体化阶梯治疗策略,重视多学科合作,对于改善患者的生存质量具有重要的实际意义。
综上所述,前列腺癌是一个病变逐渐进展的过程,需终生督导治疗,对高危局限型前列腺癌患者采用个性化综合治疗方式,能推迟肿瘤的进展,延长患者带瘤生存期,改善患者的生存质量。
1 Grimm P, Billiet I, Bostwick D, et al. Comparativeanalysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int 2012;109 Suppl 1: 22-29
2 刘俊, 胡卫列, 宋波, 等. 穿刺标本Gleason评分预测前列腺癌病理分级准确性的研究. 中国男科学杂志 2010;24(3): 25-28, 32
3 Critz FA, Levinson AK, Williams WH, et a1. Prostate specifi c antigen nadir achieved by men apparently cured of prostate cancer by radiaotherapy. J Urol 1999; 161(4):1199-1203
4 曹曙, 胡卫列, 韩立新, 等. 3种无创检查在前列腺癌初筛诊断中的应用价值. 重庆医学 2014; 43(22): 2868-2869, 2872
5 那彦群, 叶章群, 孙颖浩, 等.中国泌尿外科疾病诊断治疗指南手册.2014版. 北京:人民卫生出版社, 61-84
6 陈照阳, 吕军, 胡卫列, 等. 经直肠高强度聚焦超声联合内分泌疗法治疗前列腺癌. 中国男科学杂志 2008;22(4): 37-39
7 Crouzet S, Chapelon JY, Rouvière O, et al. Whole-gland ablation of localized prostate cancer with high-intensity focused ultrasound: oncologic outcomes and morbidity in 1002 patients. Eur Urol 2014; 65(5): 907-914
8 Warde P, Mason M, Ding K, et al. Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: A randomized,phase 3 trial. Lancet 2011; 378 (9809): 2104-2111
9 吕军, 吴浩明, 王尉, 等. 间歇性内分泌治疗联合125I粒子植入治疗中高危前列腺癌的临床研究. 中国男科学杂志 2013; 27(8): 28-32
10 Georgakopoulos J, Zygogianni A, Papadopoulos G, et al. Permanent implantation as brachytherapy technique for prostate carcinoma-review of clinical trials and guidelines. Rev Recent Clin Trials 2012; 7(3) : 173-180
11 Berthold DR, Pond GR, de Wit R, et al. Survival and PSA response of patients in the TAX 327 study who crossed over to receive docetaxel after mitoxantrone or vice versa. Ann Oncol 2008; 19(10): 1749-1753
12 瞿元元, 戴波, 孔蕴毅, 等. 影响多西他赛化疗的转移性去势抵抗性前列腺癌患者总生存期的预后因素分析.
中国癌症杂志 2012; 22(10): 779-783
13 Bracarda S, Logothetis C, Sternberg CN, et al. Current and emerging treatment modalities for metastatic castration -resistant prostate cancer. BJU Int 2011; 107 Suppl 2 : 13 -20
14 Petrioli R, Roviello G, Fiaschi AI, et al. Low-dose estramustine phosphate and concomitant low-dose acetylsalicylic acid in heavily pretreated patients with advanced castration-resistant prostate cancer. Clin Genitourin Cancer 2015; 13(5): 441-446
15 Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: fi nal overall survival analysis of the COU-AA-301 randomised, double - blind, placebo-controlled phase 3 study. Lancet Oncol 2012; 13(10) : 983-992
16 Ryan CJ, Shah S, Efstathiou E, et al. Phase II study of abiraterone acetate in chemotherapy-naive metastatic castration resistant prostate cancer displaying bone fl are discordant with serologic response. Clin Cancer Res 2011;17(14): 4854-4861
17 de Bono JS, Logothetis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364(21): 1995-2005
18 Ryan CJ, Smith MR, de Bono JS, et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368(2): 138-148
19 Cookson MS, Roth BJ, Dahm P, et al. Castration-resistant prostate cancer: AUA Guideline. J Urol 2013; 190(2):429-438
(2016-03-08收稿)
Individualized comprehensive treatment strategies for high risk of localized prostate cancer patients(one case report and literatures review)
Lv Jun1, Wen Haidong1,2*, Liu Jun1, Xiao Yuansong1, Zhang Xiaoming1, Hu Weilie1
1.Department of Urology, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, Guangdong, China;2. Guangdong Medical University, Zhanjiang
Corresponding author: Wen Haidong, E-mail: 455813506@qq.com
Objectivee To improve the understanding of comprehensive treatment for high risk of localized prostate cancer. Metthhooddss One case high risk of localized prostate cancer of our hospital clinical, The clinical data and the results of the patients followed-up were retrospectively reviewed. experienced the maximum androgen blockade therapy, high intensity focused ultrasound ablation of the prostate, intensity modulated radiation therapy, transrectal prostate125I seeds implantation, docetaxel combined with prednisoney, oral estramustine and abiraterone comprehensive treatment. Ressuullttss In September 2006, the patients admitted to hospital check PSA158.69 ng/mL, pathologic diagnosis of poorly differentiated adenocarcinoma of the prostate, Gleason score 5+4= 9 points, the patient has now been progress for castration resistant prostate cancer, with multiple bone metastases, docetaxel combined with prednisoney 3 weeks scheme chemotherapy again,PSA reduced signifi cantly than before treatment, bone pain symptoms improved signifi cantly. Concluussiioonn Individualized comprehensive treatment strategies for high-risk patients with localized prostate cancer can delay the progress of the tumor,and improve the patient's survival quality. It is worthy of clinical attention.
combined modality therapy; prostatic neoplasms
10.3969/j.issn.1008-0848.2016.07.006
R 737.25
,E-mail: 455813506@qq.com
