铜绿假单胞菌对喹诺酮类药物耐药性探讨
2016-11-19诸琴红
诸琴红

[摘要] 目的 探讨铜绿假单胞菌对喹诺酮类药物耐药性情况。 方法 采集2014年1月~2015年2月于德清县第三人民医院住院的3000例患者痰液、脓汁标本,按常规方法分离铜绿假单胞菌,从中选择30株铜绿假单胞菌喹诺酮耐药菌株进行试验。选择铜绿假单胞菌野生型标准株作为对照。通过聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)进行gyrA、gyrB、parC和parE基因QRDR氨基酸变化结果分析。 结果 30株铜绿假单胞菌喹诺酮耐药菌株中有3株没有发生Ⅱ类拓朴异构酶基因突变,其余均发生基因突变,突变率达到90%。基因突变主要集中在gyrA编码的83位密码子、parC的80位密码子。 结论 探讨铜绿假单胞菌Ⅱ类拓扑异构酶基因突变特点,对突变株进行药物敏感试验,可以为临床合理用药提供可靠的理论依据。
[关键词] 铜绿假单胞菌;喹诺酮类药物;耐药性
[中图分类号] R378.991 [文献标识码] A [文章编号] 1673-7210(2016)02(a)-0117-04
Discuss of tolerance of Pseudomonas aeruginosa to quinolone drugs
ZHU Qinhong
Department of Laboratory, the Third People's Hospital of Deqing County, Zhejiang Province, Deqing 313201, China
[Abstract] Objective To discuss the tolerance of Pseudomonas aeruginosa to quinolone drugs. Methods The specimens of sputum and pus from 3000 cases inpatients in the Third People's Hospital of Deqing County from January 2014 to February 2015 were collected, Pseudomonas aeruginosa was separated by conventional method. 30 plants of Pseudomonas aeruginosa quinolone resistant strains were selected for experiment. The wild type standard strains of Pseudomonas aeruginosa was selected as control. The QRDR amino acid changing result of gyrA, gyrB, parC and parE genes were analyzed by PCR-RFLP. Results 3 plants had no mutation of Ⅱ type topology isomerase gene among 30 plants of Pseudomonas aeruginosa quinolone resistant strains, the other plants had gene mutation, the mutation rate was 90%. The gene mutation mainly focused on 83 codon of gyrA coding, 80 codon of parC. Conclusion Discuss of characteristics of Ⅱ type topology isomerase gene mutation, test of drug sensitive for mutant strain, can provide reliable theory basis for clinical rational drug use.
[Key words] Pseudomonas aeruginosa; Quinolone drugs; Tolerance
銅绿假单胞菌是医院感染常见的致病菌之一,在重症肺炎或者下呼吸道感染患者中检出率比较高,对于病情有不利影响[1-2]。一般情况下,铜绿假单胞菌感染治疗无效的主要原因是铜绿假单胞菌产生耐药性,如果患者出现多种耐药情况,会造成治疗难度增加。铜绿假单胞菌耐药机制比较复杂,其中包括DNA拓朴异构酶突变、主动外排系统、产生β内酰胺酶及氨基糖苷修饰酶等。一直以来喹诺酮类耐药作用的靶点主要集中在DNA拓扑异构酶Ⅱ和Ⅳ,其中DNA拓扑异构酶Ⅱ包括GyrA和GyrB两个亚基,其主要通过gyrA和gyrB基因进行编码,而DNA拓扑异构酶Ⅳ则是通过parC和parE基因进行编码。长期以来对于铜绿假单胞菌耐药性的研究比较多,但是关于铜绿假单胞菌对于喹诺酮类药物耐药性相关机制的研究却相对较少[3-4]。本研究通过对铜绿假单胞菌耐药情况进行观察,拟分析其对喹诺酮类药物耐药性的机制,尤其探讨了DNA拓扑异构酶基因突变情况,现将结果报道如下:
1 资料与方法
1.1 一般资料
2014年1月~2015年2月采集于德清县第三人民医院住院的3000例患者痰液、脓汁标本,按常规方法分离铜绿假单胞菌,从中选择30株喹诺酮耐药菌株进行试验。选择铜绿假单胞菌野生型标准株ATCC27853作为对照。
1.2 方法
1.2.1 铜绿假单胞菌DNA提取
将单一菌落在培养基中培养,离心收集菌体,采用细菌DNA提取试剂盒提取铜绿假单胞菌DNA,采用0.5%琼脂糖凝胶电泳,通过紫外灯光观察结果[5-6]。
1.2.2 PCR引物设计及DNA扩增
1.2.2.1 Ⅱ类拓朴异构酶基因片段的PCR引物设计 gyrA:gyrA1:5'-GGC CTG AAG CCG GTG CAC-3',gyrA2:5'-CAC GGC GAT ACC GCT GGA-3';gyrB:gyrB1:5'-GCG GTG GAA CAG GAG ATG GGC AAG TAC-3',gyrB2:5'-CTG GGG GAA GAA GAA GGT CAA CAG CAC GGT-3';parC:parC1:5'-CTG GAT GCC GAT TCC AAG CAC-3',parC2: 5'-GAA GGA CTT GGG ATC GTC CGG-3';parE:parE1:5'-CGG CGT TCG TCT CGG GCG TGG TGA AGG-3',parE2:5'-TCG AGG GCG TAG TAG ATG TCC TTG CCG-3'。
1.2.2.2 PCR扩增条件建立 反应体系为50 μL,5 μL 10×Ex Taq buffer+27 μL ddH2O,一对引物各3 μL,5 μL 4×DNTP,4 μL MgCl2,1 μL Taq聚合酶,2 μL铜绿假单胞菌DNA模板。扩增条件为94℃进行预变性4 min;循环参数:94℃变性4 min,72℃延伸1 min,退火,gyrA和parC退火温度为62℃,30 s,gyrB和parE退火温度为67℃,30 s,循环35次;末次循环为72℃延伸7 min。
1.2.2.3 PCR产物鉴定 选取5 μL PCR扩增后产物+1 μL缓冲液,1.5%琼脂糖凝胶电泳,90 V,電泳40 min,通过紫外成像系统进行观察。其中,gyrA基因扩增产物为418 bp片段,483 bp片段为gyrB基因扩增产物,186 bp片段为parC基因扩增产物,324 bp片段为parE基因扩增产物。
1.2.2.4 PCR扩增产物多态性测定 通过PCR扩增产物限制性片段多态性分析(PCR-RFLP)反应混合物20 μL+10×T Buffer 2 μL+2 μL 0.1%BSA+3 μL PCR扩增产物+12 μL ddH2O,37℃保温4 h,3%低熔点琼脂糖电泳,采用紫外成像系统进行观察和分析[7-8]。
1.2.3 MIC测定
将铜绿假单胞菌ATCC27853作为标准株,在M-H肉汤中接种菌株,38℃培养24 h,然后在含有不同药物浓度的M-H肉汤中接种细菌,注意调整细菌浓度为(2~5)×105 cfu/mL,将细菌没有生长的最低药物浓度作为最小抑菌浓度(MIC)。参照CLSI推荐标准,铜绿假单胞菌对抗菌药物药敏临界点设置:诺氟沙星(NOR)≤4 mg/L、环丙沙星(CIP)≤1 mg/L、左氧氟沙星(LVX)≤2 mg/L、头孢唑啉(CAZ)≤8 mg/L、氟氯西林(PIP)≤64 mg/L、亚胺培南(IMP)≤4 mg/L。
1.3 观察指标
①30株铜绿假单胞菌耐药株gyrA、gyrB、parC和parE基因喹诺酮耐药决定区(QRDR)氨基酸变化情况;②喹诺酮和β-内酰胺类抗生素对Ⅱ类拓朴异构酶基因突变株体外抗菌活性情况。
2 结果
2.1 30株铜绿假单胞菌耐药株gyrA、gyrB、parC和parE基因QRDR氨基酸变化情况
有3株铜绿假单胞菌耐药株没有发生Ⅱ类拓朴异构酶基因突变,其余均发生基因突变,突变率达到90%;基因突变主要集中在gyrA编码的83位密码子、parC的80位密码子。见表1。
表1 30株铜绿假单胞菌耐药株gyrA、gyrB、parC和parE基因QRDR氨基酸变化情况
注:Thr:苏氨酸;Asp:天冬氨酸;Ser:丝氨酸;Glu:谷氨酸;Ala:丙氨酸;Ile:异亮氨酸;Asn:天冬酰胺;Gly:甘氨酸;Phe:苯丙氨酸;Leu:亮氨酸;Lys:精氨酸;Val:缬氨酸;“-”表示没有发生基因突变
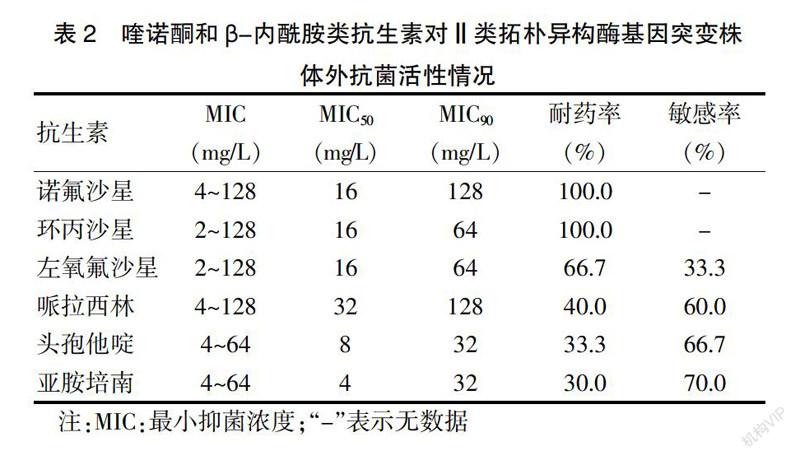
2.2 喹诺酮和β-内酰胺类抗生素对Ⅱ类拓朴异构酶基因突变株体外抗菌活性情况
诺氟沙星、环丙沙星耐药率最高,其次是左氧氟沙星,其他依次是哌拉西林、头孢他啶、亚胺培南。见表2。
表2 喹诺酮和β-内酰胺类抗生素对Ⅱ类拓朴异构酶基因突变株
体外抗菌活性情况
注:MIC:最小抑菌浓度;“-”表示无数据
3 讨论
喹诺酮类药物抗菌机制主要是对细菌DNA复制进行阻断,具有很高的选择性,安全性较好[9-10]。铜绿假单胞菌对喹诺酮类药物的耐药性与DNA拓扑异构酶Ⅱ、Ⅳ有密切关系。DNA拓扑异构酶Ⅱ分别由gyrA和gyrB基因进行编码,拓朴异构酶Ⅳ通过parC和parE基因编码[11-12]。铜绿假单胞菌gyrA基因QRDR的PCR扩增产物酶切之后可以获得141 bp和277 bp两个酶切片段[13-14]。如果铜绿假单胞菌喹诺酮类药物突变株gyrA基因第83位氨基酸密码子出现突变,酶切位点消失,不需要再被酶切,通过PCR-RFLP进行分析,突变株只有1个没有被酶切的片段。本研究结果中gyrA基因第83位氨基酸密码子出现突变株,有1个没有被酶切的片段产物,此结果和以往研究基本一致[15-16]。提示通过PCR扩增gyrA基因的QRDR,进行酶切后,可以对gyrA基因第83位氨基酸密码子点突变情况进行检测,如果发生点突变则可以证明为铜绿假单胞菌喹诺酮类耐药株。
本研究还对铜绿假单胞菌喹诺酮类药物耐药株Ⅱ类拓朴异构酶gyrA、gyrB、parC和parE基因QRDR基因片段进行分析,在耐药株中,绝大部分的Ⅱ类拓扑异构基因QRDR发生突变,其突变主要集中在gyrA基因和parC基因中,其中,gyrA基因编码第83位氨基酸密码子,出现高频率的基因突变,Thr-83变为Ile,即ACC变为ATC,但是第87位氨基酸密码子和第83位氨基酸密码子发生双突变的频率较低[17-18]。说明铜绿假单胞菌喹诺酮类药物耐药主要与gyrA中的第83位氨基酸密码子发生变异有关。本研究采集3000例住院患者的痰液、脓汁标本,按常规方法分离铜绿假单胞菌,从中选择30株喹诺酮耐药菌株进行试验。选择铜绿假单胞菌野生型标准株ATCC27853作为对照。通过PCR-RFLP进行分析,结果表明,有3株铜绿假单胞菌耐药株没有发生Ⅱ类拓朴异构酶基因突变,其余均发生率基因突变,突变率达到90%,此结果和以往研究基本一致[17-18];基因突变主要集中在gyrA编码的83位密码子、parC的80位密码子,提示gyrA和parC基因突变是铜绿假单胞菌对于喹诺酮类药物耐药的主要机制。有资料显示,铜绿假单胞菌Ⅱ类拓朴异构酶二级结构和疏水性发生变化可能是引起耐药的物质基础。铜绿假单胞菌Ⅱ类拓朴异构酶基因发生两个或者两个以上突变株对于绝大多数喹诺酮类药物呈现较高水平的耐药性[19-20]。本研究中耐药变异株对诺氟沙星、环丙沙星100%耐药,耐药率均高于左氧氟沙星、哌拉西林、头孢他啶、亚胺培南,提示诺氟沙星、环丙沙星的大量应用可能是临床上引起喹诺酮类药物耐药的因素之一。通过上述研究进一步表明,铜绿假单胞菌变异株对于喹诺酮类耐药是由于DNA拓扑异构酶的作用靶点发生不同程度的变化,其中主要为编码DNA拓朴异构酶Ⅱ的gyrA基因和编码DNA拓朴异构酶Ⅳ中的parC基因的耐药决定区发生基因突变,促使喹诺酮类药物和铜绿假单胞菌无法正常结合,从而影响了药物的作用效果,造成耐药性的形成。另外,临床上大量应用敏感度不高的药物也增加了铜绿假单胞菌耐药性的发生率。
综上所述,探讨铜绿假单胞菌Ⅱ类拓扑异构酶基因突变特点,对突变株进行药物敏感试验,可以为临床合理用药提供可靠的理论依据。
[参考文献]
[1] 明德松,邓勇.国内铜绿假单胞菌对喹诺酮类药物耐药机制的Meta分析[J].中国循证医学杂志,2013,13(10):1215-1218.
[2] Lee JK,Lee YS,Park YK,et al. Alterations in the GyrA and GyrB subunits of topoisomerase and the ParC and ParE subunits of topoisomerase in cipro oxacinresistant clinical isolates of pseudomonas aeruginosa [J]. Int J Antimicrob Agents,2005,25(4):290-295.
[3] 张国栋,曾章锐,王莹,等.gyrA、gyrB和外排系统共同介导铜绿假单胞菌对喹诺酮类耐药机制研究[J].中国感染与化疗杂志,2014,14(3):224-227.
[4] Murugan K,Selvanayaki K,Al-Sohaibani S. Antibiofilm activity of Andrographis paniculata against cystic fibrosis clinical isolate Pseudomonas aeruginosa [J]. World Journal of Microbiology and Biotechnology,2011,27(7):1661-1668.
[5] 白羽,刘金辉,李清祥,等.铜绿假单胞菌对喹诺酮类药物耐药机制的研究[J].中国病原生物学杂志,2014,9(11):1036-1040.
[6] Krishnan T,Yin WF,Chan KG. Inhibition of Quorum Sensing-Controlled Virulence Factor Production in Pseudomonas aeruginosa PAOl by Ayurveda Spice Clove(Syzygium Aromaticum)Bud Extract [J]. Sensors,2012,12(4):4016-4030.
[7] 陈树林,陈利达,陈茶,等.铜绿假单胞菌对喹诺酮类药物耐药的分子机制研究[J].中国卫生检验杂志,2012,22(4):899-903.
[8] Yang L,Rybtke MT,Jakobsen TH,et al. Computer-aided identification of recognized drugs as Pseudomonas aeruginosa quorum-sensing inhibitors [J]. Antimicrobial Agents and Chemotherapy,2009,53(6):2432-2443.
[9] 劉文广,戴路明.铜绿假单胞菌对喹诺酮类抗菌药物的耐药机制[J].医学综述,2012,18(11):1650-1652.
[10] Femandez-Pifiar R,Camara M,Dubern JF,et al. The Pseudomonas aeruginosa quinolone quorum sensing signal alters the multicellular behaviour of Pseudomonas putida KT2440 [J]. Research in Microbiology,2011,162(8):773-781.
[11] 揣国帅,刘新,王岚,等.铜绿假单胞菌生物膜对喹诺酮类抗生素耐药作用研究[J].中国病原生物学杂志,2012, 7(9):672-674.
[12] Petrova OE,Sauer K,Sag S. Contributes to the motile-sessile switch and acts in concert with BfiSR to enable Pseudomonas aeruginosa biofilm formation [J]. Journal of Bacteriology,2011,193(23):6614-6628.
[13] 蒋月婷,黄松音,吴爱武,等.耐喹诺酮类铜绿假单胞菌的耐药机制研究[J].热带医学杂志,2010,10(7):781-783.
[14] Baer M,Sawa T,Flynn P,et al. An engineered human antibody fab fragment specific for Pseudomonas aeruginosa PcrV antigen has potent antibacterial activity [J]. Infection and Immunity,2009,77(3):1083-1090.
[15] 李梅,潘发愤,周铁丽,等.多药耐药铜绿假单胞菌感染的危险因素分析[J].中华医院感染学杂志,2011,21(8):1593-1595.
[16] Tashiro Y,Ichikawa S,Nakajima-Kambe T,et al. Pseudomonas quinolone signal affects membrane vesicle production in not only Gram-negative but also Gram-positive bacteria [J]. Microbes and Environments,2008,25(2):120-125.
[17] 史天陆,苏丹,王法财,等.临床药师参与胆道术后伴发多药耐药铜绿假单胞菌感染的药学监护[J].中华医院感染学杂志,2012,22(10):2177-2179.
[18] Yu S,Jensen V,Seeliger J,et al. Structure elucidation and preliminary assessment of hydrolase activity of PqsE,the Pseudomonas quinolone signal(PQS)response protein [J]. Biochemistry,2009,48(43):10298-10307.
[19] 孙茜,王鹏华,褚月颉,等.铜绿假单胞菌感染的糖尿病足患者临床及耐药特点分析[J].中华内分泌代谢杂志,2012,28(10):817-820.
[20] D'Argenio DA,Wu M,Hoffman LR,et al. Growth phenotypes of Pseudomonas aeruginosa lasR mutants adapted to the airways of cystic fibrosis patients [J]. Molecular Microbiology,2007,64(2):512-533.
(收稿日期:2015-11-05 本文编辑:程 铭)
