葡萄糖转运蛋白1、血管内皮生长因子及增殖细胞
2016-11-19张欣吴立平康保洁
张欣 吴立平 康保洁
[摘要] 目的 探討葡萄糖转运蛋白1(Glut1)、血管内皮生长因子(VEGF)与增殖细胞核抗原(PCNA)在非小细胞肺癌(NSCLC)中的表达和相关性。 方法 研究标本取自潍坊市人民医院胸外科2013年8月~2015年6月期间住院行肺部手术的患者113例,其中93例NSCLC组织作为实验组,20例肺部良性病变组织作为对照组,采用免疫组化法检测Glut1、VEGF及PCNA在NSCLC组织和肺部良性病变组织中的表达,并分析其与NSCLC临床病理学参数间的关系及三者间的相关性。 结果 实验组中Glut1、VEGF阳性率及PCNA标记指数(PCNA-LI)分别为89.25%(83/93)、80.65%(75/93)和(67.65±26.11)%,均高于对照组[15.00%(3/20)、25.00%(5/20)和(25.25±9.34)%],差异均有高度统计学意义(P < 0.01)。Glut1表达与病理类型、TNM分期、淋巴结转移有关(P < 0.05)。VEGF表达与TNM分期、淋巴结转移有关(P < 0.05)。PCNA表达与淋巴结转移有关(P < 0.05)。Glut1与VEGF表达呈正相关(r = 0.312,P < 0.01)。Glut1、VEGF的表达与PCNA均呈正相关(r = 0.306,P < 0.01;r = 0.415,P < 0.01)。 结论 Glut1、VEGF及PCNA与NSCLC的发生、发展密切相关,联合检测三者有助于判断NSCLC的预后。
[关键词] 非小细胞肺癌;葡萄糖转运蛋白1;血管内皮生长因子;增殖细胞核抗原
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2016)02(a)-0073-04
Expression and its correlation of Glut1, VEGF and PCNA in non-small cell lung cancer
ZHANG Xin1 WU Liping2 KANG Baojie1
1.Weifang Medical University, Shandong Province, Weifang 261053, China; 2.Department of Respiratory Medicine, Weifang People's Hospital, Shandong Province, Weifang 261041, China
[Abstract] Objective To investigate the expression and its correlation of glucose transporter 1 (Glut1), vascular endothelial growth factor (VEGF) and proliferating cell nuclear antigen (PCNA) in non-small cell lung cancer (NSCLC). Methods The samples in this study were obtained from 113 cases of patients taking chest surgery hospitalized in Weifang People's Hospital from August 2013 to June 2015, among whom, 93 cases of NSCLC tissues were taken as experimental group and 20 cases of benign lesion lung tissues were taken as control group. Expression of Glut1, VEGF and PCNA in NSCLC tissues and benign lesion lung tissues was detected by immunohistochemistry, and the relationship of their expression with the clinical pathological parameters of NSCLC and their correlation were analyzed. Results The positive rate of Glut1, VEGF and PCNA labeling index (PCNA-LI) in the experimental group was 89.25% (83/93), 80.65% (75/93) and (67.65±26.11)% respectively, which were higher than those of control group [15.00% (3/20), 25.00% (5/20) and (25.25±9.34)%], the differences were all highly statistically significant (P < 0.01). The expression of Glut1 was correlated with pathological types, TNM stage and lymph node metastasis (P < 0.05). The expression of VEGF was correlated with TNM stage and lymph node metastasis (P < 0.05). The expression of PCNA was correlated with lymph node metastasis (P < 0.05). There was a positive correlation between Glut1 and VEGF expression (r = 0.312, P < 0.01), and the expressions of Glut1, VEGF with PCNA both showed positive correlation (r = 0.306, P < 0.01; r = 0.415, P < 0.01). Conclusion The positive expressions of Glut1, VEGF and PCNA in NSCLC may play an important role in the occurrence and development of NSCLC. Combined detection of the three indicators will help to estimate the prognosis of NSCLC.
[Key words] Non-small cell lung cancer; Glucose transporter1; Vascular endothelial growth factor; Proliferating cell nuclear antigen
肺癌发病率及死亡率均居全球恶性肿瘤首位,尽管诊断、手术、放化疗等已取得一定成效,但肺癌尤其是非小细胞肺癌(NSCLC)的治疗效果及预后较差,而恶性肿瘤治疗失败的重要原因为侵袭和转移。葡萄糖转运蛋白1(Glut1)为葡萄糖跨膜转运的主要载体,对细胞能量代谢起着关键性作用。血管内皮生长因子(VEGF)为恶性肿瘤血管生成中重要的调节因子。它在肿瘤的生长、侵袭和转移过程中起关键作用,是近年的研究热点[1]。增殖细胞核抗原(PCNA)是DNA多聚酶σ的辅助蛋白,其合成与DNA复制和细胞增殖直接相关[2]。本研究应用免疫组织化学染色法检测NSCLC组织中Glut1、VEGF和PCNA蛋白的表达水平,探讨三者在NSCLC发生、发展中的作用及其相关性。
1 资料与方法
1.1 一般资料
选取潍坊医学院附属潍坊市人民医院(以下简称“我院”)胸外科2013年8月~2015年6月行肺段叶切除手术的原发性NSCLC患者93例的组织标本作为实验组,所有患者在接受手术之前均未行放疗、化疗等相关治疗。实验组中男54例,女39例;年龄35~76岁,平均(58.84±8.02)岁;组织类型:肺鳞癌32例,肺腺癌61例;按1997年UICC修订的标准[3]进行TNM分期:Ⅰ期49例,Ⅱ期17例,Ⅲ期20例,Ⅳ期7例;组织学分化程度:高分化29例,中分化42例,低分化22例;有淋巴结转移者46例,无淋巴结转移者47例;有吸烟史42例,无吸烟史51例。对照组选取我院同期肺良性病变组织20例,其中包括11例炎性病变,5例肺大疱,4例肺结核。实验中采用的NSCLC及良性病变组织标本均经病理切片证实。本研究所入选的患者均已知情同意并签署知情同意书,医院伦理委员会均通过。
1.2 主要试剂及方法
兔抗人Glut1多克隆抗体、鼠抗人PCNA单克隆抗体、兔抗人VEGF单克隆抗体购自北京中杉金桥生物有限公司。所有标本均由中性甲醛固定,采用免疫组化SP法、石蜡包埋组织经切片,微波行抗原修复,其余均按照试剂盒说明严格执行,采用PBS液代替一抗来作为阴性对照,用已知阳性的癌组织作阳性对照。
1.3 评定标准
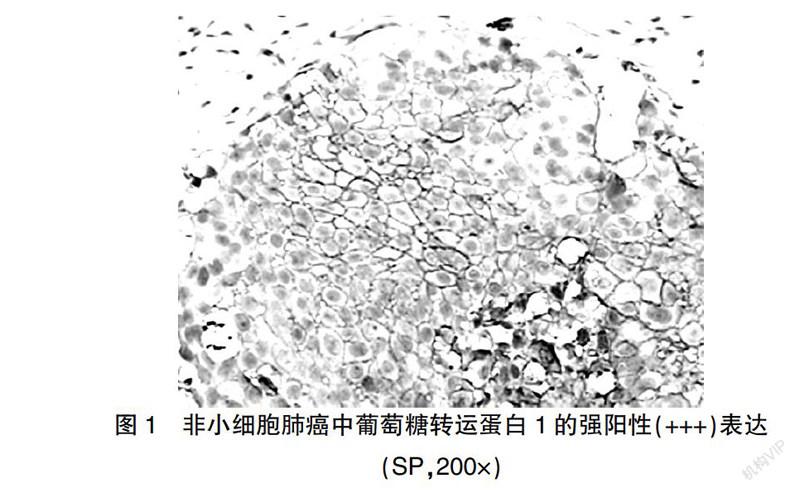
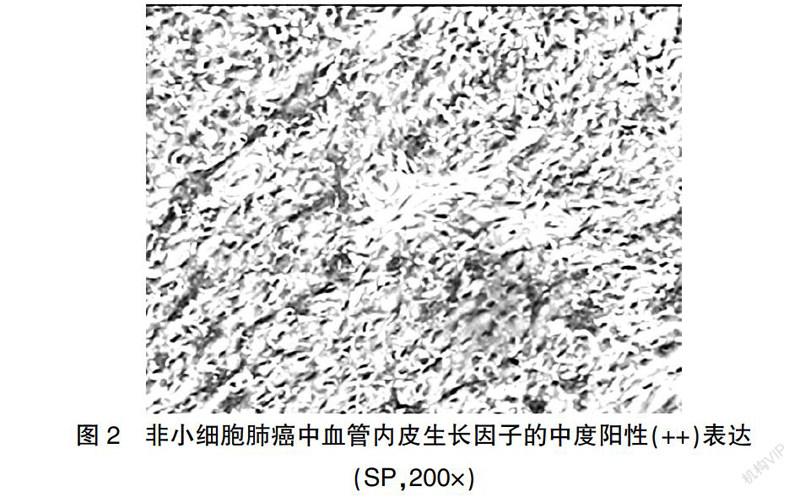
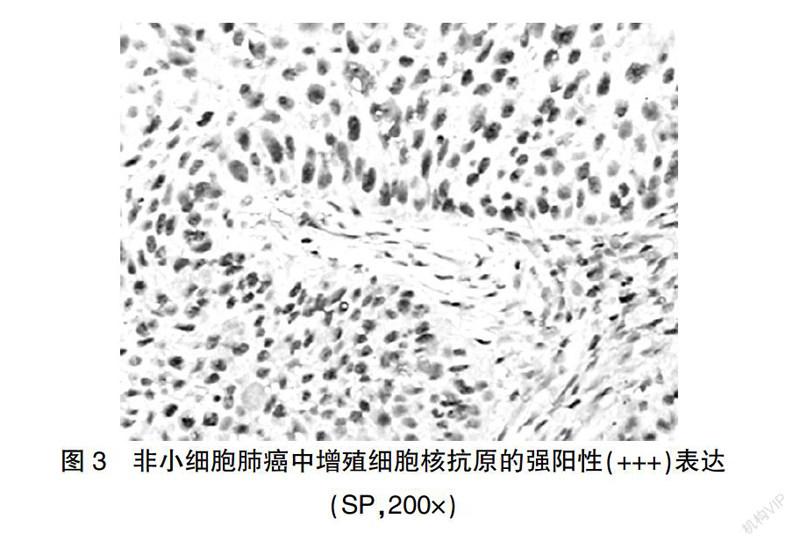
参考Cooper等[4]报道的评判标准,将胞质和/或胞膜染为棕黄色的细胞定义为Glut1阳性細胞,在高倍镜(×400)下随机选择5个视野,计算每张切片阳性细胞百分率,无癌细胞染色为阴性(-),<10%癌细胞染色为弱阳性(+),10%~50%癌细胞染色为中度阳性(++),>50%癌细胞染色为强阳性(+++)。VEGF参考Ye等[5]报道的判断标准,胞质染为棕黄色即为VEGF阳性细胞,在400倍镜下随机选5个视野各计数200个肿瘤细胞,计算阳性细胞百分率,标本中无癌细胞染色即为(-),1%~<25%癌细胞染色即为(+),25%~50%癌细胞染色即为(++),>50%癌细胞染色即为(+++)。将细胞核内出现棕黄色颗粒定义为PCNA阳性细胞,每张切片观察5个高倍(400×)视野,各计数100个肿瘤细胞,计算PCNA阳性细胞百分率,将其定义为PCNA标记指数(PCNA-LI);其中阳性细胞所占百分比<50%定义为低表达,≥50%定义为高表达。
1.4 统计学方法
采用SPSS 17.0统计软件,其中计量资料以均数±标准差(x±s)表示,采用t检验,率的比较采用χ2检验,采用Pearson等级相关分析进行相关性检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 Glut1、VEGF和PCNA在NSCLC组织中的表达
实验组中Glut1、VEGF阳性率及PCNA-LI分别为89.25%(83/93)、80.65%(75/93)和(67.65±26.11)%,均高于对照组[15.00%(3/20)、25.00%(5/20)和(25.25±9.34)%],差异均有高度统计学意义(P < 0.01)(图1~3)。
2.2 Glut1、VEGF和PCNA与临床病理因素间的关系
Glut1在NSCLC组织中的表达与TNM分期、淋巴结转移及病理类型有关(P < 0.05),而与患者的性别、年龄、肿瘤分化程度、吸烟无关(P > 0.05)。VEGF表达与TNM分期、淋巴结转移有关(P < 0.05),而在不同年龄、性别、组织分化程度、肿瘤病理类型及是否有吸烟史方面差异无统计学意义(P > 0.05)。淋巴结转移者PCNA的阳性表达率高于无淋巴结转移者(P < 0.05),而与其他因素无关。见表1。
2.3 Glut 1、VEGF、PCNA表达的相关性
NSCLC组织中,通过Pearson等级相关分析,Glut1与VEGF表达呈正相关(r = 0.312,P < 0.01)。见表2。Glut1、VEGF的表达与PCNA 均呈正相关(r = 0.306,P < 0.01;r = 0.415,P < 0.01)。见表3。
3 讨论
恶性肿瘤细胞主要特点是增殖迅速,其耗氧量不断增加导致供能和耗能之间不平衡,因此细胞对氧和营养的过度消耗导致肿瘤低氧、低糖的微环境,为适应此微环境,通过增加葡萄糖摄取来获取能量,Glut1是葡萄糖跨膜转运最重要的载体,它同恶性肿瘤的进展有直接的相关性。本研究结果显示,实验组中Glut1的阳性表达率显著高于对照组,且淋巴结转移者中Glut1的阳性表达明显高于无转移者,中晚期的表达高于早期者,这与Noguchi等[6]实验结果相符。另外一些研究也发现,Glut1同恶性肿瘤的TNM分期以及淋巴结转移有关,因此可用于判断恶性肿瘤的预后[7]。在NSCLC组织中,鳞癌Glut1的阳性表达明显高于腺癌,且鳞癌在肿瘤的癌巢中央染色较深。这与Meijer等[8]研究的结果相符,其研究表明,鳞癌相较于腺癌能更多地表达Glut1,这可能同鳞癌多以巢状生长有关,其中央的血供较差,为满足其快速增殖的能量供应,继发葡萄糖转运增多,其与病理类型的相关性机制尚需进一步研究。Glut1对肺癌摄取葡萄糖起着重要作用,而正常组织及肿瘤组织对葡萄糖的摄取存在差异,由此推断高表达Glut1可能是肿瘤早期诊断和恶化进展的重要指标,并提示肿瘤具有侵袭性和不良的预后。
实体肿瘤生长和转移的前提是血管生长,它在实体肿瘤的发生、发展中起重要的作用[9]。肺癌相较于其他恶性肿瘤更易发生远处转移,其可能的原因是肺组织毛细血管比其他的组织更为丰富[10]。VEGF是最主要的血管生长促进因子之一,可促使新生血管的生長和延伸,从而促进肿瘤的生长与转移。本研究结果显示,VEGF在实验组中的阳性表达率明显高于对照组,另外还发现,有淋巴结转移的VEGF阳性表达率高于无淋巴结转移者,中晚期的VEGF阳性表达率高于早期者(P < 0.05)。因此可推测VEGF在肺癌的发生、发展过程中起到了关键作用,并且同肺癌的恶性程度有关,提示该因子有可能作为评估肺癌患者预后的指标。
PCNA是细胞增殖合成DNA所必需的核蛋白,与DNA的复制以及细胞增殖密切相关[11],检测它在细胞中的表达,可作为评价细胞增殖状态的一个指标。本研究结果显示,实验组PCNA的表达高于对照组,且有淋巴结转移者表达高于无转移者(P < 0.05),提示高表达PCNA与肺癌发生及生物学行为有关,同时可作为判断肺癌预后的重要指标。
肿瘤的发生、发展是一个多基因调控和多步骤发展的过程。本研究发现,NSCLC组织中,Glut1、VEGF和PCNA均为高表达,且Glut1与VEGF的表达呈正相关,可能是因为恶性肿瘤的快速增殖导致其血液供应不能满足能量需求,促使肿瘤释放出特异性血管形成因子(如VEGF),因而促进了GLUT1的高表达。VEGF、Glut1的表达均与PCNA呈正相关,推测Glut1及VEGF高表达可能跟NSCLC增殖活动有关,但是对于它们促进肿瘤细胞增殖的具体机制尚不完全清楚,仍需进一步研究。
Glut1、VEGF及PCNA在NSCLC的发生、发展过程中起重要作用,三者联合检测可作为评价NSCLC生物学行为及其预后的重要生物学指标,为其早期诊断及预防提供重要参考依据,具有一定的临床应用价值。
[参考文献]
[1] Funakoshi T,Lee CH,Hsieh JJ. A systematic review of predictive and prognostic biomarkers for VEGF-targeted therapy in renal cell carcinoma [J]. Cancer Treat Rev,2014,40(4):533-547.
[2] Bravo R,Frank R,Blundell PA,et al. Cylin /PCNA is the auxiliary protein of DNA polymerase-delta [J]. Nature,1987,326(6112):515-517.
[3] Sobin LH,Wittekind C. UICC TNM classification of malignant tumours [M]. 5th. New York:Wiley Liss,1997:93-97.
[4] Cooper R,Sarioglu S,Sokmen S,et al. Glucose transporter-1(GLUT-1):a potential marker of prognosis in rectal carcinoma [J]. Br Cancer,2003,89(5):870-876.
[5] Ye X,Lu D. HER-2 and VEGF expression in breast cancer and their correlations [J]. Chinese-German J Clin Oncol,2010,9(4):208-212.
[6] Noguchi Y,Saito A,Miyagi Y,et al. Suppression of facilitative glucose transporter 1 mRNA can suppress tumor growth [J]. Cancer Lett,2000,154(2):175-182.
[7] Lidgren A,Bergh A,Grankvist K,et al. Glucose transporter-1 expression in renal cell carcinoma and its correlation with hypoxia inducible factor-1 alpha [J]. BJU Int,2008,1(4):480-484.
[8] Meijer TW,Schuurbiers OC,Kaanders JH,et al. Differences in metabolism between adeno-and squamous cell non-small cell lung carcinomas:spatial distribution and prognostic value of GLUT1 and MCT4 [J]. Lung Cancer,2012, 76(3):316-323.
[9] Shang L,Zhao J,Wang W,et al. Inhibitory effect of endostar on lymphangiogenesis in non-small cell lung cancer and its effect on circulating tumor cells [J]. Chinese Journal of Lung Cancer,2014,20(10):722-729.
[10] 钱玥,邹萍.血管内皮生长因子在非小细胞肺癌患者诊断中的应用价值[J].当代医学,2014,20(12):8-9.
[11] Dieckman LM,Freudenthal BD,Washington MT. PCNA structure and function:insights from structures of PCNA complexes and post-translationally modified PCNA [J]. Subcell Biochem,2012,62(3):281-299.
(收稿日期:2015-10-22 本文编辑:张瑜杰)
