新型吡唑酰腙类化合物的合成及其生物活性
2016-11-19王玉申龚华玉吴小琼王晓斌
谢 艳, 王玉申, 龚华玉, 吴小琼, 王晓斌, 肖 维, 汪 华, 薛 伟*
(1. 贵州大学 绿色农药与农业生物工程国家重点实验室培育基地,贵州 贵阳 550025;2. 山东昌邑家园化工有限公司,山东 昌邑 261303; 3. 安顺职业技术学院,贵州 安顺 561000;4. 湖北省农业科学院 植保土肥所,湖北 武汉 430064)
·研究论文·
新型吡唑酰腙类化合物的合成及其生物活性
谢 艳1, 王玉申2, 龚华玉1, 吴小琼3, 王晓斌1, 肖 维1, 汪 华4, 薛 伟1*
(1. 贵州大学 绿色农药与农业生物工程国家重点实验室培育基地,贵州 贵阳 550025;2. 山东昌邑家园化工有限公司,山东 昌邑 261303; 3. 安顺职业技术学院,贵州 安顺 561000;4. 湖北省农业科学院 植保土肥所,湖北 武汉 430064)
以取代肼和取代乙酰乙酸乙酯为起始原料,依次经闭环、氯酰化、氧化、酯化及取代反应制得1,3-取代-5-氯-4-吡唑甲酰肼(7a, 7d, 7g和7j); 7分别与取代呋喃或噻吩甲醛经加成反应合成了12个新型的吡唑酰腙类化合物(9a~9l),其结构经1H NMR,13C NMR, IR和元素分析表征。初步的生物活性测试结果表明:在500 μg·mL-1浓度下,部分化合物对烟草花叶病毒(TMV)具有一定的抑制活性,其中1-苯基-3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9k)的治疗活性、保护活性和钝化活性分别为63.6%, 85.7%和93.1%,与对照药宁南霉素(65.9%, 86.4%和97.8%)相当;在50 μg·mL-1浓度下,部分化合物表现出一定的抑菌活性,其中1,3-二甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9b)与1-甲基3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9e)对小麦赤霉病菌(Gibberellazeae)的抑制率分别为42.5%和46.8%。
肼; 乙酰乙酸乙酯; 吡唑; 酰腙; 合成; 生物活性
吡唑类化合物是重要的含氮杂环化合物,其结构中含有4个不同的取代位点以及不同的取代基,赋予了吡唑类化合物生物活性多样性的特点,使其在农药研究领域占有重要地位。如吡唑类杀菌剂:吡唑醚菌酯和吡唑酰胺类的呋吡菌胺与吡噻菌胺,吡唑类杀虫杀螨剂:氟虫腈、vaniliprole和乙虫清,吡唑类除草剂:吡嘧磺隆、氯吡嘧磺隆和唑嘧磺隆[1-4]。酰腙基团是一类优秀生物活性的schiff碱,具有强配位能力,可用于杀菌、抗病毒等方面。
2010年,邹敏等[5]合成了吡唑啉酮类衍生物,生物活性测试表明:当浓度为0.01%时,化合物对大肠杆菌的抑制率达100%。2011年高元磊等[6]合成了吡唑酰腙类化合物,进一步的生物活性研究表明,在50 μg·mL-1浓度下,当R基团为对氟苯基时,化合物对苹果腐烂菌和小麦赤霉菌的抑制率分别为48.9%和54.2%,与对照药剂噁霉灵抑制活性相当。当R基团为2,3-二氯苯基时,化合物对小麦赤霉菌的抑制率为62.9%,优于对照药剂恶霉灵。
为了寻找高效、低毒的农药,由高活性的吡唑商品化农药杀菌剂品种中找到先导化合物,进行分子设计。本文根据活性基团拼接原理,以取代肼和取代乙酰乙酸乙酯为起始原料,依次经闭环、氯酰化、氧化、酯化及取代反应制得1,3-取代-5-氯-4-吡唑甲酰肼(7a, 7d, 7g和7j); 7分别与取代呋喃或噻吩甲醛经加成反应合成了12个新型的吡唑酰腙类化合物(9a~9l, Scheme 1),其结构经1H NMR,13C NMR, IR和元素分析表征。并对其初步的生物活性进行了测试。
1 实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪;QY-20型三用紫外分析仪;JEOL-ECX500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);SHIMADZU IRprestige-21型傅立叶红外光谱仪(KBr压片);Elementar Vario III型元素分析仪。
3~5参考文献[7]方法合成;其余所用试剂均为分析纯或化学纯。

Scheme 1
1.2 合成
(1) 7a, 7d, 7g和7j的合成通法
在三口瓶中加入1,3-取代-5-氯-4-吡唑酸(5a, 5d, 5g和5j)0.1 mol,搅拌下缓慢滴加重蒸的SOCl210 mL,冰浴冷却下反应10 min;加入干燥甲醇25 mL,回流反应8 h。减压蒸出溶剂,加少量水,用10%NaOH溶液调至中性,抽滤,滤饼干燥得白色固体1,3-取代-5-氯-4-吡唑甲酸甲酯(6a, 6d, 6g和6j)。
在三口瓶中依次加入6 0.05 mol, 80%水合肼30 mL,搅拌下回流反应20 h(TLC监测)。冷却结晶得白色固体7a, 7d, 7g和7j。
(2) 9a~9j的合成通法
在三口瓶中加入7 1 mmol,用无水乙醇10 mL溶解,加入取代呋喃或噻吩甲醛1.2 mmol,搅拌下回流反应10 min;加入冰醋酸2 mmol,回流反应2 h。减压浓缩,残余物用无水乙醇重结晶得9a~9j。
1,3-二甲基-5-氯-4-(2-呋喃)-腙基羰基吡唑(9a): 黄色粉末, 产率91%, m.p.188~189 ℃;1H NMRδ: 8.19(s, 1H, CH=N), 7.84(d,J=5.15 Hz, 1H, O—CH=C), 6.91(d,J=3.45 Hz, 1H, C—CH=C), 6.63(dd,J=3.45 Hz, 3.45 Hz, 1H, C—CH=C), 3.77(s, 3H, NCH3), 2.26(s, 3H, CCH3);13C NMR(125 MHz)δ: 158.5, 147.8, 142.8, 139.4, 131.5, 129.5, 128.3, 127.3, 112.6, 36.5, 13.6; IRν: 3 211, 3 062, 2 929, 1 365, 1 298, 1 263, 1 064, 906, 760 cm-1; Anal. calcd for C11H11N4O2Cl: C 49.54, H 4.16, N 21.01; found C 49.47, H 4.18, N 21.04。
1,3-二甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9b): 白色粉末,产率94%, m.p.153~155 ℃;1H NMRδ: 8.51(s, 1H, CH=N), 7.68(d,J=5.15 Hz, 1H, S—CH=C), 7.45(d,J=3.45 Hz, 1H, C—CH=C), 7.13(t,J=8.60 Hz, 1H, C—CH=C), 3.78(s, 3H, NCH3), 2.27(s, 3H, CCH3);13C NMRδ: 157.8, 153.0, 137.3, 133.4, 130.2, 129.9, 126.4, 126.2, 108.6, 37.0, 15.0; IRν: 3 223, 3 097, 2 945, 1 263, 1 143, 956, 910, 717 cm-1; Anal. calcd for C11H11N4OSCl: C 46.73, H 3.92, N 19.82; found C 46.76, H 3.84, N 19.86。
1,3-二甲基-5-氯-4-(2-(3-甲基)噻吩)-腙基羰基吡唑(9c): 棕色粉末,产率94%, m.p.208~210 ℃;1H NMRδ: 8.58(s, 1H, CH=N), 7.56(d,J=5.15 Hz, 1H, S—CH=C), 6.96(d,J=5.15 Hz, 1H, C—CH=C), 3.77(s, 3H, NCH3), 2.30(s, 3H, N=C—CH3), 2.27(s, 3H, CCH3);13C NMRδ: 158.3, 147.8, 141.9, 140.5, 132.8, 127.2, 112.5, 127.3, 112.6, 36.5, 14.1, 13.6; IRν: 3 217, 3 099, 2 964, 2 470, 1 770, 1 146, 908, 727 cm-1. Anal. calcd for C11H13N4OSCl: C 48.56, H 4.42, N 18.88; found C 48.52, H 4.46, N 18.82。
1-甲基-3-三氟甲基-5-氯-4-(2-呋喃)-腙基羰基吡唑(9d): 白色固体,产率96%, m.p.176~178 ℃;1H NMRδ: 8.23(s, 1H, CH=N), 7.54(d,J=5.15 Hz, 1H, O—CH=C), 7.20(d,J=3.45 Hz, 1H, C—CH=C), 7.08(t,J=8.60 Hz, 1H, C—CH=C), 3.79(s, 3H, NCH3);13C NMRδ: 161.7, 143.8, 140.0, 137.4, 137.0, 131.3, 128.2, 127.7, 120.4, 112.1, 37.7; IRν: 3 309, 3 211, 3 084, 2 949, 1 433, 1 240, 958, 875, 704 cm-1; Anal. calcd for C11H8N4O2F3Cl: C 41.20, H 2.51, N 17.47; found C 41.29, H 2.61, N 17.97。
1-甲基-3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9e): 黄色固体,产率94%, m.p.187~188 ℃;1H NMRδ: 8.23(s, 1H, CH=N), 7.54(d,J=5.15 Hz, 1H, O—CH=C), 7.20(d,J=5.15 Hz, 1H, C—CH=C), 7.08(t,J=8.60 Hz, 1H, C—CH=C), 3.79(s, 3H, NCH3);13C NMRδ: 161.7, 143.9, 140.0, 137.5, 137.2, 128.9, 128.2, 127.8, 122.6, 120.4, 37.7; IRν: 3 319, 3 278, 2 673, 2 563, 2 283, 1 789, 1 643, 1 514, 702 cm-1; Anal. calcd for C11H8N4OSF3Cl: C 39.24, H 2.39, N 16.64; found C 39.34, H 2.56, N 16.24。
1-甲基-3-三氟甲基-5-氯-4-(2-(3-甲基)噻吩)-腙基羰基吡唑(9f): 白色粉末,产率93%, m.p.212~214 ℃;1H NMRδ: 8.30(s, 1H, CH=N), 7.44(d,J=5.15 Hz, 1H, S—CH=C), 6.93(d,J=5.15 Hz, 1H, C—CH=C), 3.80(s, 3H, NCH3), 2.28 (s, 3H, CH3);13C NMRδ: 161.7, 144.2, 140.0, 137.5, 137.0, 133.3, 131.2, 126.9, 122.6, 120.5, 37.8, 14.0; IRν: 3 313, 3 213, 2 565, 1 621, 1 579, 1 516, 1 155, 1 112 cm-1; Anal. calcd for C12H10N4OSF3Cl: C 41.09, H 2.87, N 15.97; found C 41.11, H 2.85, N 16.07。
1-苯基-3-甲基-5-氯-4-(2-呋喃)-腙基羰基吡唑(9g): 黄色粉末,产率95%, m.p. 159~161 ℃;1H NMRδ: 8.27(s, 1H, CH=N), 7.84(d,J=5.15 Hz, 1H, O—CH=C), 7.44~7.43(m, 4H, PhH), 7.34~7.32(m, 1H, PhH), 6.91(d,J=5.15 Hz, 1H, C—CH=C), 6.63(dd,J=3.45 Hz, 3.45 Hz, 1H, C—CH=C), 2.33(s, 3H, N=CCH3);13C NMRδ: 164.7, 147.1, 145.0, 140.2, 137.7 137.1, 133.3, 131.0, 129.1, 127.6, 126.8, 125.1, 120.4, 13.9; IRν: 3 387, 1 556, 1 541, 1 510, 1 165, 1 155, 746 cm-1; Anal. calcd for C16H13N4O2Cl: C 58.45, H 3.99, N 17.04; found: C 58.20, H 4.04, N 17.14。
1-苯基-3-甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9h): 黄色粉末,产率92%, m.p.183~185 ℃;1H NMRδ: 8.12(s, 1H, CH=N), 7.59(d,J=5.15 Hz, 1H, S—CH=C), 7.44~7.34(m, 4H, PhH), 7.33(m, 1H, PhH), 7.07(d,J=5.15 Hz, 1H, S—C=CH), 6.93(dd,J=3.45 Hz, 3.45 Hz, 1H, C—CH=C), 2.29(s, 3H, N=CCH3);13C NMRδ:164.7, 147.1, 145.0, 140.2, 137.7, 137.1, 133.8, 131.0, 129.1, 127.6, 126.8, 125.1, 119.8, 13.9; IRν: 3 346, 3 319, 1 811, 1 593, 1 537, 1 489, 1 363, 850, 785 cm-1; Anal. calcd for C16H13N4OSCl: C 55.73, H 3.80, N 16.25; found C 55.43, H 3.60, N 16.35。
1-苯基-3-甲基-5-氯-4-(2-(3-甲基)噻吩)-腙基羰基吡唑(9i): 黄色粉末,产率94%, m.p.198~199 ℃;1H NMRδ: 8.27(s, 1H, CH=N), 7.45~7.41(m, 4H, PhH), 7.35~7.32(m, 1H, PhH), 7.30(d,J=5.15 Hz, 1H, S—CH=C), 6.81(d,J=5.15 Hz, 1H, C—CH=C), 2.33(s, 3H, N=C—CH3), 2.17(s, 3H, CH3);13C NMRδ: 164.7, 147.1, 145.0, 140.2, 137.7, 137.1, 133.7, 131.0, 129.1, 127.6, 126.8, 125.1, 119.7, 14.5, 13.9; IRν: 3 161, 3 103, 3 072, 2 933, 1 734, 1 627, 1 593, 1 533, 1 519, 1 138 cm-1; Anal. calcd for C17H15N4OSCl: C 56.90, H 4.21, N 15.61; found C 56.20, H 4.91, N 15.41。
1-苯基-3-三氟甲基-5-氯-4-(2-呋喃)-腙基羰基吡唑(9j): 白色粉末,产率98%, m.p. 215~217 ℃;1H NMRδ: 8.08(s, 1H, CH=N), 7.71(d,J=5.15 Hz, 1H, O—CH=C), 7.59~7.56(m, 4H, PhH), 7.54~7.51(m, 1H, PhH), 6.88(d,J=5.15 Hz, 1H, O—C=CH), 6.43(dd,J=3.45 Hz, 3.45 Hz, 1H, C—CH=C);13C NMRδ: 161.6, 150.3, 145.6, 144.6, 144.2, 138.3, 133.3, 132.9, 129.5, 125.6, 122.5, 120.4, 112.5, 110.8; IRν: 3 404, 3 344, 3 142, 3 018, 1 869, 1 654, 1 593, 1 481, 1 382, 937 cm-1; Anal. calcd for C16H10N4O2F3Cl: C 50.21, H 2.63, N 14.64; found C 50.28, H 2.78, N 14.84。
1-苯基-3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9k): 白色粉末,产率97%, m.p.189~191 ℃;1H NMRδ: 8.16(s, 1H, CH=N), 7.58(d,J=5.15 Hz, 1H, O—CH=C), 7.56~7.53(m, 4H, PhH), 7.51~ 7.49(m, 1H, PhH), 7.20(d,J=5.15 Hz, 1H, S—C=CH), 7.03(dd,J=3.45 Hz, 3.45 Hz, 1H, C—CH=C);13C NMRδ: 161.6, 144.1, 139.9, 139.6, 139.3, 138.6, 137.9, 129.9, 129.2, 128.9, 128.0, 127.9, 125.5, 122.5, 124.4; IRν: 3 348, 3 319, 3 066, 1 634, 1 579, 1 568, 1 480, 1 315, 1 020, 700 cm-1; Anal. calcd for C16H10N4OSF3Cl: C 48.19, H 2.53, N 14.05; found C 48.45, H 2.20, N 14.67。
1-苯基-3-三氟甲基-5-氯-4-(2-(3-甲基)噻吩)-腙基羰基吡唑(9l): 白色粉末,产率95%, m.p.>250 ℃;1H NMRδ: 8.54(s, 1H, CH=N), 7.58~7.56(m, 4H, PhH), 7.54(d,J=5.15 Hz, 1H, S—CH=C), 7.53(m, 1H, PhH), 6.94(d,J=5.15 Hz, 1H, C—CH=C), 2.34(s, 3H, CH3);13C NMRδ: 158.0, 149.5, 142.2, 140.1, 137.7, 132.8, 131.5, 130.0, 129.5, 129.3, 128.7, 127.1, 125.8, 114.6, 13.9; IRν: 3 180, 3 020, 2 854, 1 633, 1 589, 1 568, 1 496, 1 411, 1 294, 1 143, 1 001, 893, 769 cm-1; Anal. calcd for C17H12N4OSF3Cl: C 49.46, H 2.93, N 13.57; found C 49.29, H 2.94, N 14.65。
1.3 抑菌活性测试
采用菌丝生长速率法[8],以苹果腐烂病菌、小麦赤霉菌和辣椒枯萎病菌为测试对象, 对9a~9l的抑菌活性进行测试。采用PDA培养基,量取90 mL培养基分装在200 mL三角瓶中灭菌备用。量取10 mL药剂浓度为50 mg·L-1供试药液加入90 mL PDA培养基(40~50 ℃)中,充分摇匀,将其倒入灭菌后的培养皿中,设三次重复,同时加入等量的溶剂为空白对照。测试时,以苹果腐烂病菌、小麦赤霉病菌、辣椒枯萎病菌为测试对象,用接种针将菌饼移接到平板中央,置于恒温培养箱中培养,待对照长满时,测量菌落直径,每个菌落按十字交叉法测量2次,按下式计算抑菌率。
1.4 抗TMV活性测试
(1) 活体治疗作用
采用半叶枯斑法[9-10]选长势一致的心叶烟,人工摩擦接种于撒有金刚砂的适龄叶片上,接种后用清水冲洗。待叶片干后,在左半叶涂施化合物溶液,右半叶涂施对应剂量的溶剂作对照。随后在光照培养箱中保湿培养3~4 d后观察并记录产生枯斑的数目。每药剂处理设3株,每株3~4片叶,按上述方法每药剂进行3次重复。
(2) 活体保护作用
选长势一致的心叶烟,在左半叶涂上化合物溶液,右半叶涂上对应剂量的溶剂作对照,并在光照培养箱中保湿培养,人工摩擦接种于撒有金刚砂的适龄叶片上,接种后用清水冲洗.随后在光照培养箱中保湿培养,3~4 d后观察并记录产生枯斑的数目。每药剂处理设3株,每株3~4片叶,按上述方法每药剂进行3次重复。
(3) 活体钝化作用
接种后均用清水冲洗,随后在光照培养箱中保湿培养, 3~4 d后观察并记录产生枯斑的数目。每药剂处理设3株,每株3~4片叶,按上述方法每药剂进行3次重复。
在试验3~4 d后,分别记录每片叶的左右半叶的枯斑数,按下式计算出供试化合物对植物病毒的抑制率,即相对效果。
Y=(C-A)/C×100%
式中:C为对照组(右半叶)枯斑数,A为化合物处理组(左半叶)枯斑数
2 结果与讨论
2.1 表征
以9a为例进行结构表征分析。IR分析表明:9a中的酰胺伸缩振动峰出现在1 298 cm-1处,NH的伸缩振动峰出现在3 211 cm-1附近,CH3的对称变形振动峰出现在1 365 cm-1附近。在1H NMR中,由于N的吸电子性使得NCH3的吸收峰出现在δ3.95左右,NH上的活泼H受氮原子的影响而使其化学位移向低场移动,吸收峰出现在δ7.0附近,同时,N—C—H上的氢由于受相邻氮原子的作用,使得δ向低场移动,吸收峰出现在δ8.45附近。
2.2 生物活性
对9a~9l进行了初步的生物活性测试,结果见表1和表2。由表1和表2可见,在50 mg·L-1浓度下,化合物对苹果腐烂病菌、小麦赤霉菌和辣椒枯萎病菌有一定的抑制作用,其中对小麦赤霉病菌的抑制作用总体上明显好于对苹果腐烂病菌与辣椒枯萎病菌的抑制作用;其中9e与9g对小麦赤霉病菌的抑制率分别为43.7%和45.8%;在浓度为500 mg·L-1时,9a~9l对TMV均表现出一定的活性,其中9k的治疗活性、保护活性和钝化活性分别为63.6%, 85.7%和93.1%,与宁南霉素(65.9%, 86.4%和97.8%)相当。

表1 化合物的抑菌活性(抑制率/%)*
*G.zeae:小麦赤霉菌,C.mandshurica:苹果腐烂病菌,F.oxysporum:辣椒枯萎病菌。
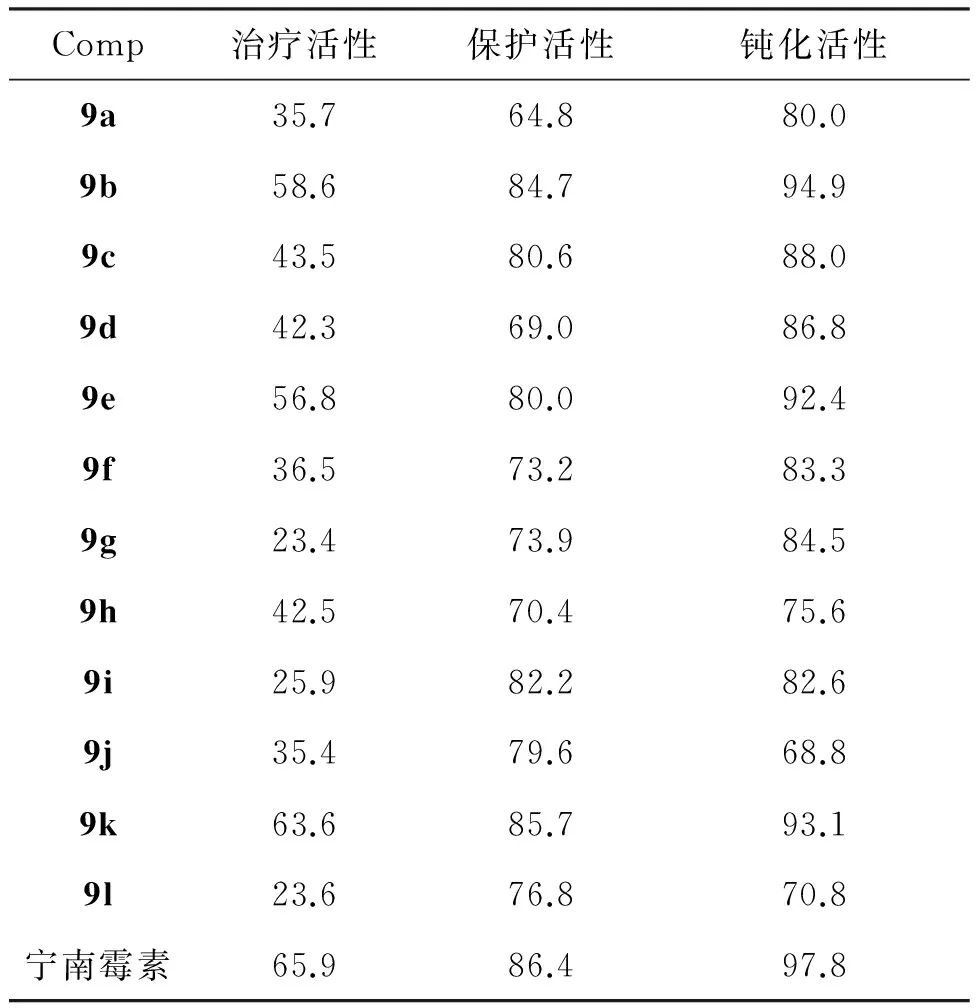
表2 化合物的抗TMV活性(抑制率/%)
2.3 生物活性初步构效关系分析
对目标化合物的初步构效关系分析表明:2-噻吩取代类化合物的活性优于2-呋喃和2-(3-甲基)噻吩取代类化合物的活性;另外噻吩和呋喃环上无取代基时,化合物对小麦赤霉病菌表现出较好的活性,同时当噻吩环上无取代基时对TMV表现出较好的抑制活性。
3 结论
以取代肼和取代乙酰乙酸乙酯为起始原料,合成了12个新型的吡唑酰腙类化合物(9a~9l)。初步的生物活性测试结果表明:在500 μg·mL-1浓度下,部分化合物对烟草花叶病毒(TMV)具有一定的抑制活性,其中1-苯基-3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9k)的治疗活性、保护活性和钝化活性分别为63.6%, 85.7%和93.1%,与对照药宁南霉素(65.9%, 86.4%和97.8%)相当;在50 μg·mL-1浓度下,部分化合物表现出一定的抑菌活性,其中1,3-二甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9b)与1-甲基3-三氟甲基-5-氯-4-(2-噻吩)-腙基羰基吡唑(9e)对小麦赤霉病菌的抑制率分别为42.5%和46.8%。
[1] 宋宝安. 新杂环农药-杀菌剂[M].北京:化学工业出版社,2009.
[2] 柏再苏,王大翔. 杂环、基因工程和二十一世纪的农药[J].农药,1998,37(6):2-6.
[3] 曹瑾,张一宾. 吡唑类农药的研究进展[J].精细化工中间体,2007,37(6):1-4.
[4] 化工部农药信息总站. 国外农药品种手册[M].北京:化学工业出版社,1996,922-923.
[5] 邹敏,卢俊,辛春伟,等. 1-(2-羟基苯甲酰基)-3-甲基-4-取代苯腙基-吡唑啉酮及其中间体的合成、表征及抑菌活性[J].有机化学,2010,30(8):1201-1206.
[6] 高元磊,林选福,韩菲菲,等.N-[3-(4-喹唑啉基)氨基-1H-吡唑-4-甲酰基]醛腙类衍生物的合成及抗菌活性研究[J].有机化学,2011,31(10):1648-1652.
[7] Wu L T, Song B A, Bhadury P S,etal. Synthesis and antiviral activity of novel pyrazole amides containingα-aminophosphonate moiety [J].Journal of Heterocyclic Chemistry,2011,48(2):389-396.
[8] 孔凡彬,高扬帆,陈锡岭,等. 9种药剂对玉米小斑病菌的室内抑菌试验[J].广西农业科学,2006,37(2):148-149.
[9] 李树正,王笃祜,焦书梅,等. 农药实验法:杀菌剂篇[M].北京:农业出版社,1991,93.
[10] 王力钟,李永红,于淑晶,等. 2种抗活性筛选方法在农药创制领域的应用[J].农药,2013,52(11):829-831.
Synthesis and Biological Activities of Novel Acylhydrazone Compounds Containing Pyrazole Group
XIE Yan1, WANG Yu-shen2, GONG Hua-yu1, WU Xiao-qiong3,WANG Xiao-bin1, XIAO Wei1, WANG Hua4, XUE Wei1*
(1. State Key Laboratory Breeding Base of Green Pesticide and Agricultural Bioengineering, Guizhou University,Guiyang 550025, China; 2. Shandong Changyi Jiayuanhuagong Chemical Ltd., Changyi 261303, China; 3. Vocational and Technical College of Anshun, Anshun 561000, China; 4. Institute of Plant Protection and Soil Fertilizer, Hubei Academy of Agricutural Science, Wuhan 430064, China)
1,3-Disubstituted 5-chloro-4-pyrazole formyl hydrazines(7a, 7d, 7g and 7j) were prepared by ring-closing, chlorine acylation, oxidation, esterification and substitution addition reaction, using substituted hydrazine and substituted ethyl acetoacetate as starting materials. Twelve novel pyrazole acylhydrazone compounds(9a~9l) were synthesized by addition reaction of 7 with furan or thiophene, respectively. The structures were characterized by1H NMR,13C NMR, IR and elemental analysis. The bioassay results showed that some title compounds showed certain antiviral activity against tobacco mosaic virus(TMV) at a concentration of 500 μg·mL-1. Particularly, the protection, treatment and passivation activities of 1-phenyl-3-trifluoromethyl-5-chloro-4-(2-thiophene)-hydrazone carbonyl pyrazole(9k) were 63.6%, 85.7% and 93.1%, respectively, slightly lower than the contrast agents Ningnanmycin(65.9%, 86.4% and 97.8%).Part of the compounds showed certain antibacterial activities againstG.zeae, inhibition ratio of 1,3-dimethy-5-chloro-4-(2-thiophene)-hydrazone carbonyl pyrazole(9b) and 1-methy-3-trifluoromethyl-5-chloro-4-(2-thiophene)-hydrazone carbonyl pyrazole(9e) were 42.5% and 46.8% at 50 μg·mL-1, respectively.
hydrazine; ethyl acetoacetate pyrazole; acylhydrazone; synthesis; biological activity
2016-03-01
贵州省优秀青年科技人才培养专项(201535); 公益性行业农业科研专项(20150311-8)
谢艳(1990-),女,白族,贵州安顺人,硕士研究生,主要从事新农药与新药物设计与合成研究。
薛伟,教授, E-mail: wxue@gzu.edu.cn
O621.3; O626
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16054
