新型海参硫酸软骨素葡萄糖受体及葡萄糖醛酸受体的高效合成
2016-11-19苏凯强于广利管华诗李春霞
苏凯强, 蔡 超, 于广利, 管华诗, 李春霞
(中国海洋大学 医药学院 海洋药物教育部重点实验室 山东省糖科学与糖工程重点实验室,山东 青岛 266003)
·研究论文·
新型海参硫酸软骨素葡萄糖受体及葡萄糖醛酸受体的高效合成
苏凯强, 蔡 超, 于广利, 管华诗, 李春霞*
(中国海洋大学 医药学院 海洋药物教育部重点实验室 山东省糖科学与糖工程重点实验室,山东 青岛 266003)
以D-葡萄糖为起始原料,经9步反应合成了2-O-苄基-3-O-烯丙基-1-O-对甲氧基苯基-α-D-葡萄糖(9);将9的6-位伯羟基经叔丁基二苯基硅烷基(TBDPS)保护,首次合成了正交保护的新型葡萄糖受体2-O-苄基-3-O-烯丙基-6-O-叔丁基二苯基硅烷基-1-O-对甲氧基苯基-α-D-葡萄糖(Ⅱ),总收率28.2%;将9的6-位伯羟基氧化糖醛酸化后,再经甲酯化,以25.0%的总收率首次合成了新型葡萄糖醛酸受体2-O-苄基-3-O-烯丙基-1-O-对甲氧基苯基-α-D-葡萄糖醛酸甲酯(Ⅲ),化合物结构经1H NMR,13C NMR, IR和HR-MS(ESI)表征。
D-葡萄糖; 葡萄糖醛酸; 受体; 合成
1988年Vieira和Mourão[1]从Ludwigothureagrisea海参体壁中分离得到了海参硫酸软骨素,研究发现其主要由N-乙酰氨基D-半乳糖、D-葡萄糖醛酸、L-岩藻糖及硫酸基组成;其中N-乙酰氨基D-半乳糖与D-葡萄糖醛酸通过β1→4糖苷键连接组成海参硫酸软骨素的主链(硫酸软骨素E骨架),而岩藻糖以α1→3糖苷键连接在葡萄糖醛酸3-位羟基上;由于含有岩藻糖支链,因此又被称为岩藻糖基化的硫酸软骨素(Fucosylated chondroitin sulfate, FCS, Chart 1)。

Chart 1
研究表明FCS不仅具有抗凝血、抗血栓、抗炎、抗肿瘤、抗病毒及抗高血糖等多种药理作用,还具有促进血管生成、调节免疫与细胞生长等多种生理活性[2]。其中FCS的抗凝血、抗血栓活性明显优于肝素(UFH)、低分子量肝素(LMWH)及硫酸皮肤素(DS)[3];并且FCS主要通过肝素辅因子Ⅱ发挥抗凝血作用而不依赖于抗凝血酶Ⅲ[4],因此FCS引发出血的风险较小[5]。2006年,Mourão等[6]研究发现FCS经口服后依然可以表现出良好的抗凝血和抗血栓活性,这一显著特点克服了肝素类抗凝血药物只能通过注射给药的局限性,增加了治疗的方便性;因此FCS有望被开发为新型的抗凝血、抗血栓药物。
目前FCS的获取主要依靠天然产物的提取分离与纯化,但是由于FCS在自然界中含量少、结构复杂,因此很难分离纯化得到结构均一、确证的FCS寡糖,严重阻碍了FCS的作用机制及构效关系的深入研究。通过化学合成的方法获取不同聚合度、不同硫酸化模式的FCS寡糖及其衍生物无疑是解决这一问题的有效途径。通过化学合成法制备FCS寡糖,需要分别制备氨基半乳糖、岩藻糖及葡萄糖醛酸砌块,由于N-乙酰氨基D-半乳糖及L-岩藻糖分别以β1→4和α1→3糖苷键连接在葡萄糖醛酸上,因此寻找一种合适的策略构建葡萄糖醛酸砌块是制备FCS寡糖的关键。
根据FCS的结构特点,在合成葡萄糖醛酸砌块时需要将葡萄糖醛酸的2,3,4-位仲羟基进行区分保护,使葡萄糖醛酸的3,4-位羟基可以选择性裸露,以便进行FCS寡糖骨架的构建。而葡萄糖醛酸一般由葡萄糖经氧化反应转化而来,因此FCS寡糖中葡萄糖醛酸砌块主要可通过以下两种合成策略构建:(1)先糖苷化再氧化,即先制得正交保护的葡萄糖受体,糖苷化偶连之后再将葡萄糖的6-位伯羟基裸露进而氧化为糖醛酸;(2)先氧化再糖苷化,即直接将葡萄糖经氧化反应制得葡萄糖醛酸受体,再经糖苷化反应制得FCS寡糖。关于FCS寡糖的葡萄糖受体的研究报道较少,仅Tamura等[7]于2013年以化合物4,6-O-苯亚甲基缩醛基-1-O-对甲氧基苯基-β-D-葡萄糖为起始原料,经6步反应合成了葡萄糖受体2-O-苄基-3-O-对甲氧基苯甲酰基-6-O-叔丁基二苯基硅烷基-1-O-对甲氧基苯基-β-D-葡萄糖(Ⅰ, Chart 2),但是该合成方法反应条件苛刻,我们多次尝试均未获得目标产物;而关于FCS寡糖的葡萄糖醛酸受体的合成研究则至今未见报道。为了快速高效地合成FCS寡糖,需要发展一种操作简便、适合大量制备的方法来合成FCS寡糖的葡萄糖醛酸砌块。

Chart 2
本课题组在合成FCS寡糖的过程中,首次设计合成了两个新型的葡萄糖受体(Ⅱ和 Ⅲ, Chart 2),并比较了合成策略的优劣。
以廉价易得的D-葡萄糖为起始原料,在路易斯酸FeCl3的催化下与丙酮反应制得1,2,5,6-O-双异亚丙基-α-D-呋喃葡萄糖(1); 1依次经烯丙基化、酸解及乙酰化反应制得1,2,4,6-O-四乙酰基-3-O-烯丙基-β-D-葡萄糖(4)[8]; 4在BF3Et2O催化下与对甲氧基苯酚(MEHQ)反应制得3-O-烯丙基-2,4,6-O-三乙酰基-1-O-对甲氧基苯基-α-D-葡萄糖(5); 5脱除乙酰基后用苯亚甲基缩醛基保护4,6-位羟基制得3-O-烯丙基-4,6-O-苯亚甲基缩醛基-1-O-对甲氧基苯基-α-D-葡萄糖(7);在7的2-位引入苄基后,再将苯亚甲基缩醛基脱除制得2-O-苄基-3-O-烯丙基-1-O-对甲氧基苯基-α-D-葡萄糖(9); 9的6-位伯羟基经叔丁基二苯基硅烷基(TBDPS)保护合成了新型葡萄糖受体2-O-苄基-3-O-烯丙基-6-O-叔丁基二苯基硅烷基-1-O-对甲氧基苯基-α-D-葡萄糖(Ⅱ, Scheme 1),共10步反应,总收率28.2%。另外选择性地将9的6-位羟基氧化后,再经甲酯化,经11步反应以25.0%总收率合成了葡萄糖醛酸受体2-O-苄基-3-O-烯丙基-1-O-对甲氧基苯基-α-D-葡萄糖醛酸甲酯(Ⅲ, Scheme 1),化合物结构经1H NMR,13C NMR, IR和HR-MS(ESI)表征。
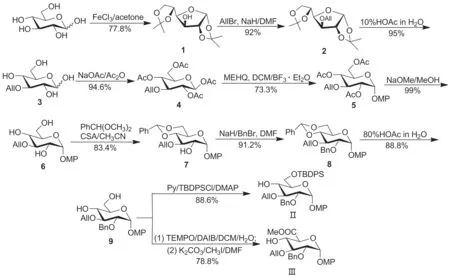
Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-2型微机熔点仪;P-1020型旋光仪;安捷伦DD2 500-MR型核磁共振仪(CDCl3为溶剂,TMS为内标);NEXUS 470型红外光谱仪(KBr压片);Micromass Q-TOF Ultima Global型和InoSpec 4.7 Tesla FTMS (MALDI/DHB)型质谱仪。
化合物2~4按文献方法[8]合成;D-葡萄糖,分析纯,国药集团化学试剂有限公司;其余所用试剂均为分析纯,其中溶剂使用前均经无水处理。
1.2 合成
(1) 1的合成

(2) 5的合成
将4[8]0.9 g(2.32 mmol)和MEHQ 574 mg(4.64 mmol)溶于DCM(15 mL)中,冰浴冷却,搅拌下加入BF3Et2O 584 μL(4.63 mmol),反应20 min;撤去冰浴,于室温反应48 h(TLC监测)。用Et3N淬灭反应,加入DCM 10 mL,用DCM(3×20 mL)萃取,合并有机相,依次用饱和NaHCO3水溶液(2×20 mL)和饱和NaCl溶液(2×20 mL)洗涤,无水Na2SO4干燥,减压浓缩后经硅胶柱层析(洗脱剂:A=8 ∶1)纯化得白色固体5 768 mg,收率73.3%,Rf0.50(展开剂:A=1 ∶1), m.p.120.5~121.7 ℃,1H, 4-H), 4.93(dd,J=3.7 Hz, 10.0 Hz, 1H, 2-H), 4.24(ddt,。
(3) 6的合成

(4) 7的合成

(5) 8的合成

(6) 9的合成

(7) Ⅱ的合成
(8) Ⅲ的合成
将9 245 mg(0.59 mmol)加至二氯甲烷/水(V/V=2 ∶1)混合溶剂10 mL中,N2保护下依次加入四甲基哌啶氮氧化物(TEMPO)18.5 mg(0.12 mmol)和碘苯二乙酯(DAIB)475 mg(1.48 mmol),加毕,剧烈搅拌反应30 min(TLC监测,展开剂:A=1 ∶1, 1滴甲酸)。加入饱和Na2S2O3水溶液2 mL淬灭反应,蒸干,残余物用乙酸乙酯(20 mL)溶解,依次用少量1 mol·L-1盐酸洗涤,乙酸乙酯(3×20 mL)萃取,合并有机相,依次用水(2×20 mL)和饱和NaCl溶液(2×20 mL)洗涤,无水Na2SO4干燥,减压浓缩后真空干燥得黄色油状液体。
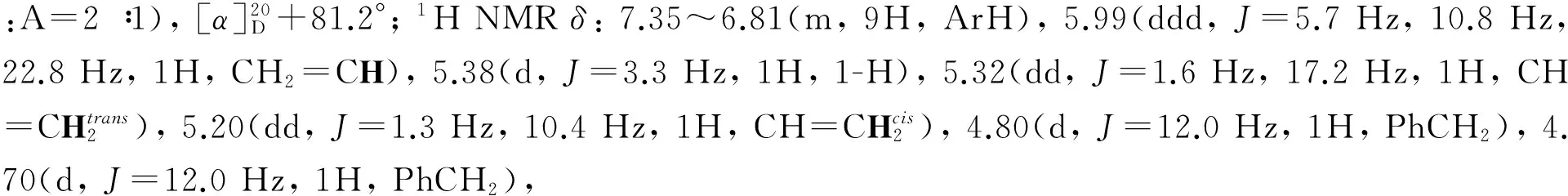
本研究以廉价易得的D-葡萄糖为原料,在无水FeCl3催化下与丙酮反应,以77.8%的收率制得1。采用无水FeCl3作为催化剂的优点在于反应条件较为温和、适合大量制备、反应时间短、产率较高,并且后处理简单,水洗即可除去杂质无需硅胶柱层析分离。而文献方法中经常采用浓硫酸作为催化剂,其用量在放大制备时很难控制,并且在反应结束后中和多余的酸时会剧烈放热,导致大量副产物生成,必须经硅胶柱层析分离才能得到纯净产物1,因此产率比较低。
参考Qu等[8]报道的方法,将化合物1的3-位羟基经烯丙基化后,在酸性条件下脱除双异亚丙基缩酮,同时由呋喃糖异构化为吡喃糖制得3。随后将3在酸酐/乙酸钠作用下,将裸露的羟基全部乙酰化制得4[8],四步反应中仅一步反应需要硅胶柱层析分离,总收率61.4%。
为了使葡萄糖受体的端基在糖苷化反应时不被活化,选择对甲氧基苯基保护1-位羟基,参考文献[9]方法,以73.3%的收率得到化合物5,脱除三个乙酰基后,再与苯亚甲基二甲缩醛反应,选择性的保护4,6-位羟基则得到了2-位羟基裸露的化合物7,两步反应均无需硅胶柱层析分离,直接浓缩或经乙醇重结晶即可得到纯净的产物,且产率均较为理想。在化合物7的2-位引入永久保护基苄基后,再将4,6-位羟基上的苯亚甲基缩醛基脱除得到化合物9,两步反应总收率为80.9%。选择性地将9的6-位伯羟基经TBDPS保护后,则首次合成了正交保护的葡萄糖受体Ⅱ;另外将9的6-位伯羟基氧化为羧基后,再经甲酯化,则首次得到了正交保护的葡萄糖醛酸受体Ⅲ。
该路线的优点为反应步骤较少、操作简单、适合大量制备,并且其2-位羟基的保护基可以根据需求进行变换。例如,当葡萄糖砌块作为受体时,其2-位羟基可以选用永久保护基Bn保护,有利于减少后续FCS三糖分子硫酸化完成后脱保护基的步骤;当葡萄糖砌块转化作为供体时,其2-位羟基选用Bz等有邻基参与作用的酰基类保护基保护,有利于1,2-trans-β-糖苷键的构建。
以D-葡萄糖为起始原料,分别经10和11步反应,分别以28.2%和25.0%的总收率合成了两个新型葡萄糖受体和葡萄糖醛酸受体。该方法试剂廉价低毒,操作简便易行,收率高且适合大量制备,为海参硫酸软骨素寡糖的合成奠定了基础,也为其它硫酸软骨素类寡糖的合成提供了参考。
[1] Vieira R P, Mourão P A. Occurrence of a unique fucose-branched chondroitin sulfate in the body wall of a sea cucumber[J].Journal of Biological Chemistry,1988,263(34):18176-18183.
[2] Pomin V H. Holothurian fucosylated chondroitin sulfate[J].Marine drugs,2014,12(1):232-254.
[3] Mourão P A S, Boisson-Vidal C, Tapon-Bretaudière J,etal. Inactivation of thrombin by a fucosylated chondroitin sulfate from echinoderm[J].Thrombosis research,2001,102(2):167-176.
[4] Fonseca R J, Santos G R, Mourão P A. Effects of polysaccharides enriched in 2,4-disulfated fucose units on coagulation,thrombosis and bleeding[J].Thrombosis and Haemostasis,2009,102(5):829-836.
[5] Minamiguchi K, Nagase H, Kitazato K T,etal. Interaction of a new depolymerized holothurian glycosaminoglycan with proteins in Human plasma[J].Thrombosis research,1996,83(3):253-264.
[6] Fonseca R J, Mourão P A. Fucosylated chondroitin sulfate as a new oral antithrombotic agent[J].Thrombosis and Haemostasis,2006,96(6):822-829.
[7] Tamura J, Tanaka H, Nakamura A,etal. Synthesis ofβ-D-GalNAc(4,6-diS)(1-4)[α-L-Fuc(2,4-diS) (1-3)]-β-D-GlcA,a novel trisaccharide unit of chondroitin sulfate with a fucose branch[J].Tetrahedron Letters,2013,54(30):3940-3943.
[8] Qu H, Sun W, Zhang Y,etal. Synthesis and NMR elucidation of four novel 2-(trimethylsilyl) ethyl glycosides[J].Research on Chemical Intermediates,2014,40(4):1557-1564.
[9] Zong G, Cai X, Liang X,etal. Facile syntheses of the disaccharide repeating unit of theO-antigenic polysaccharide of Burkholderia pseudomallei strain 304b and its dimer and trimer[J].Carbohydrate research,2011,346(16):2533-2539.
Efficient Synthesis of Novel Glucose and Glucuronic Acid Acceptors for Sea Cucumber Chondroitin Sulfate Preparation
SU Kai-qiang, CAI Chao, YU Guang-li, GUAN Hua-shi, LI Chun-xia*
(Key Laboratory of Glycoscience and Glycotechnology of Shandong Province, Key Laboratory of Marine Drugs,Ministry of Education, School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China)
p-Methoxyphenyl 2-O-benzyl-3-O-allyl-α-D-glucopyranoside(9) was synthesized from D-glucose by nine step reactions. The primary hydroxyl of 9 was protected by tert-butyldiphenysilyl(TBDPS) to afford the novel orthogonal protected glucose acceptorp-methoxyphenyl 2-O-benzyl-3-O-allyl-6-O-tert-butyldiphenysilyl-α-D-glucopyranoside(Ⅱ) for the first time, in total yield of 28.2%. Oxidation of the primary hydroxyl of 9, followed by esterification with iodine methane, provided the new glucuronic acid acceptor methyl (p-methoxyphenyl 2-O-benzyl-3-O-allyl-α-D-glucopyranoside) uronate(Ⅲ), in total yield of 25.0%. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI).
D-glucose; glucuronic acid; acceptor; synthesis
2016-03-09;
2016-09-06
资助: 国家自然科学基金委员会-山东省人民政府联合资助海洋科学研究中心项目(U1406402); 海洋公益性行业科研专项基金资助项目(201405038); 青岛市自主创新重大专项(15-4-13-zdzx-hy)
苏凯强(1987-),男,汉族,河北石家庄人,硕士研究生,主要从事药物化学的研究。 E-mail: sukaiqiang.luck@163.com
李春霞,教授, Tel. 0532-82032030, E-mail: lchunxia@ouc.edu.cn
O629.11
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16068
