新型手性膦噁唑啉铱络合物的合成及其在氢化反应中的应用
2016-11-19孟祥燕梁建英沈剑锋樊伟明
孟祥燕, 梁建英, 沈剑锋, 樊伟明
(浙江震元制药有限公司,浙江 绍兴 312071)
·快递论文·
新型手性膦噁唑啉铱络合物的合成及其在氢化反应中的应用
孟祥燕*, 梁建英, 沈剑锋, 樊伟明
(浙江震元制药有限公司,浙江 绍兴 312071)
在鹰爪碱诱导下,2-氯甲基-4,4-二甲基噁唑啉与叔丁基苯基膦硼烷经络合反应,以43%的收率合成了光学纯度大于99%,手性中心在P上的新型手性噁唑啉氮膦配体(3); 3和铱配合物([Ir(cod)Cl]2)经络合反应以55%的收率制得两个新型手性膦噁唑啉铱络合物催化剂(1和2),其结构经1H NMR,13C NMR,31P NMR和元素分析表征。考察了1和2对烯烃的不对称氢化反应的催化性能。结果表明:1具有较好的催化能力,收率>92%,但催化剂的手性诱导能力较差(ee≤36%)。
2-氯甲基-4,4-二甲基噁唑啉; 叔丁基苯基膦硼烷; 噁唑啉氮膦配体; 铱络合物; 合成; 不对称氢化; 催化
不对称催化氢化广泛应用于光学活性化合物的合成,无论在实验室研究还是工业化生产领域均取得了巨大成功[1]。高对映选择性、高收率、低催化剂用量、条件温和及原子经济性等是这一领域最吸引人的特征[2]。Rh和Ru催化的不对称氢化反应的研究比较多,其手性络合物对官能化烯烃催化效果比较好,对非官能团多取代烯烃的氢化则表现出较差的催化活性[3]。Crabtree催化剂对于催化多取代的烯烃具有良好的催化效果[4],但其用于合成反应远不如Wilkinson催化剂使用广泛[5],在手性催化方面几乎为空白。直到1998年,Pfaltz等[6]第一次使用手性噁唑啉膦配体组装成了手性Crabtree催化剂,并成功用于烯烃的催化氢化,该催化剂无论对非官能化的烯烃或官能化的烯烃均显示出了很好的催化活性和手性诱导能力。继此发现后,为了进一步开拓铱配合物的催化效能,许多手性N—P配体与金属铱的配合物相继被报道[7-10],在Rh催化的不对称氢化反应中,手性中心在膦原子上的配体均取得了优良的结果。手性Ir络合物催化的不对称氢化反应中,已报道的配体中手原子几乎都位于碳原子上,由于碳原子的手性中心离活性的Ir原子空间距离上较远,可能会减弱手性的诱导能力。

Scheme 1
为了进一步研究该类型配体中含膦部分对催化剂的影响,本文设计并合成了手性中心在膦原子上的配体。以2-氯甲基-4,4-二甲基噁唑啉(6)为起始原料,经DMAP催化成环制得2-氯甲基-4,4-二甲基噁唑啉(5);在鹰爪碱的诱导下,5与叔丁基苯基膦硼烷(4)经络合反应以43%的收率合成了光学纯度大于99%的手性中心在磷原子上的新型手性噁唑啉氮膦配体(3); 3和铱配合物([Ir(cod)Cl]2)经络合反应以55%的收率制得两个新型手性膦噁唑啉铱络合物催化剂——(R)-膦-[2-(4,4-二甲基噁唑啉)甲基叔丁基苯基膦·1,5-环辛二烯合四-3,5-双三氟甲基苯硼酸铱(1)和双-(R)-膦-[2-(4,4-二甲基噁唑啉)甲基叔丁基苯基膦合四-3,5-双三氟甲基苯硼酸铱(2)(Scheme 1),其结构经1H NMR,13C NMR,31P NMR和元素分析表征。并考察了1和2对烯烃的不对称氢化反应的催化性能。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字显微熔点仪(温度未校正);WZZ-2B型自动旋光仪;Bruker AV-400型核磁共振仪(CDCl3为溶剂,TMS为内标;31P NMR: 85%磷酸为外标);Nicolet Nexus 670型红外光谱仪(KBr压片);Agilent 6820型气相色谱仪;Waters 1525型高效液相色谱仪;Bruker APEXII area-detector diffractometer型X-射线单晶衍射仪。
所用试剂均为分析纯,其中溶剂使用前经无水处理。
1.2 合成
(1) 5的合成
N2保护下,在Schlenk瓶中依次加入6 16.9 g(0.1 mol),三乙胺71.7 mL(0.5 mol),二氯甲烷120 mL及DMAP 1.2 g(0.01 mol),搅拌下冷却至0 ℃,快速滴加对甲苯磺酰氯21.4 g(0.1 mol)的二氯甲烷(50 mL)溶液,滴毕,自然升至室温,反应过夜(GC跟踪)。用5%酒石酸溶液(60 mL)萃取,有机相依次用饱和食盐水(2×50 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂及低沸点物质,经油泵减压蒸馏得无色油状液体5 12.6 g,收率84%;1H NMR(400 MHz)δ: 4.09(s, 2H), 4.05(s, 2H), 1.31(s, 6H);13C NMR (100 MHz)δ: 160.9, 80.0, 67.6, 36.5, 28.0。
(2) 3的合成[11]
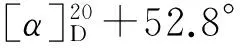
(3) 1和2的合成


1.3 催化剂的应用
向反应管中加入底物烯烃(0.5 mmol),快速加入催化剂(0.0025 mmol )和干燥二氯甲烷2 mL,将试管放入高压釜内,置换氢气三次,加压至5 MPa,于室温反应3~5 h。粗产物经硅胶短柱纯化得氢化产物。表征数据与文献[8,12]报道一致,ee值由手性GC或HPLC确定。
2 结果与讨论
2.1 催化剂的合成
以合成噁唑啉的经典方法,用氯乙酰氯和氨基乙醇缩合成酰胺后,活化羟基为磺酸酯后可以顺利的环化得到噁唑啉5,在鹰爪碱诱导下,用丁基锂锂化苯基叔丁基膦硼烷络合物,该锂化的络合物与噁唑啉5反应,得到富含膦手性的噁唑啉膦硼烷络合物,经过多次结晶后可以得到对映体过量大于99%的手性配体。该手性膦的硼烷络合物经过去硼烷后与[Ir(cod)Cl]2形成铱络合物,再经过配离子交换得到手性的催化剂。
2.2 催化剂的应用
将1和2用于烯烃的氢化反应(Scheme 2),考察其催化性能,结果见表1。实验结果表明:1对官能团化的或非官能团化的烯烃都具有良好的催化能力,但催化剂的手性选择能力较差。反式二苯丙烯可获得33%ee值,而顺式仅6%ee值(No.1~2)。
Scheme 2
该催化剂对于官能团化的肉桂醇衍生物和脱氢氨基酸酯都具有较好的催化活性,但手性选择能力依旧较差,肉桂醇衍生物只获得10%ee值(No.3~4)。脱氢氨基酸酯最高也只有36%的对映选择性(No.5~10)。当用络合物2为催化剂催化氢化反应时,反应根本无法进行,这说明了配位能力较强的配体会显著降低催化剂的催化活性。

表1 以0.5 mol%1为催化剂的不对称氢化结果
aIsolated yield;bDetermined by chiral GC or HPLC[8,12];cThe reaction was carried out with 1 mol% 2 as catalyst。
3 结论
合成了两个新型手性膦噁唑啉铱络合物催化剂1和2,其中催化剂1对于烯烃的氢化反应具有较好的催化能力,但催化剂在底物的氢化反应中对映选择性较差,说明手性中心在膦原子上是非必须的,同时如果发生两个配体同时配位到铱原子上,催化剂会失去催化能力,这也为催化剂的催化原理提供了研究依据。
[1] Noyori R. Asymmetric catalysis:Science and opportunities(Nobel Lecture)[J].Angew Chem Int Ed,2002,41(12):2008-2022.
[2] Roseblade S J, Pfaltz A. Iridium-catalyzedasymmetric aydrogenation of olefins[J].Acc Chem Res,2007,40(12):1402-1411.
[3] Bess E N, Sigman M S. Distinctivemeta-directing group effect for iridium-catalyzed 1,1-diarylalkene enantioselective hydrogenation[J].Org Lett,2013,15(3):646-649.
[4] Crabtree R H, Felkin H, Morris G E. Activation of molecular hydrogen by cationic iridium diene complexes[J].Chem Commun,1976,18(18):716-717.
[5] Osborn J A, Jardine F H, Young J F,etal. The preparation and properties of tris(triphenylphosphine)halogeno rhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives[J].J Chem Soc A,1966,1711-1732.
[6] Lightfoot A, Schnider P, Pfaltz A. Enantioselectivehydrogenation of olefins with iridium-phosphanodihydrooxazole catalysts [J].Angew Chem In Ed,1998,37(20):2897-2899.
[7] Huang W, Yu C, Shi L,etal. Iridium-catalyzed asymmetric hydrogenation of pyrrolo[1,2-a] pyrazinium salts[J].Org Lett,2014,16(12):3324-3327.[8] Chen L, Xu W, Huang B,etal.Asymmetric catalysis with an inert chiral-at-metal iridium complex[J].J Am Chem Soc,2013,135(29):10598-10601.
[9] Guo C, Sun D, Yang S,etal. Iridium-catalyzed asymmetric hydrogenation of 2-pyridyl cyclic imines:A highly enantioselective approach to nicotine derivatives [J].J Am Chem Soc,2015,137(1):90-93.
[10] Song S, Zhu S, Li Y. Iridium-catalyzed enantioselective hydrogenation ofα,β-unsaturated carboxylic acids with tetrasubstituted olefins[J].Org Lett,2013,15(14):3722-3725.
[11] Wolfe B, Livinghouse T. A direct synthesis of P-chiral phosphine-boranes via dynamic resolution of lithiated racemictert-butylphenylphosphine-borane with (-)-sparteine[J].J Am Chem Soc,1998,120(20):5116-5117.
[12] Li S, Xiao T, Li D,etal. First iridium-catalyzed highly enantioselective hydrogenation ofβ-nitroacrylates[J].Org Lett,2015,17(15):3782-3785.
Synthesis of Novel Chiral Ir-Phosphine-Oxazoline Complexes and Their Application in Asymmetric Hydrogenation of Olefins
MENG Xiang-yan*, LIANG Jian-ying, SHEN Jian-feng, FAN Wei-ming
(Zhejiang Zhenyuan Pharmaceutical Co., Ltd., Shaoxing 312071, China)
A novel chiral oxazoline-phosphine ligand(3) with 99%eein 43% yield was prepared by reaction oftert-butylphenylphosphine-borane with 2-(chloromethyl)-4,4-dimethyl-4,5-dihydrooxazole in the present of (-)-sparteine. Two novel chiral Ir-phosphine-oxazoline complexes(1 and 2) with chiral center in phosphine atom were synthesized by complexation reaction of 3 with [Ir(cod)Cl]2. The structures were characterized by1H NMR,13C NMR,31P NMR and elemental analysis. The catalytic performance of 1 and 2 in the hydrogenation of olefins were investigated. The results showed that 1 exhibited good catalytic activity with >92% yield and modest enantioselectivities(<36%).
2-(chloromethyl)-4,4-dimethyl-4,5-dihydrooxazole;tert-butylphenylphosphine-borane; oxazoline-phosphine ligand; Ir complex; synthesis; asymmetric hydrogenation; catalysis
2015-12-15;
2016-07-26
浙江省自然科学基金资助项目(Y405013)
孟祥燕(1983-),女,汉族,湖北洪湖人,硕士,工程师,主要从事不对称催化氢化及药物合成研究。 Tel. 0575-85153577, E-mail: maria_1126@sina.com
O621.3; O614.82
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.15402
