过渡金属甲基磺酸盐催化醇的四氢吡喃化反应
2016-11-19朱强,宫红,姜恒,王锐
朱 强, 宫 红, 姜 恒, 王 锐
(辽宁石油化工大学 化学与材料科学学院,辽宁 抚顺 113001)
·研究论文·
过渡金属甲基磺酸盐催化醇的四氢吡喃化反应
朱 强, 宫 红, 姜 恒*, 王 锐
(辽宁石油化工大学 化学与材料科学学院,辽宁 抚顺 113001)
以过渡金属甲基磺酸盐[Mn(CH3SO3)2·2H2O, Cu(CH3SO3)2·4H2O, Co(CH3SO3)2·4H2O和Zn(CH3SO3)2·4H2O]为催化剂,在室温条件下催化醇的四氢吡喃化反应,并对反应条件进行了优化。结果表明:当醇用量为30 mmol,醇和3,4-二氢吡喃摩尔比为1.0 ∶1.1,甲基磺酸盐用量为1 mmol,二氯甲烷20 mL时,可高效催化醇的四氢吡喃化反应。与路易斯酸催化活性相比,过渡金属甲基磺酸盐催化醇的四氢吡喃化反应效果最好,催化酚的效果较差。用Mn(CH3SO3)2·2H2O和Cu(CH3SO3)2·4H2O催化正丁醇的四氢吡喃化反应,重复使用5次,收率分别为89%和92%。
过渡金属甲基磺酸盐; 醇; 四氢吡喃化反应; 催化; 合成
羟基化合物包括醇类、酚类、糖类和甾类等,被广泛用于医学和工业合成,许多药物的活性与羟基有密切联系[1-2]。通常,该类化合物分子中具有一个或多个羟基,对羟基进行合理保护,有利于多官能团化合物的合成和系列后续反应进行。
在四氢吡喃化反应中,最早使用的催化剂为质子酸,但是质子酸不适用于对目标分子中存在酸敏感基团的分子进行保护。近年来,有关催化四氢吡喃化反应的催化剂的文献报道较多,比较典型的催化剂有:[SnIV(TNH2PP)(OTf)2]/CM-MIL-101[3], Ti4+/4A[4],三乙胺[5],铝化锗硅酸盐ITH沸石[6],SANM[7], [Et3N(CH2)4SO3H][OTs][8], 3,5-二硝基苯甲酸[9],NaHSO4/SiO2[10],氧化石墨[11]及CMK-5-SO3H[12]。但是,这些催化剂大多具有反应时间长或所需试剂昂贵等缺点。因此,开发一种经济高效、绿色无毒、可循环使用的催化剂仍然十分必要。
过渡金属甲基磺酸盐在室温可催化Mannich反应[13]、Biginelli反应[14]、酯化反应[15]和Friedel-Crafts酰化反应[16]。因其具有用量少、对空气和水分不敏感以及催化活性高等诸多优点,是一种可回收使用且具有较高研究价值的催化剂。
本文参考文献[17-18]方法合成了4种过渡金属甲基磺酸盐[M(MS)2]——Mn(CH3SO3)2·2H2O[Mn(MS)2], Cu(CH3SO3)2·4H2O[Cu(MS)2], Co(CH3SO3)2·4H2O[Co(MS)2]和Zn(CH3SO3)2·4H2O[Zn(MS)2],其结构经IR和TG确证。将其用于催化醇的四氢吡喃化反应(Scheme 1),考察了其催化性能。并对反应条件进行了优化,对反应机理进行了探究。

Scheme 1
1 实验部分
1.1 仪器与试剂
Perkin-Elmer Spectrum GX型傅里叶变换红外光谱仪(KBr压片);Perkin-Elmer Pyris 1 TGA型热重分析仪;Autosystem XL型气相色谱仪。
3,4-二氢吡喃(DHP),北京百灵威科技有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) M(MS)2的制备[以Mn(MS)2为例]
将甲烷磺酸9.61 g(0.1 mol)和水6.49 mL(V/V=1∶1)加入反应瓶中,搅拌下分5次缓慢加入碳酸锰5.75 g(0.05 mol),加毕,回流反应1.5 h。趁热过滤,滤饼经洗涤,重结晶得Mn(MS)213.54 g,收率96.30%。
用类似方法合成Cu(MS)2[17], Zn(MS)2[17]和Co(MS)2[18]。表征数据与文献报道一致。
(2) 醇的四氢吡喃化反应
在50 mL反应瓶中依次加入醇30 mmol, DHP 33 mmol, DCM 20 mL和M(MS)21 mmol,搅拌下于25 ℃反应5 h。定时取少量反应液进行气相色谱分析,以环己烷为内标物计算收率。
2 结果与讨论
2.1 反应条件优化
以Mn(MS)2催化正丁醇的四氢吡喃化反应为例,考察了正丁醇和DHP的摩尔比、Mn(MS)2及DCM用量对收率的影响,结果见表1。由表1可见,在相同条件下,不加入DCM时,反应5 h收率为65%,而以DCM为溶剂可有效促进反应进行,短时间内即完成THP醚的转化,收率≥95%(No.1~4)。
为确定DCM的用量,进行三组对照实验(No.2~4),实验结果相近,收率均较高,但是DCM用量为20 mL时,反应时间最短,DCM用量增至25 mL时,所需反应时间反而增加。这可能因为DCM过量导致醇和DHP的浓度降低,致使反应速率减慢。
当使用1 mmol Mn(MS)2时,改变醇和DHP摩尔比[r=n(C4H9OH)∶n(DHP)],当r为1.0 ∶1.5时,反应时间与r为1.0 ∶1.1时相同,且收率相当(No.3,5)。
对Mn(MS)2用量的研究发现,当恒定醇、DHP和DCM用量时,Mn(MS)2用量为0.8 mmol时,收率不高;随着Mn(MS)2用量的增加,收率随之增大;当Mn(MS)2用量增至1.5 mmol时,其催化时间并没有缩短(No.3,6~7)。可见,使用1 mmol的Mn(MS)2是该反应的最合适用量。
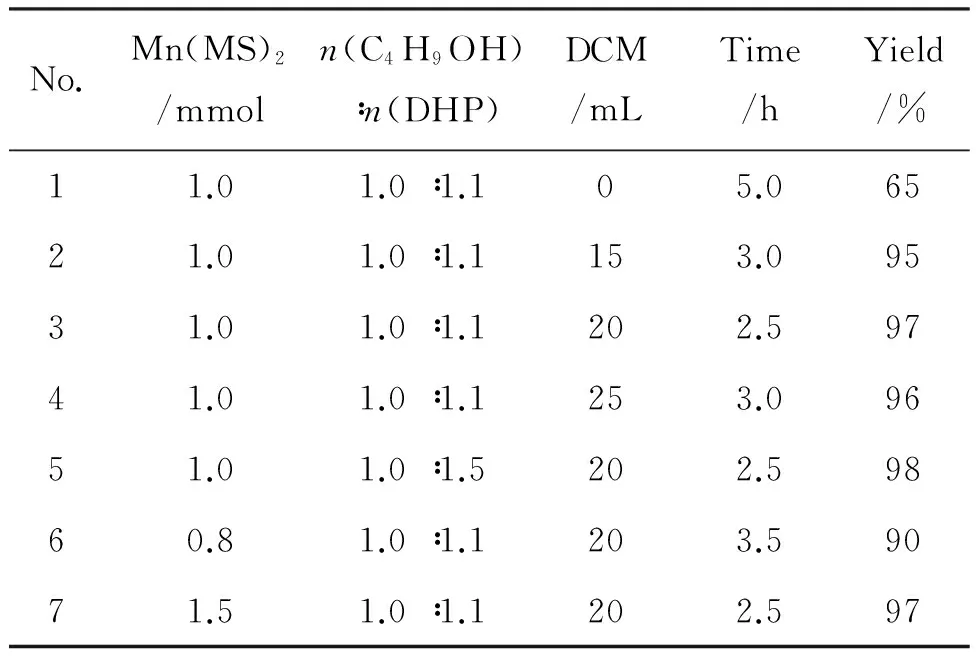
表1 正丁醇的四氢吡喃化反应
综上所述,最佳反应条件为:醇30 mmol,r为1.0 ∶1.1, Mn(MS)2用量1 mmol, DCM用量20 mL。
2.2 催化剂的活性对比
(1) M(MS)2的催化活性对比
在最优反应条件下,对M(MS)2的催化活性进行了对比,实验结果见表2。由表2可见,Mn(MS)2, Cu(MS)2和Co(MS)2的催化效果良好,用时短,转化率高。而Zn(MS)2催化活性较差,转化率也都较低。这可能是中心金属的配位性差异导致的,由于Mn2+, Cu2+和Co2+的外围电子构型是3p63d5, 3p63d9和3p63d7,缺电子结构导致了金属的配位活性较高,而Zn2+的外围电子构型是3p63d10,轨道处于充满状态,金属的配位活性较差。因此选用Mn(MS)2和Cu(MS)2为催化剂进行下一步研究。
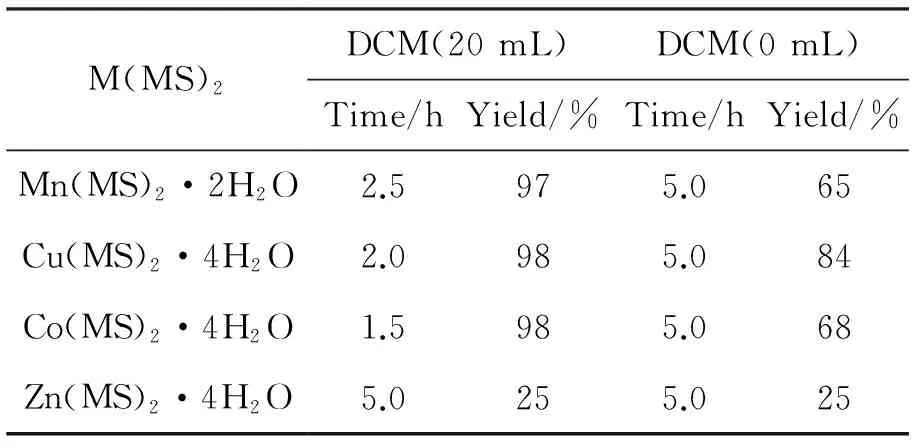
表2 M(MS)2的催化活性对比*
*Reaction conditions: butyl alcohol 30 mmol, DHP 33 mmol, methanesulfonate 1 mmol, room temperature。
(2) M(MS)2与同金属路易斯酸盐的催化活性对比
在最佳反应条件下,以正丁醇的四氢吡喃化反应为例,对铜和锰相应的硫酸盐、醋酸盐和盐酸盐的催化活性进行研究,结果见表3。由表3可见,与其他无机盐的路易斯酸相比,Mn(MS)2和Cu(MS)2催化活性最高,均能在较短时间内催化反应,并且转化率较高。而硫酸盐、醋酸盐和盐酸盐的催化活性非常低,反应时间长,转化率低。此外,单独使用CH3SO3H作为催化剂时,溶液变黄并观察到放热现象,反应1 h和2 h的收率均为69%。这是由于CH3SO3H酸性太强,使部分DHP快速聚合,导致四氢吡喃醚的收率较低,所以CH3SO3H并不能很好地催化反应。可见Mn(MS)2和Cu(MS)2作为催化剂的效果均优于硫酸盐、醋酸盐、盐酸盐和甲基磺酸。

表3 不同催化剂活性比较*
*Reaction conditions: butyl alcohol 30 mmol, DHP 33 mmol, catalyst 1 mmol, DCM 20 mL, at room temperature。
(3) Mn(MS)2和Cu(MS)2对多种醇的四氢吡喃化催化及重复使用活性
在最佳反应条件下,分别用Mn(MS)2和Cu(MS)2催化伯醇、仲醇、叔醇和芳香醇的四氢吡喃化反应,实验结果见表4。由表4可见,Mn(MS)2的催化活性较Cu(MS)2略低,在对直链饱和醇的催化中,随着碳链的增加,反应时间并没有出现明显增长,也都维持了高收率。相同碳链数的异醇和仲醇的催化时间与直链醇相比,时间相同。而叔丁醇、叔戊醇和环己醇的催化时间与伯醇和仲醇相比稍长。这可能是因为叔丁醇、叔戊醇和环己醇的空间位阻过大,造成醇羟基的活性降低,使反应速率减慢。对于较难催化的叔丁醇和叔戊醇,虽然他们的反应时间与其他醇相比较长,但是在延长反应时间后,其收率也都在90%以上,效果较好。可见,过渡金属甲基磺酸盐可以催化多种醇的四氢吡喃化反应,收率高,无副产物生成。
在催化对氯苯酚和对甲酚的四氢吡喃化反应中发现,当加入Mn(MS)2后,反应放热且颜色变黄,经GC监测,收率分别为35%和43%,此时体系中未监测到DHP,而酚含量较高,说明DHP在反应中存在聚合,Cu(MS)2催化时也出现了同样的现象。当加入催化剂后,监测体系pH为1~2,这可能是酚类化合物本身显酸性,金属离子与酚羟基配位后活化了MS基团,生成的CH3SO3H酸性较强,使DHP聚合,导致四氢吡喃醚收率较低。可见,Mn(MS)2和Cu(MS)2并不能有效催化酚的四氢吡喃化反应。
以正丁醇和DHP反应为例,采用连续催化的方法,即当反应结束后,滤出反应液,催化剂在反应瓶中直接用于下一步催化,连续催化5次,Mn(MS)2和Cu(MS)2的反应时间为2.5 h和2 h。考察了Mn(MS)2和Cu(MS)2的重复催化活性,结果见表4。由表4可见,两种过渡金属甲基酸盐第5次的催化收率分别为89%和92%,催化活性仍然较高。说明Mn(MS)2和Cu(MS)2在催化四氢吡喃化反应中稳定性较好,是可以重复使用的优良催化剂。

表4 多种醇的四氢吡喃化反应a
aReaction conditions: alcohol 30 mmol, DHP 33 mmol, methanesulfonate 1 mmol, DCM 20 mL, room temperature;bCatalyst reused for five times sequentially。
2.3 反应机理
目前为止四氢吡喃化反应机理还没有明确的结论,本文参照文献[3,7-8,11]报道的催化机理,以Mn(MS)2为例,过渡金属甲基磺酸盐的催化机理可以通过Scheme 2进行解释。由于Mn(MS)2中Mn2+存在空轨道,可以与DHP配位形成1,活化了DHP,使DHP中氧原子的邻位碳电正性增强,有利于醇的亲核加成。同时醇羟基中氧的孤对电子也可以和Mn(MS)2进行配位,加速了醇和1的反应,形成了THP醚的过渡态2,过渡态在经过质子化后形成THP醚和Mn(MS)2, Mn(MS)2继续进行下一循环的催化。

在使用DCM时可以有效促进反应的速率和收率,这可能是由于DCM的极性很大,可以通过溶剂化作用使THP醚的过渡态稳定,从而使活化能降低,反应速率加快。

Scheme 2
3 结论
以过渡金属甲基磺酸盐为催化剂,确定了室温下醇的四氢吡喃化反应条件为:醇30 mmol,醇与DHP摩尔比为1.0 ∶1.1,催化剂用量1 mmol, DCM用量20 mL。其中Mn(MS)2和Cu(MS)2可以高效的完成多种醇的催化,并且重复催化5次,活性仍然较高。
[1] 郑时龙,尤庆祥,袁玲,等. 微波技术在药物合成反应中的应用研究──Ⅱ.无溶剂条件下酚羟基的甲基化反应[J].华西药学杂志,1997,12(3):166-167.
[2] 杨红,陶佩珍. 阿昔洛韦联合羟基脲抗疱疹病毒的研究[J].华西药学杂志,2005,20(5):401-404.
[3] Zadehahmadi F, Tangestaninejad S, Moghadam M,etal. Highly efficient protection of alcohols and phenols catalysed by tin porphyrin supported on MIL-101[J].Applied Organometallic Chemistry,2015,29(4):209-215.
[5] Sharif S K, Sirija M R, Ramudu B S,etal. Green synthesis of tetrahydropyranyl ethers of phenols in the presence of triethylamine in water as solvent[J].IOSR Journal of Applied Chemistry,2015,8(8):20-25.
[6] Shamzhy M V, Opanasenko M V, Francisca S O,etal. Post-synthesis incorporation of Al into germanosilicate ITH zeolites:The influence of treatment conditions on the acidic properties and catalytic behavior in tetrahydropyranylation[J].Catalysis Science & Technology,2015,5(5):2973-2984.
[7] Shirini F, Abedini M, Abkenar A N,etal. Sulfonic acid-functionalized ordered nanoporous Na+-montmorillonite(SANM) as an efficient and recyclable catalyst for the tetrahydropyranylation and detetrahydropyranylation of alcohols and phenols[J].Journal of Nanostructure in Chemistry,2014,4(1):1-6.
[8] Hajipour A R, Azizi G. Mild and efficient solvent-free tetrahydropyranylation(THP) of alcohols catalyzed by reusable acidic ionic liquid [Et3N(CH2)4SO3H][OTs][J].Iranian Journal of Catalysis,2014,4(3):213-218.
[9] Bodipati N, Palla S R, Komera V,etal. 3,5-Dinitrobenzoic acid catalyzed synthesis of 2,3-unsaturatedO-andS-glycosides and tetrahydropyranylation of alcohols and phenols[J].Tetrahedron Letters,2014,55(50):6878-6881.
[10] Kinfe H H, Mebrahtu F M, Moshapo P T. Solvent-free NaHSO4-SiO2-catalyzed efficient tetrahydropyranylation of alcohols and phenols[J].Synthetic Communications,2013,43(9):1237-1242.
[11] 徐亮,杨安卫,马宁. 氧化石墨催化醇和酚的四氢吡喃化保护与脱保护[J].有机化学,2013,33(09):2004-2009.
[12] Zareyee D, Alizadeh P, Ghandali M S,etal. Solvent-free acetylation and tetrahydropyranylation of alcohols catalyzed by recyclable sulfonated ordered nanostructured carbon[J].Chemical Papers,2013,67(7):713-721.
[13] Wang M, Song Z G, Jiang H. Three-component Mannich reaction of aromatic ketones,aldehydes and amines catalyzed by reusable aluminium methanesulfonate[J].Organic Preparations and Procedures International,2009,41(4):315-321.
[14] Wang M, Song Z G, Gong H,etal. Praseodymium methanesulfonate catalyzed one-pot synthesis of 3,4-dihydropyrimidin-2-(1H)-ones[J].Preparative Biochemistry & Biotechnology,2008,38(1):105-114.
[15] Jiang H. Reaction-controlled recovery of the copper(II) methanesulfonate catalyst for esterification[J].Reaction Kinetics and Catalysis Letters,2005,84(2):223-228.
[16] Morizur V, Szafranek J, Bonhomme D,etal. Catalysis of the acylation of aromatic derivatives by metallic tosylates[J].Tetrahedron,2015,71(38):6813-6817.
[17] Wang M, Wang Z C, Sun Z L,etal. Synthesis andcharacterization of transition metal methanesulfonates and their catalytic behavior in Biginelli reactions[J].Transition Metal Chemistry,2005,30(7):792-796.
[18] Su T T, Jiang H, Gong H. Thermal decomposition and dehydration kinetic studies on hydrated Co(II) methanesulfonate[J].Thermochimica acta,2005,435(1):1-5.
[19] Kobayashi S, Hachiya I. Lanthanide triflates as water-tolerant Lewis acids.Activation of commercial formaldehyde solution and use in the aldol reaction of silyl enol ethers with aldehydes in aqueous media[J].The Journal of Organic Chemistry,1994,59(13):3590-3596.
Tetrahydropyranylation of Alchols Catalyzed by Transition Metal Methylsulfonate
ZHU Qiang, GONG Hong, JIANG Heng*, WANG Rui
(College of Chemical and Material Science, Liaoning Shihua University, Fushun 113001, China)
Transition metal methylsulfonates[Mn(CH3SO3)2·2H2O, Cu(CH3SO3)2·4H2O, Co(CH3SO3)2·4H2O and Zn(CH3SO3)2·4H2O] were used to catalyze tetrahydropyranylation of alchols at room temperature. It was found that when alcohol dosage was 30 mmol, alcohol and 3,4-dihydropyran molar ratio was 1.0 ∶1.1, the amount of transition metal methanesulfonate was 1 mmol, in 20 mL dichloromethane, the tetrahydropyranylation of alcohols occurs efficiently. Comparing to Lewis acid, transition metal methanesulfonate exhibited better catalytic activity on tetrahydropyranylation of alcohols, and poor activity on tetrahydropyranylation of phenol. Using Mn(CH3SO3)2·2H2O or Cu(CH3SO3)2·4H2O as catalyst for tetrahydropyranylation ofn-butyl alcohol, the yield were 89% and 92% after five cycles, respectively.
transition metal methanesulfonate; alchol; tetrahydropyranylation; catalysis; synthesis
2016-01-05;
2016-08-31
辽宁省自然科学基金资助项目(201202122)
朱强(1991-),男,汉族,山东潍坊人,硕士研究生,主要从事有机合成的研究。 E-mail: 1131211001@qq.com
姜恒,教授, Tel. 0413-56860790, E-mail: hjiang78@hotmail.com
O643.3; O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16005
