新型苦参碱肟酯类化合物的合成
2016-11-19刘华文王坚毅王立升
刘华文, 张 森, 李 东, 刘 旭, 王坚毅, 王立升*
(1. 广西大学 化学化工学院,广西 南宁 530004; 2. 广西中医药大学 药学院,广西 南宁 530001)
·快递论文·
新型苦参碱肟酯类化合物的合成
刘华文1, 张 森2, 李 东1, 刘 旭1, 王坚毅1, 王立升1*
(1. 广西大学 化学化工学院,广西 南宁 530004; 2. 广西中医药大学 药学院,广西 南宁 530001)
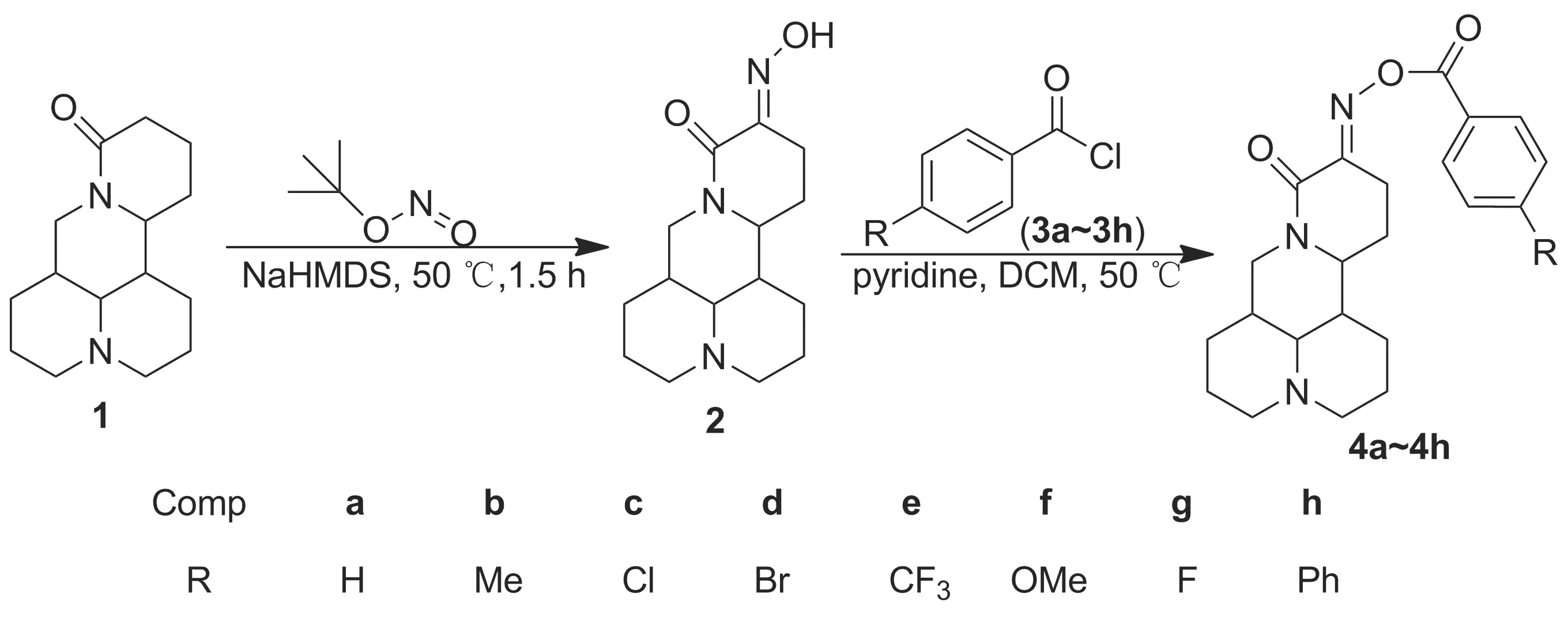
利用生物活性因子拼接法将活性基团肟酯引入植物源活性化合物苦参碱中对其结构进行修饰,以苦参碱为原料,与亚硝酸叔丁酯反应制得关键中间体肟(2); 2与苯甲酰氯类化合物经酯化反应合成了8个新型的苦参碱肟酯类化合物,其结构经1H NMR,13C NMR和MS表征。
苦参碱; 肟酯; 苯甲酰氯; 合成
苦参碱(1)是由豆科植物苦参Sophora flavescens Ait的干燥根、植株及果实经乙醇等有机溶剂提取制成的,属于生物碱,具有广泛的药理作用,如抗肿瘤、抗心律失常[1]、抗炎[2]及抗病毒等,临床上主要用于慢性病毒性肝炎的治疗,毒副作用小,疗效好[3]。然而1较低的生物利用度和对中枢神经系统有毒副作用等缺点限制了其临床应用[4-6]。
1还是一种应用广泛的天然植物源农药。目前,国内登记以苦参碱为主要活性的农药多达几十种,且母药含量高达5%[7]。
植物源农药,具有特定性、天然性的特点,只对特定的生物产生作用,在大自然中能迅速分解,最终产物为二氧化碳和水。其次1是对有害生物具有活性的植物内源化学物质,成分不是单一的,而是化学结构相近的多组和化学结构不相近的多组的结合,相辅相成,共同发挥作用。第三,1因为多种化学物质共同作用,使其不易导致有害物产生抗药性,能长期使用。第四,对相应的害虫不会直接完全毒杀,而是控制害虫生物种群数量不会严重影响到该植物种群的生产和繁衍。这种机理和在化学农药防护副作用凸显后经过多年研究得出的综合防治体系中有害生物控制的原则是十分近似的,说明苦参碱与一般高毒、高残留的化学农药有着明显区别,是十分绿色、环保的。
Scheme 1
肟作为一种重要的有机反应中间体,可以用来制备胺、酰胺、噁唑、吡啶、硝酮及肟酯等化合物,在研发中常被选为有效的活性基团,受到医药和农药行业的广泛关注[8]。
肟酯类化合物具有优良的杀虫、杀菌及除草活性,不少品种还具有低毒和低残留等优点。目前该类化合物的分子设计和合成以及生物活性是研究的热点,因其具有广泛的生物活性和多变结构类型而倍受人们的关注[9]。
本文采用生物活性因子拼合的方法对苦参碱进行结构修饰,设计并合成了一系列苦参碱衍生物,以期发现活性良好的化合物。以1为原料,与亚硝酸叔丁酯反应制得肟(2); 2与苯甲酰氯类化合物(3a~3h)经酯化反应合成了8个新型的苦参碱肟酯类化合物(4a~4h, Scheme 1),其结构经1H NMR,13C NMR和MS表征。
1 实验部分
1.1 仪器与试剂
AVANCE III HD 600 MHz型超导核磁共振仪(CDCl3为溶剂,TMS为内标);ThermoFisher型超高效液相-离子阱质谱联用仪。
所用试剂均为分析纯。
1.2 合成
(1) 2的合成
在反应瓶中依次加入1 1.24 g(5 mmol)和甲苯20 mL,搅拌下加入双(三甲基硅基)氨基钠5 mL,于室温反应10 min;加入亚硝酸叔丁酯3 mL,于50 ℃反应1.5 h(TLC检测)。冷却至室温,真空抽滤,滤液浓缩后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=1 ∶1]纯化得白色固体2 0.89 g,收率65%, m.p.148~153 ℃;1H NMRδ: 15.21(s, 1H), 4.32(dd,J=12.8 Hz, 4.4 Hz, 1H), 3.98(ddd,J=10.9 Hz, 7.8 Hz, 5.3 Hz, 1H), 3.24(t,J=12.8 Hz, 1H), 2.90~2.76(m, 2H), 2.66(ddd,J=15.4 Hz, 7.4 Hz, 3.9 Hz, 1H), 2.49(ddd,J=15.2 Hz, 10.9 Hz, 3.9 Hz, 1H), 2.32~2.20(m, 1H), 2.07~1.95(m, 2H), 1.90(dd,J=8.8 Hz, 6.9 Hz, 1H), 1.81~1.68(m, 4H), 1.66~1.55(m, 3H), 1.53~1.41(m, 3H), 1.33~1.21(m, 1H);13C NMRδ: 160.94, 142.68, 63.12, 57.08, 57.04, 53.09, 42.48, 41.36, 35.64, 27.57, 26.39, 26.04, 24.76, 20.99, 20.57; MSm/z: 278{[M+H]+}。
(2) 4a~4h的合成(以4a为例)
在反应瓶中依次加入2 1.0 g和二氯甲烷20 mL,搅拌使其溶解;加入吡啶0.5 mL,缓慢滴加10%苯甲酰氯(3a)的二氯甲烷(5 mL)溶液,滴毕,回流反应1.5 h(TLC检测)。依次用饱和碳酸氢钠溶液和水洗涤至pH 7,无水硫酸钠干燥,浓缩后用石油醚/乙酸乙酯重结晶得4a。
分别用3b~3h代替3a,用类似方法合成4b~4h。
4a: 淡黄色固体,收率55%, m.p.142~148 ℃;1H NMRδ: 12~8.06(m, 2H), 7.66~7.61(m, 1H), 7.50(dd,J=10.8 Hz, 4.9 Hz, 2H), 4.51(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.08(ddd,J=10.8 Hz, 8.0 Hz, 5.0 Hz, 1H), 3.28(t,J=12.8 Hz, 1H), 3.22(ddd,J=16.3 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.92~2.78(m, 2H), 2.75~2.63(m, 1H), 2.29(ddt,J=17.2 Hz, 7.3 Hz, 4.9 Hz, 1H), 2.01(dtd,J=15.0 Hz, 12.3 Hz, 2.8 Hz, 2H), 1.85(s, 3H), 1.78~1.70(m, 3H), 1.65(ddd,J=14.3 Hz, 9.1 Hz, 4.5 Hz, 1H), 1.61~1.53(m, 2H), 1.53~1.46(m, 3H);13C NMRδ: 162.89, 158.06, 157.85, 133.64, 129.80, 128.65, 128.55, 63.33, 57.12, 56.82, 52.72, 42.89, 42.38, 35.52, 27.56, 26.41, 23.36, 22.42, 21.04, 20.72; MSm/z: 382{[M+H]+}。
4b: 白色固体,收率53%, m.p. 146~154 ℃;1H NMRδ: 7.96(d,J=8.2 Hz, 2H), 7.27(d,J=8.8 Hz, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.05(ddd,J=10.9 Hz, 8.0 Hz, 5.1 Hz, 1H), 3.26(t,J=12.8 Hz, 1H), 3.18(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.89~2.77(m, 2H), 2.71~2.62(m, 1H), 2.43(s, 3H), 2.30~2.21(m, 1H), 1.99(dtd,J=14.9 Hz, 12.3 Hz, 2.7 Hz, 2H), 1.88(d,J=15.2 Hz, 2H), 1.83~1.77(m, 1H), 1.77~1.67(m, 3H), 1.67~1.61(m, 1H), 1.61~1.51(m, 2H), 1.51~1.42(m, 3H);13C NMRδ: 163.98, 158.14, 157.56, 144.53, 129.84, 129.36, 125.70, 63.33, 57.12, 56.82, 52.72, 42.89, 42.38, 35.52, 27.56, 26.41, 23.36, 22.42, 21.77, 21.04, 20.72; MSm/z: 396{[M+H]+}。
4c: 白色固体,收率49%, m.p.140~155 ℃;1H NMRδ: 8.04~7.98(m, 2H), 7.49~7.43(m, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.07(s, 1H), 3.28(t,J=12.7 Hz, 1H), 3.18(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.85(dd,J=31.8 Hz, 10.4 Hz, 2H), 2.74~2.65(m, 1H), 2.33~2.24(m, 1H), 2.04(s, 3H), 1.88(d,J=13.7 Hz, 1H), 1.82(d,J=9.5 Hz, 1H), 1.78~1.70(m, 3H), 1.69~1.62(m, 1H), 1.57(ddd,J=18.4 Hz, 9.5 Hz, 4.2 Hz, 2H), 1.53~1.45(m, 3H);13C NMRδ: 162.15, 157.97, 157.94, 140.24, 131.14, 129.06, 126.90, 63.28, 57.10, 56.88, 52.72, 42.92, 42.35, 35.51, 27.54, 26.40, 23.27, 22.42, 21.02, 20.69; MSm/z: 416{[M+H]+}。
4d: 淡黄色固体,收率40%, m.p.136~141 ℃;1H NMRδ: 7.93(d,J=8.5 Hz, 1H), 7.93(d,J=8.5 Hz, 1H), 7.63(d,J=8.5 Hz, 1H), 7.63(d,J=8.5 Hz, 1H), 4.49(d,J=9.5 Hz, 1H), 4.06(s, 1H), 3.27(t,J=12.4 Hz, 1H), 3.21~3.11(m, 1H), 2.91~2.74(m, 2H), 2.73~2.56(m, 1H), 2.25(t,J=16.2 Hz, 1H), 2.16(s, 1H), 2.01(t,J=18.4 Hz, 2H), 1.87(d,J=13.1 Hz, 1H), 1.80(s, 1H), 1.72(s, 4H), 1.64(d,J=10.4 Hz, 1H), 1.57(d,J=8.9 Hz, 2H), 1.48(s, 3H);13C NMRδ: 162.21, 158.06, 157.92, 131.69, 131.23, 128.91, 127.38, 63.31, 57.08, 56.77, 52.69, 42.87, 42.33, 35.46, 27.51, 26.36, 23.31, 22.44, 20.99, 20.66; MSm/z: 461{[M+H]+}。
4e: 白色固体,收率55%, m.p. 158~170 ℃;1H NMRδ: 8.19(d,J=8.2 Hz, 2H), 7.75(d,J=8.3 Hz, 2H), 4.48(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.07(ddd,J=10.9 Hz, 8.1 Hz, 5.1 Hz, 1H), 3.27(t,J=12.8 Hz, 1H), 3.19(ddd,J=16.3 Hz, 7.2 Hz, 4.3 Hz, 1H), 2.92~2.76(m, 2H), 2.69(ddd,J=16.0 Hz, 11.0 Hz, 4.7 Hz, 1H), 2.34~2.22(m, 1H), 2.04~1.96(m, 1H), 1.95(s, 2H), 1.87(d,J=13.6 Hz, 1H), 1.84~1.78(m, 1H), 1.78~1.69(m, 3H), 1.69~1.61(m, 1H), 1.60~1.52(m, 2H), 1.48(dq, J=6.9 Hz, 4.1 Hz, 3H);13C NMRδ: 161.78, 158.48, 157.78, 131.84, 130.18, 125.72, 125.69, 124.37, 63.27, 57.12, 57.11, 52.73, 42.92, 42.39, 35.51, 27.55, 26.41, 23.31, 22.52, 21.04, 20.71; MSm/z: 412{[M+H]+}。
4f: 淡黄色固体,收率45%, m.p.136~144 ℃;1H NMRδ: 8.03(t,J=5.7 Hz, 2H), 6.96(t,J=5.7 Hz, 2H), 4.49(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.05(ddd,J=11.0 Hz, 8.0 Hz, 5.1 Hz, 1H), 3.88(s, 3H), 3.25(t,J=12.7 Hz, 1H), 3.22~3.12(m, 1H), 2.83(dd,J=31.6 Hz, 10.9 Hz, 2H), 2.71~2.58(m, 1H), 2.32~2.19(m, 1H), 2.05~1.94(m, 2H), 1.89(s, 2H), 1.80(dd,J=16.9 Hz, 8.2 Hz, 1H), 1.76~1.68(m, 3H), 1.68~1.60(m, 1H), 1.55(ddd,J=19.0 Hz, 9.9 Hz, 4.4 Hz, 2H), 1.52~1.43(m, 3H);13C NMRδ: 161.78, 158.48, 157.78, 131.84, 130.18, 125.72, 125.69, 63.34, 57.14, 56.88, 55.53, 52.71, 42.88, 42.37, 35.53, 27.57, 26.43, 23.36, 22.36, 21.06, 20.74; MSm/z: 450{[M+H]+}。
4g: 淡黄色固体,收率49%, m.p.156~162 ℃;1H NMRδ: 8.14~8.07(m, 2H), 7.21~7.13(m, 2H), 4.50(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.12~4.04(m, 1H), 3.28(t,J=12.8 Hz, 1H), 3.19(ddd,J=16.4 Hz, 7.3 Hz, 4.3 Hz, 1H), 2.85(dd,J=31.5 Hz, 10.9 Hz, 2H), 2.73~2.62(m, 1H), 2.34~2.24(m, 1H), 2.02(dt,J=16.2 Hz, 12.0 Hz, 2H), 1.87(s, 2H), 1.83(d,J=11.9 Hz, 1H), 1.74(tdd,J=14.1 Hz, 10.2 Hz, 4.3 Hz, 3H), 1.64(dd,J=24.4 Hz, 10.1 Hz, 1H), 1.61~1.53(m, 2H), 1.53~1.45(m, 3H);13C NMRδ: 161.99, 157.98, 157.88, 132.44, 132.39, 116.01, 115.87, 63.30, 57.12, 56.89, 52.71, 42.92, 42.38, 35.52, 27.55, 26.41, 23.31, 22.42, 21.04, 20.71; MSm/z: 400{[M+H]+}。
4h: 淡黄色固体,收率52%, m.p.120~135 ℃;1H NMRδ: 8.17~8.11(m, 2H), 7.72~7.68(m, 2H), 7.66~7.59(m, 2H), 7.51~7.46(m, 2H), 7.44~7.38(m, 1H), 4.50(dd,J=12.8 Hz, 4.5 Hz, 1H), 4.10~4.03(m, 1H), 3.27(t,J=12.8 Hz, 1H), 3.22(m, 1H), 2.84(dd,J=32.1 Hz, 10.9 Hz, 2H), 2.75~2.64(m, 1H), 2.32~2.24(m, 1H), 2.00(dtd,J=14.9 Hz, 12.2 Hz, 2.6 Hz, 2H), 1.88(d,J=13.6 Hz, 1H), 1.81(dd,J=13.5 Hz, 10.0 Hz, 1H), 1.64(dd,J=15.4 Hz, 11.8 Hz, 4H), 1.64(dd,J=14.7 Hz, 11.1 Hz, 1H), 1.61~1.52(m, 2H), 1.48(dd,J=13.0 Hz, 4.5 Hz, 3H);13C NMRδ: 162.77, 158.07, 157.91, 146.42, 139.80, 134.71, 130.34, 129.01, 128.38, 127.32, 127.21, 63.35, 57.13, 56.95, 52.72, 42.88, 42.40, 35.52, 27.56, 26.42, 23.41, 22.47, 21.05, 20.72; MSm/z: 458{[M+H]+}。
2 结果与讨论
2.1 合成
(1) 2的合成
在2的合成中,因为双(三甲基硅基)氨基钠为强碱,与水会发生反应,生成氢氧化钠和六甲基二硅氮烷。水的存在会对苦参碱14-位上碳负离子的生成产生影响,从而导致产率的降低;所以该反应过程中所用甲苯需经无水处理。另外,用硅胶柱层析进行纯化时在展开剂中加入少量的三乙胺溶液,纯化的效果会得到很大的提高。
(2) 4的合成
在4的合成中,反应条件温和,副产物少,产率较高。吡啶作为缚酸剂,二氯甲烷作为溶剂,使后处理更加简单易行。4经浓缩后,用石油醚和乙酸乙酯重结晶,纯度得到显著提升。
(3) 肟酯类化合物的合成
在形成酯的反应中,酰化效果最佳。酰化试剂的酰化能力由强到弱依次为:酰氯、酸酐、酯、羧酸、酰胺。因此,在成酯反应中,采用酰氯。吡啶是一种常用的缚酸剂,本身结构相对稳定,且呈透明无水的溶液状态,不会对反应物与反应液造成影响,同时吡啶还起到催化作用,在酰氯和肟的反应中,吡啶中的氮原子起到亲核试剂,进攻酰氯中的羰基,形成了一个稳定的碳正离子(Scheme 2),从而加快了反应的进行。

Scheme 2
3 结论
以具有广泛生物活性的苦参碱为先导化合物,引入肟酯活性基团进行结构修饰改造,通过合成中间体苦参碱肟,然后和苯甲酰氯类化合物进行反应,合成了8个新的苦参碱肟酯类化合物,有关其活性研究正在进行中,有望在医药或农药领域得到应用。
该合成方法简单、反应条件温和、收率高等优点,为该类化合物的合成提供了参考。
[1] Li X L, Chu W M, Liu J L,etal. Antiarrhythmic proerties of long-ter,trestment with matrine in arrhythmic rat induced by coronary ligation[J].Biol Pharm Bull,2009,32(9):1521-1526.
[2] Zhang B, Liu Z Y, Li Y Y,etal. Antiinflammatory effects of matrine in LPS-induced acute lung injury in mice[J].Eur J Pharmacol,2011,44(5):573-579.
[3] 黄丹,赖玲. 苦参碱剂型的研究进展[J].广西医科大学学报,2014,31(6):1040-1042.
[4] 付海根,唐胜,李迎红,等. 新型12-N-取代苦参酸衍生物的合成及其抗结核活性[J].合成化学,2014,22(6): 739-743.
[5] 王立升,杨龙力,刘旭,等. 苦参碱磺胺类拼合物的合成[J].合成化学,2015,23(2):140-143.
[6] 艾静,高焕焕,何树庄,等. 苦参碱青蒿素和粉防己碱对豚鼠心室肌细胞胞浆钙的影响[J].中国药理学报,2001,22(6):512-515.
[7] 田然歌. 苦参碱植物源农药专利授权与产业化分析[J].农业科学与管理,2015,36(12):12-14.
[8] 孟献涛. 肟在有机合成中的一些应用[D].保定:河北大学,2009.
[9] Song B A, Liu X H, Yang S,etal. Synthesis and anticancer activity of 2,3,4-trimethoxyacetophenoxime ester containing benzothiazole moiety[J].Chin J Org Chem,2005,23(9):1236-1240.
Synthesis of Novel Matrine Oxime Ester Compounds
LIU Hua-wen1, ZHANG Sen2, LI Dong1,LIU Xu1, WANG Jian-yi1, WANG Li-sheng1*
(1. College of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China 2. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530001, China)
Matrine was modified by active functional group oxime esterviabiologically active factor splicing. The key intermediate oxime(2) was synthesized by oximic reaction of matrine withtert-butyl nitrite. Eight novel matrine oxime ester compounds were synthesized by esterification of 2 with benzoyl chloride analogs. The structures were characterized by1H NMR,13C NMR and MS.
matrine; oxime ester; benzoyl chloride; synthesis
2016-03-16;
2016-08-31
国家自然科学基金资助项目(21262005)
刘华文(1989-),男,汉族,广西平南人,硕士研究生,主要从事药物合成的研究。 E-mail: liuhuawen105@163.com
王立升,教授,博士生导师, E-mail: w_lsheng@163.com
O626.4
A
10.15952/j.cnki.cjsc.1005-1511.2016.10.16071
