多剂量水合氯醛溶液及糖浆剂微生物限度方法的建立及验证
2016-10-22王宁宁
石 珊, 金 霏, 王宁宁, 周 卓
(1中国医科大学附属第一医院药学部, 沈阳 110005; 2中国医药集团总公司, 北京 100088)
·药学研究·
多剂量水合氯醛溶液及糖浆剂微生物限度方法的建立及验证
石珊1, 金霏1, 王宁宁1, 周卓2
(1中国医科大学附属第一医院药学部, 沈阳110005;2中国医药集团总公司, 北京100088)
目的建立水合氯醛溶液及糖浆剂的微生物限度检查法并对中国医科大学附属第一医院药学部生产的水合氯醛溶液及糖浆剂进行检查。方法按照《中国药典》(2010版)规定,采用薄膜过滤法检查水合氯醛溶液样品和糖浆剂样品在常温和冷藏条件下放置0、7、14、28 d时微生物的生长情况。结果水合氯醛溶液及糖浆剂均具有抑菌活性,各菌薄膜过滤法回收率均>70%,能有效地去除其抑菌活性,水合氯醛溶液及糖浆剂样品在冷藏和常温下保存28 d时微生物检查结果均合格。结论用薄膜过滤法进行微生物限度检查可以客观反映药物中微生物的污染情况,能够满足日常快速准确的检验。
水合氯醛溶液; 水合氯醛糖浆; 薄膜过滤法; 微生物限度检查
水合氯醛作为临床常用的镇静催眠药,用药过程安全平稳,口服起效迅速,给药方式多样,催眠效果好,不良反应少。其在医疗机构内不仅应用于成人的镇静催眠,也被广泛用于儿科的检查和治疗中[1]。由于溶液剂对消化道黏膜有轻微刺激,味道苦涩,口感差,因此常用于成人口服或儿童肛门给药。为了使患儿更易接受,中国医科大学附属第一医院制备有水合氯醛糖浆剂,可以掩盖水合氯醛的不良气味,改善口感。因此,应对不同的患者的需求,我院制备有10%水合氯醛溶液和10%水合氯醛糖浆剂2种水合氯醛制剂。水合氯醛本身具有抑菌活性[2],目前常规采用直接接种法、培养基稀释法等检验方法[3-4],能受到药物自身的抑菌作用的影响,干扰微生物限度检查结果,故本研究依据《中国药典》(2010 年版)二部[5]的附录XI J《微生物限度检查法》中验证要求,采用薄膜过滤法分别建立水合氯醛溶液及糖浆剂的微生物限度检查方法用于验证,并应用于样品的检验。
1 材料与方法
1.1实验药品、仪器和菌种大肠埃希菌〔CMCC(B)44102〕,金黄色葡萄球菌〔CMCC(B)26003〕,白色念珠菌〔CMCC(F)98001〕,枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63501〕,黑曲霉菌(Aspergilus niger)〔CMCC(F)98003〕,营养琼脂培养基(批号:1309272北京三药科技开发公司),改良马丁琼脂培养基(批号:121015北京三药科技开发公司),隔水式恒温培养箱(细菌)(上海新苗GNP-9080BS-Ⅲ),霉菌培养箱(上海博讯NJX-250B-Z),高压蒸汽灭菌器(上海申安SYQ-DSX-280B),振荡器(常州国华HY-2),菌落计数器(Galazy230),电子天平(上海光正YP10002),洁净工作台(苏州安泰SW-CJ-IBU),大容量电动移液器(EP03490),麦氏比浊管(泰生物 YZB/浙温0167-2012),水合氯醛〔玉龙海藻有限公司 批号(20141001)〕,单糖浆〔自制批号(20141201)〕。
1.2实验方法
1.2.1样品的制备精密称取水合氯醛10 g,溶于100 mL容量瓶中,配制成水合氯醛浓度为10%的溶液,过滤,转移至100 mL棕色磨口瓶中备用。精密称取水合氯醛10 g,加入适量水溶解于100 mL容量瓶中,加入单糖浆65 mL,配制成水合氯醛浓度为10%的糖浆剂,过滤,转移至100 mL棕色磨口瓶中备用。
1.2.2菌液制备菌液制备 按照《中国药典》(2010版)二部[2]的附录XI J《微生物限度检查法》方法制备金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌和黑曲霉菌液,备用。
1.2.3供试品溶液制备取供试品10 mL,加pH 7.0 无菌氯化钠-蛋白胨缓冲液90 mL,混匀,为1∶10 的供试液。
1.2.4微生物计数方法学验证采用薄膜过滤法进行3次独立的平行试验。供试品对照组:在pH 7.0 无菌氯化钠-蛋白胨缓冲液加入10 mL 的供试液,配制成100 mL溶液,混匀,过滤,冲洗滤膜。试验组:方法同供试品对照组,于最后1 次冲洗液中滴入1 mL试验菌液。菌液组:在pH 7.0 无菌氯化钠-蛋白胨缓冲液加入1 mL菌液,配制成100 mL溶液,混匀,过滤,冲洗滤膜。稀释剂对照组: 取稀释剂10 mL代替供试液,其余方法同供试品对照组。按规定时间培养,取出滤膜,菌面朝上贴于琼脂培养基平板上培养,逐日观察结果并测定菌数。
回收率计算:试验组菌回收率=(试验组菌落数-供试品对照组菌落数)/菌液组菌落数×100%,稀释剂对照组回收率=(稀释剂对照组菌落数-供试品对照组菌落数)/菌液组菌落数×100%。
1.2.5控制菌检查方法验证试验组:取10 mL供试液和上述含10~100 cfu大肠埃希菌试验菌1 mL,滴入盛有100 mL BL培养基的三角瓶中,培养24 h。阴性对照组:取10 mL pH 7.0 无菌氯化钠-蛋白胨缓冲液,加入盛有100 mL 胆盐乳糖培养基的三角瓶中,自培养24 h 。培养后将三角瓶中的培养物划线在麦康凯琼脂培养基上,培养18 h后观察结果。结果显示,试验组检出了大肠埃希菌而阴性对照组未检出,说明可采用薄膜过滤法对本品进行控制菌(大肠埃希菌)检查。
1.2.6样品测定方法采用上述验证后的薄膜过滤法,分别对冷藏和常温条件下模拟常规情况(每日开启3次)的10%水合氯醛溶液和10%水合氯醛糖浆剂进行测定微生物限度检查。
2 结果
2.1微生物限度方法验证结果使用薄膜过滤法进行各菌回收率测定,水合氯醛溶液的各菌回收率为80.9%~116.0%;糖浆剂各菌回收率为75.9%~108.0%,均>70%,说明这两种制剂的细菌、霉菌及酵母菌计数可采用薄膜过滤法,见表1、表2。
2.2样品测定结果10%水合氯醛溶液和10%糖浆剂在未添加防腐剂时,在冷藏或常温条件下放置28 d时微生物检查结果合格,说明配制后的多剂量水合氯醛制剂可以在冷藏和常温下放置28 d(表3~5)。
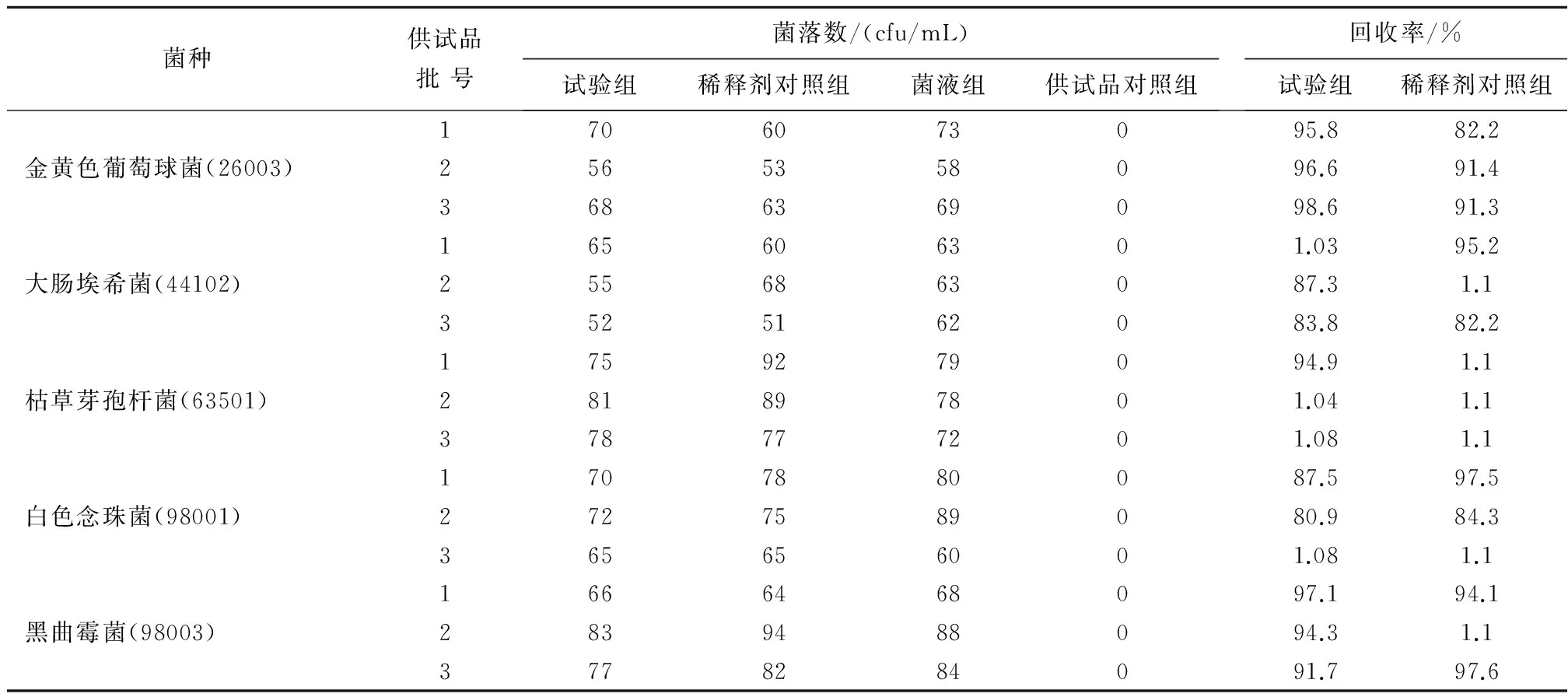
表1 水合氯醛溶液薄膜过滤法方法学验证结果
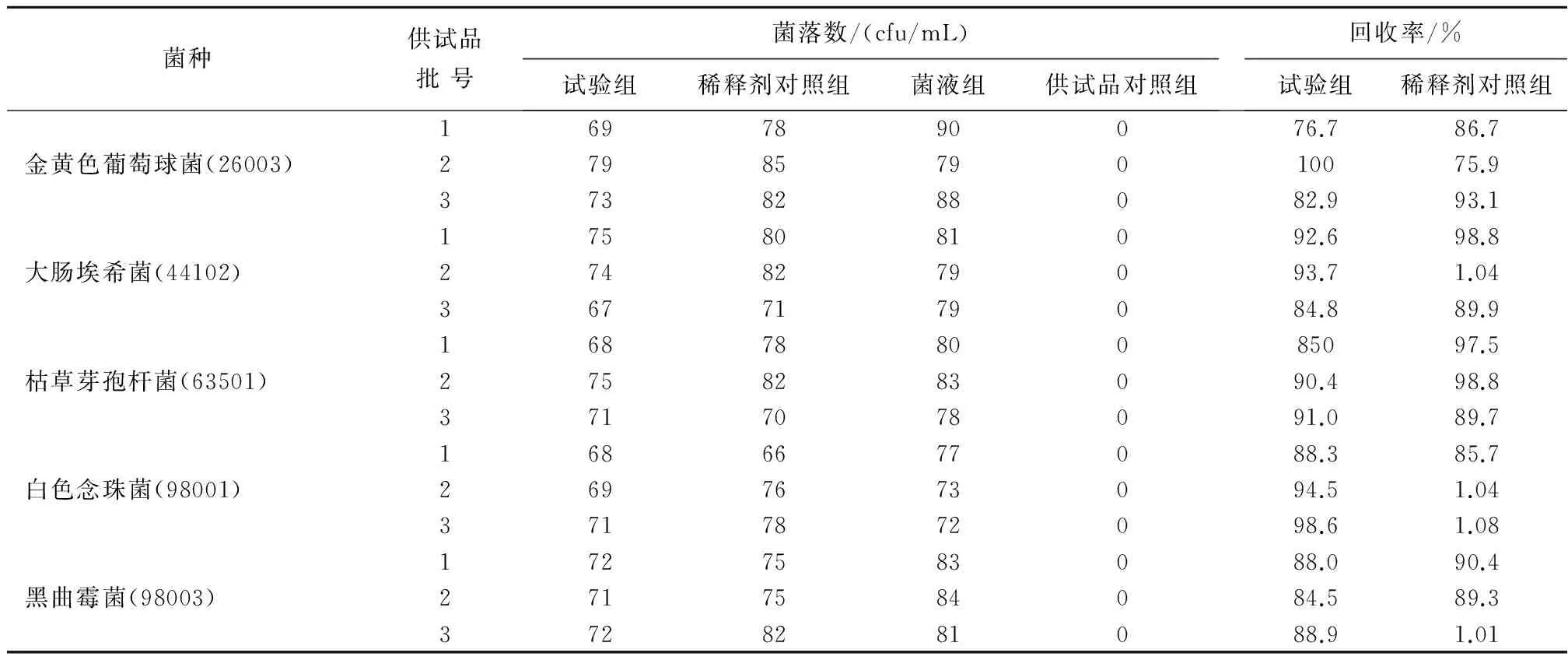
表2 水合氯醛糖浆剂薄膜过滤法方法学验证结果
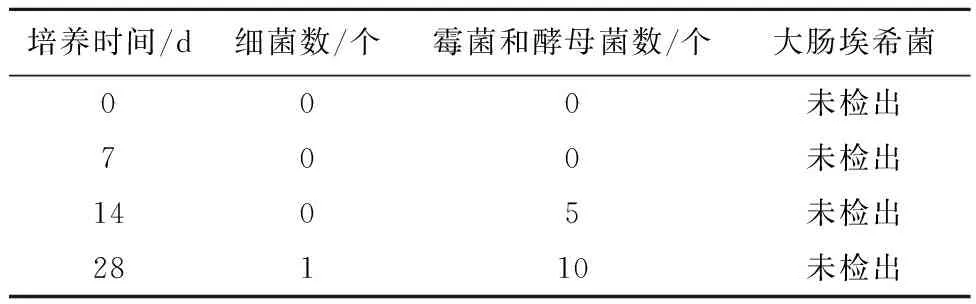
表3 冷藏条件下不同时间水合氯醛溶液样品测定结果

表4 常温条件下不同时间水合氯醛溶液样品测定结果

表5 冷藏条件下不同时间水合氯醛糖浆剂样品测定结果

表6 常温条件下不同时间水合氯醛糖浆剂样品测定结果
3 讨论
初晓等[2]报道:水合氯醛对于金黄色葡萄球菌的最低抑菌浓度为 6.25×103g/mL,最低杀菌浓度为 6.25×103g/mL。水合氯醛自身的杀菌作用,使配制的溶液不易受细菌感染,在不加任何防腐剂的情况下,在实验测定的时间内不生长细菌和霉菌。水合氯醛在光照、热、遇酸、碱都会降解,自身的浓度受到影响[6-9],抑菌效果也不同。本实验采用薄膜过滤法,去除了药物自身的抑菌作用的影响,建立的方法简便、准确。
医疗机构内常用的水合氯醛制剂为多剂量剂型,配制后溶液需多次开启,而多次开启也容易造成制剂的污染。为使实验结果更贴近真实情况,本实验在对样品进行检查时模拟每天开启3次容量瓶,使得结果更贴近实际情况。
[1]柯辉,雷美容,马晓玉.水合氯醛儿科临床应用新进展[J].护理研究,2011,25(11):3022-3024.
[2]初晓,刘爱明,李伟.水合氯醛对大肠杆菌金黄色葡萄球菌抗菌效能的测定[J].中国药师,2003,6(7):415.
[3]杜建红,张国庆,方晨,等.水合氯醛合剂微生物限度检查的验证[J].中国执业药师,2014,11(5):21-23.
[4]区洁雯,吕锦俊.水合氯醛糖浆微生物限度检查方法的验证[J].中国药房,2014,25(21):1998-2000.
[5]国家药典委员会. 中华人民共和国药典(2010 年版)二部[S].北京:化学工业出版社,2010:附录XI J.
[6]赵可新,徐列兵.水合氯醛合剂中水合氯醛稳定性考察试验[J].医学理论与实践,2005,18(1):4-5.
[7]刘佳,姜清华,杨跃辉.水合氯醛溶液稳定性考察[J].实用药物与临床,2013,16(8):720-721.
[8]张华,石磊.水合氯醛溶液中主成分稳定性考察[J].中国药师,2014,17(1):168-169.
[9]赵蕾,唐辉,袁天荣,等.水合氯醛糖浆生产工艺的研究[J].现代中药研究与实践,2014,28(4):38-40.
(本文编辑杨晨晨)
The establishment and validation of microbial limit test with chloral hydrate solution and chloral hydrate syrup in multi-dose bottles
SHI Shan1, JIN Fei1, WANG Ningning1, ZHOU Zhuo2
(1DepartmentofPharmacy,theFirstAffliatedHospitalofChineseMedicalUniversity,Shenyang110005,China;2ChinaNationalPharmaceuticalGroupCorporation,Beijing100088,China)
ObjectiveTo establish and verify the microbial limit test for chloral hydrate solution and chloral hydrate syrup. MethodsIn accordance with Chinese Pharmacopoeia (2010 Edition), membrane filtration method was used to examine microbial growth of the samples on the 0 d, 7 d, 14 d, 28 d, in the condition of room temperature and cold storage. ResultsChloral hydrate solution and chloral hydrate syrup had antimicrobial activity, the recovery rates of membrane filtration method were higher than 70%,which could effective eliminate the antibacterial activity. And the microbial examination results were qualified for the preservation of the chloral hydrate solution and chloral hydrate syrup for 28 d in room temperature or cold storage. ConclusionThe membrane filtration method can be used for the microbial limit test, which can directly show the condition of bacterial contamination of drugs so as to achieve the purpose of test.
chloral hydrate solution; chloral hydrate syrup; membrane filtration method; microbial limit tests
中国医科大学附属第一医院药学部科研专项基金(20140305)
石珊(1981-),女,硕士,主管药师,研究方向:临床药学及药物制剂学,E-mail: shshcmu@163.com。
R286.0
A
1009-5551(2016)10-1299-04
10.3969/j.issn.1009-5551.2016.10.021
2016-08-03]
