吐鲁番锦鸡儿地上部分化学成分及体外抗肿瘤活性研究
2016-10-22独孤佳秀胡亚雯李雪征贾晓光
独孤佳秀, 潘 兰, 姜 哲, 金 美, 胡亚雯, 李雪征, 贾晓光
(1延边大学附属医院药学部,吉林 延吉 133000; 2延边大学药学院, 吉林 延吉 133002;3新疆维吾尔自治区中药民族药研究所, 乌鲁木齐 830002)
吐鲁番锦鸡儿地上部分化学成分及体外抗肿瘤活性研究
独孤佳秀1,2, 潘兰3, 姜哲1, 金美1, 胡亚雯1,2, 李雪征1,2, 贾晓光3
(1延边大学附属医院药学部,吉林 延吉133000;2延边大学药学院, 吉林延吉133002;3新疆维吾尔自治区中药民族药研究所, 乌鲁木齐830002)
目的研究吐鲁番锦鸡儿地上部分的化学成分及其体外抗肿瘤活性。方法采用正相、反相硅胶柱色谱及制备型HPLC进行分离纯化,根据波谱数据鉴定化合物结构;应用A549、Hela 2种人癌细胞系,采用MTT法评价乙醇提取物的抗肿瘤活性。结果从吐鲁番锦鸡儿地上部分的乙醇总提取物中分离鉴定出6种化合物,分别为4′-O-甲基紫铆查尔酮(Ⅰ)、β-谷甾醇(Ⅱ)、3-O-甲基山奈酚(Ⅲ)、3-O-甲基槲皮素(Ⅳ)、3-O-甲基山奈酚-7-O-β-D-葡萄糖苷 (Ⅴ)、3-O-甲基槲皮素-7-O-β-D-葡萄糖苷(Ⅵ);乙醇总提取物对A549及Hela均有显著的抑制作用。结论吐鲁番锦鸡儿具有较强的体外抗肿瘤活性,Ⅵ为首次从该属植物分离得到的化合物,化合物IⅠ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ为首次从该植物中分离得到。
吐鲁番锦鸡儿; 化学成分; 分离, 结构鉴定; 体外抗肿瘤活性
吐鲁番锦鸡儿(Caragana turfanensis Kom.)为豆科(Leguminesae)锦鸡儿属(Caragana Fabr.)植物,生长于海拔2 100 m的山坡、河流阶地、峭壁,分布于伊犁地区、塔里木盆地、吐鲁番盆地[1]。锦鸡儿属植物的根部、花、种子、果实、全草皆可入药,多数以根部为主[2]。锦鸡儿根又名白心皮、金雀花根、板参,味甘、微辛,性平,归肺、脾经,具有健脾强胃、活血通乳、利尿通经功效,民间主要用于治疗虚热劳损、阴虚喘咳、淋浊白带等[3]。研究表明,吐鲁番锦鸡儿根中可能含有生物碱、甾体、黄酮、有机酸、萜类、蛋白质等多种成分[4],潘兰等[5]报道吐鲁番锦鸡儿的根与地上部分具有类似的化学成分,说明其有一定的药用价值和开发前景。关于吐鲁番锦鸡儿化学成分及药理活性的研究尚未见报道。本研究首次对吐鲁番锦鸡儿地上部分的化学成分采用正相及反相硅胶柱层析等分离,并根据光谱数据鉴定其结构,探索乙醇总提取物的体外抗肿瘤活性。
1 仪器与材料
1.1仪器与试剂核磁共振仪(瑞士Bruker,AV-300),暗箱式紫外分析仪(上海宝山顾村电光仪器厂,ZF-20C),高效液相色谱仪(天津Bonna-Agela,FL-LC050),GF254薄层层析硅胶、柱层析硅胶(青岛海洋化工厂,200-300目、300~400目),ODS制备型色谱柱(YMC)(北京慧德易科技有限责任公司),细胞培养箱、酶标仪(Thermo Scientific),净化工作台(上海新苗医疗器械公司),倒置生物显微镜(厦门Motic公司)。试剂乙醇、甲醇、石油醚、乙酸乙酯、二氯甲烷均为国产分析纯,胎牛血清、0.25%胰蛋白酶、青霉素100 U/mL、链霉素100 μg/mL(美国Gibco公司)、阿霉素(上海源叶生物科技有限公司)、DMSO(美国Sigma公司)、DMEM培养液(Themor公司产品)、MTT(美国Sigma公司)。
1.2药材与细胞株吐鲁番锦鸡儿采于新疆克尔克孜州,经过王果平副研究员鉴定为吐鲁番锦鸡儿(Caragana turfanensis Kom.),凭证标本均存放于新疆中药民族药研究所。 细胞系A549(人类肺腺癌细胞)、Hela(人类宫颈癌细胞)均购于美国菌种保藏中心(ATCF, Manassas,VA, USA)。
2 方法与结果
2.1提取方法称取干燥吐鲁番锦鸡儿地上部分10.00 kg,干燥后粉碎,加入95%乙醇回流提取3次,合并提取液,减压回收溶剂得乙醇提取物950.51 g。将浸膏加适量水混悬,依次用石油醚、乙酸乙酯、正丁醇进行梯度萃取,将不同极性萃取物减压回收溶剂,得到石油醚萃取物(47.55 g)、乙酸乙酯萃取物(144.10 g)、正丁醇萃取物(202.12 g)。
2.2分离方法取吐鲁番锦鸡儿地上部分乙酸乙酯萃取物,采用正相硅胶柱层析分离,用二氯甲烷-甲醇(100∶0~0∶100)进行梯度洗脱,TLC检识,合并相同组分得馏分Fr.1~Fr.9。将Fr.2用硅胶柱层析分离,用石油醚-乙酸乙酯梯度洗脱得化合物Ⅰ、Ⅱ。Fr.6用硅胶柱层析分离,以二氯甲烷-甲醇梯度洗脱得化合物Ⅲ、Ⅳ。将Fr.8用反相硅胶以甲醇-水进行反复洗脱得6个馏分Fr.8-1~ Fr.8-6,采用制备型高效液相色谱对Fr.8-4进行分离,使用混合流动相(甲醇-水比例为4∶6,流速3 mL/min)洗脱,得到化合物Ⅴ、Ⅵ。
2.3结构鉴定
2.3.1化合物Ⅰ浅黄色粉末(CH3OH),1H-NMR (300 MHz, CH3OD) δ ppm: 7.54 (1H, d, J=19.0 Hz, Hβ), 7.45 (1H, d, J=15.0 Hz, Hα), 6.27 (1H, dd, J=9.0 Hz, 2.4 Hz, H-5′), 6.22 (1H, d, J=2.4 Hz, H-3′), 7.00 (1H, s, H-2), 6.97 (1H, d, J=8.9 Hz, H-6), 6.75 (1H, d, J=8.9 Hz, H-5)。13C-NMR (75 MHz, CH3OD) δ ppm: 63.8 (3-OCH3), 102.5 (C-6′), 106.2 (C-5′), 114.1 (C-5), 114.8 (C-2), 115.6 (C-1′), 121.4 (C-6), 125.6 (C-1),145.1 (Cβ),145.6 (Cα), 147.3 (C-3),148.5 (C-4),166.7 (C-2′, 4′), 181.1 (C=O)。该化合物的波谱数据与参考文献[6]中报道的4′-O-甲基紫铆查尔酮一致,故鉴定其为4′-O-甲基紫铆查尔酮。
2.3.2化合物Ⅱ白色针状结晶(CH2Cl2),1H-NMR (300 MHz, CDCl3) δ ppm: 5.35 (1H, J=4.2, 0.6 Hz, dd, H-6), 3.51 (1H, m, H-3), 2.25 (2H, d, H-4), 1.00 (3H, s, H-19), 0.92 (3H, d, J=6.3 Hz, H-21), 0.85 (3H, t, H-29), 0.82 (3H, d, J=6.3 Hz, H-27), 0.80 (1H, s, H-26), 0.68 (3H, s, H-18)。13C-NMR (75 MHz, CDCl3) δ ppm: 12.0 (C-18), 12.1 (C-29), 19.0 (C-21), 19.2 (C-27), 19.6 (C-19), 20.0 (C-26), 21.2 (C-11), 23.2 (C-28), 24.5 (C-15), 26.2 (C-23), 28.4 (C-16), 29.3 (C-25), 31.81 (C-2), 32.1 (C-8, 12), 34.1 (C-22), 36.3 (C-20), 36.7 (C-10), 37.4 (C-1), 39.9 (C-7), 42.5 (C-4, 13), 46.0 (C-24), 50.3 (C-9), 56.2 (C-17), 56.9 (C-14), 72.0 (C-3), 141.0 (C-5), 121.9 (C-6)。数据与文献[7]报道相符,确定该化合物为β-谷甾醇 (β-sitosterol)。2.3.3化合物Ⅲ淡黄色粉末(CH3OH),1H-NMR (300 MHz, CH3OD) δ ppm: 3.76 (3H, s, -OCH3), 6.18 (1H, d, J=2.0 Hz, H-6), 6.38 (1H, d, J=2.0 Hz, H-8), 6.91 (2H, d, J=8.9 Hz, H-3′, H-5′), 7.96 (2H, d, J=8.9 Hz, H-2′, H-6′)。13C-NMR (75 MHz, CH3OD) δ ppm: 60.5 (3-OCH3), 94.8 (C-8), 99.8 (C-6), 105.9 (C-10), 116.5 (C-3′, 5′), 122.2 (C-1′), 131.4 (C-2′,6′), 139.4 (C-3) 158.0 (C-2), 158.4 (C-9), 161.7 (C-4′), 163.6 (C-5), 165.9 (C-7), 180.0 (C-4)。数据与文献[8]的3-O-甲基山奈酚(3-O-methylkaempferol)一致,故鉴定该化合物为3-O-甲基山奈酚。
2.3.4化合物Ⅳ黄色粉末(CH3OH),1H-NMR (300 MHz, CH3OD) δ ppm: 3.77 (3H, s, -OCH3), 6.18 (1H, d, J=2.0 Hz, H-6), 6.37 (1H, d, J=2.0 Hz, H-8), 6.89 (1H, d, J=8.5 Hz, H-5′), 7.51 (1H, dd, J=2.2 Hz, 8.5 Hz, H-6′), 7.61 (1H, d, J=2.1 Hz, H-2′)。13C-NMR (75 MHz, CH3OD) δ ppm: 60.5 (3-OCH3), 94.7 (C-8), 99.7 (C-6), 105.9 (C-10), 116.4 (C-2′), 116.5 (C-5′), 122.3 (C-6′), 122.9 (C-1′), 139.5 (C-3), 146.5 (C-3′), 149.9 (C-4′), 158.0 (C-2), 158.4 (C-9), 163.1 (C-5), 165.9 (C-7), 180.0 (C-4)。数据与高海峰等[9]报道的一致,确定该化合物为3-O-甲基槲皮素(3-O-methoxylquercetin)。
2.3.5化合物Ⅴ黄色粉末(CH3OH),1H-NMR (300 MHz, CH3OD) δ ppm: 3.79 (3H, s, -OCH3), 5.06 (1H, d, J=6.3 Hz), 6.48 (1H, d, J=1.7 Hz, H-6), 6.80 (1H, d, J=1.7 Hz, H-8), 6.92 (2H, d, J=8.7 Hz, H-3′, H-5′), 8.01 (2H, d, J=8.7 Hz, H-2′, H-6′)。13C-NMR (75 MHz, CH3OD) δ ppm: 60.5 (3-OCH3), 62.5 (C-6″),71.3 (C-4″), 74.7 (C-2″), 77.8 (C-3″), 78.4 (C-5″), 95.8 (C-8), 100.8 (C-6), 101.6 (C-1″), 107.7 (C-10), 116.6 (C-3′, 5′), 122.4 (C-1′), 131.6 (C-2′, 6′), 139.7 (C-3), 158.0 (C-2), 158.6 (C-9), 161.9 (C-4′), 162.8 (C-5), 164.7 (C-7), 180.2 (C-4)。数据与文献[10]中的一致,确定该化合物为3-O-甲基山奈酚-7-O-β-D-葡萄糖苷(3-O-methyl kaempferol -7-O-β-D- glucoside)。
2.3.6化合物Ⅵ黄色颗粒状粉末(CH3OH),1H-NMR (300 MHz, CH3OD) δ ppm: 3.80 (3H, s, -OCH3), 6.49 (1H, d, J=2.0 Hz, H-6), 6.76 (1H, d, J=2.0 Hz, H-8), 6.90 (1H, d, J=8.5 Hz, H-5′), 7.55 (1H, dd, J=1.3 Hz, 7.4 Hz, H-6′), 7.65 (1H, d, J=1.3 Hz, H-2′)氢信号提示该化合物具有槲皮素母核,与文献[9]的结果相比较,H-6、H-8均向低场移动,推断可能有糖与C-7位相连。13C-NMR (75 MHz, CH3OD) δ ppm: 60.5 (3-OCH3), 62.5 (C-6″), 71.3 (C-4″), 74.7 (C-2″), 77.9 (C-3″), 78.4 (C-5″), 95.8 (C-8), 100.8 (C-6), 101.7 (C-1″), 107.6 (C-10), 116.4 (C-2′), 116.7 (C-5′), 122.5 (C-1′,6′), 139.8 (C-3), 146.5 (C-3′), 150.0 (C-4′), 158.0 (C-2), 158.6 (C-9), 162.8 (C-5), 164.7 (C-7), 180.1 (C-4)。结合文献数据[11-12],确定该化合物为3-O-甲基槲皮素-7-O-β-D-葡萄糖苷(3-O-methyquercetinl-7-O-β-D-glucoside)。
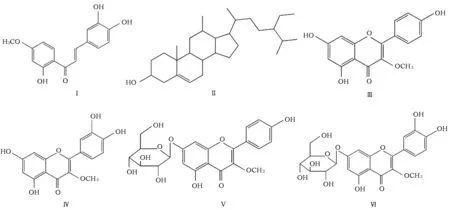
图1 吐鲁番锦鸡儿地上部分植物分离得到的化合物结构
2.4体外抗肿瘤活性测试MTT法测试吐鲁番锦鸡儿地上部分总提取物的活性。吐鲁番锦鸡儿地上部分乙醇提取物用DMSO溶解,用DMEM培养液稀释至终浓度为12.5、25、50、100、200 μg/mL进行实验。DMSO配制样品时,其终浓度为0.1%,阳性对照物为阿霉素(doxorubicin),浓度为10 μM。取对数生长期的A549、Hela细胞,调整细胞悬液浓度为5×104个/mL,接种于96孔培养板中,200 μL/孔,培养于37℃、5%CO2的培养箱内,24 h后加入待测样品。分别设空白组、给药组和阳性对照组,每组设3个复孔,药物干预24 h后每孔加MTT溶液(终浓度为0.5 mg/mL),继续培养4 h后吸弃上清液,振摇10 min充分溶解紫色甲臜结晶,经酶标检测仪在570 nm 波长处测定吸光度OD值,以空白组为细胞存活率100%,抑制率为0,计算各组细胞的抑制率。
细胞抑制率(%)=(1-药物组OD值/正常对照组OD值)×100%。
2.5MTT实验结果吐鲁番锦鸡儿地上部分乙醇提取物对A549、Hela细胞显示较强的抑制活性(图2)。100 μg/mL的总提取物对A549、Hela细胞抑制率分别为53.69%、58.52%,而50 μg/mL的总提取物即可显著抑制Hela细胞生长。
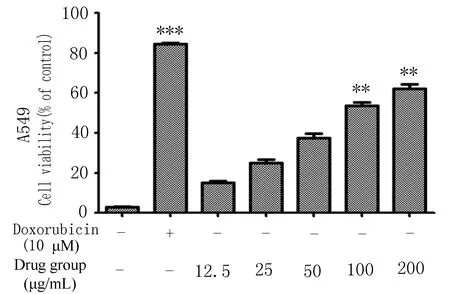
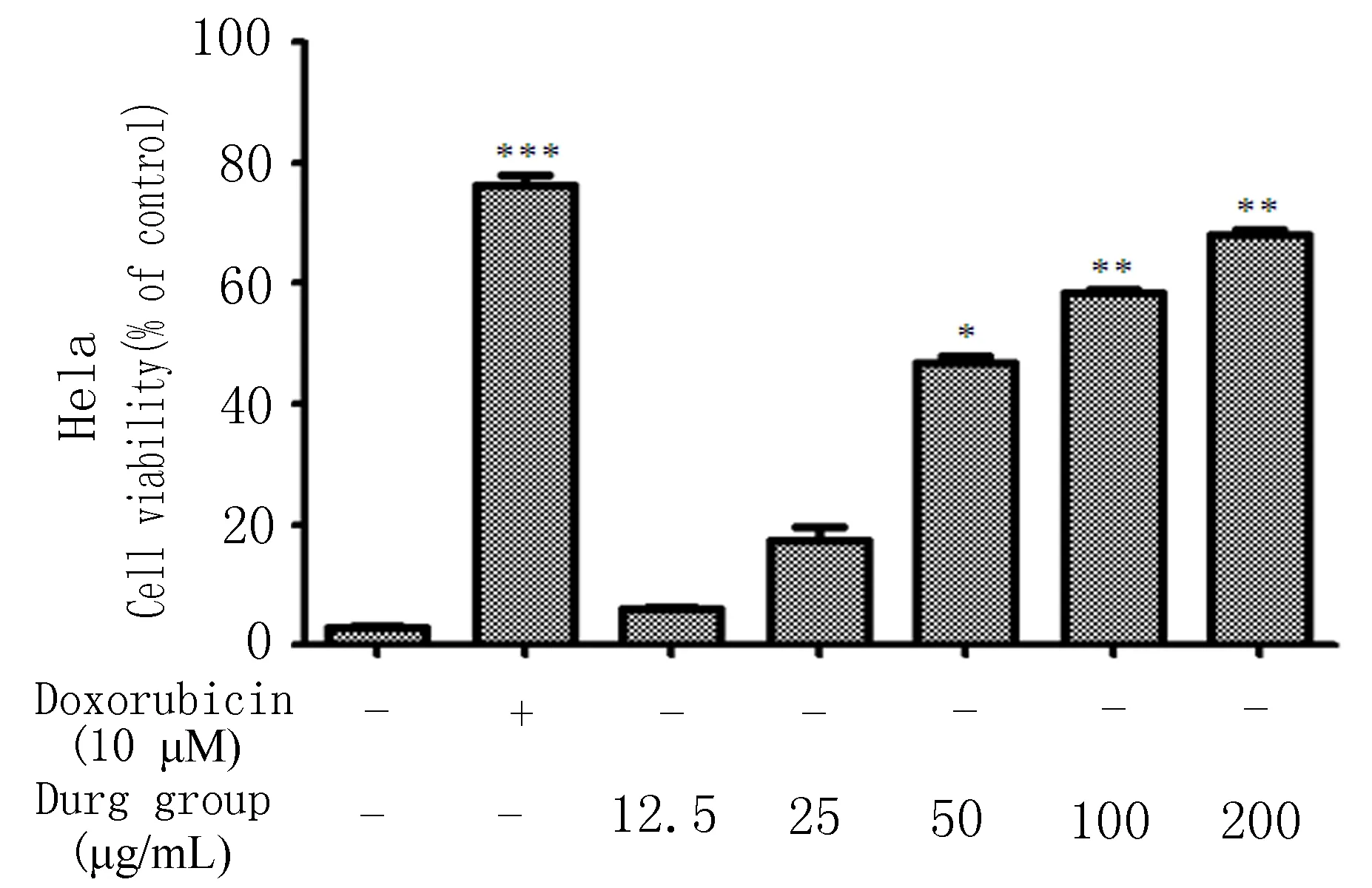
图2 吐鲁番锦鸡儿地上部分乙醇提取物对A549、Hela细胞的影响
3 结论
吐鲁番锦鸡儿作为传统民间药材,具有潜在的开发利用价值。本研究首次对吐鲁番锦鸡儿地上部分进行了化学成分的初步研究及体外抗肿瘤活性的探讨。从中分离鉴定了6种化合物,化合Ⅵ从该属植物中首次分离,Ⅰ、Ⅱ、Ⅲ、Ⅳ及Ⅴ是从该植物中首次分离得到的成分。本研究还明确了吐鲁番锦鸡儿地上部分对A549及Hela细胞具有显著抑制作用,为其后续的化学成分及药理活性的研究提供了一定的理论基础。
[1]潘兰,贾新岳,石明辉,等.新疆产四种锦鸡儿的民族植物学调查[J].中国现代中药,2013,15(7):578-579.
[2]霍炎,秦路平,郭澄,等.锦鸡儿属植物在传统医药中的应用[C].全国第六届天然药物资源学术研讨会论文集,西安:2004:186-189.
[3]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1986:1019.
[4]邱殿光,潘兰,力瓦衣丁·买合苏提,等.吐鲁番锦鸡儿根化学成分初步研究[J].新疆农业科学,2014,51(5):963-966.
[5]潘兰,贾岳新,力瓦衣丁·买合苏提,等.吐鲁番锦鸡儿根与地上部分化学成分比较[J].时珍国医国药,2014,25(12):3056-3057.
[6]朱娜.柳叶鬼针草黄酮类成分与生物活性研究[D].长春:吉林大学,2009.
[7]Consolacion YR, Virgilio DE, Nancy LL, et al. Chemical constituents of Hypnea nidulans Setchell [J]. Der Pharma Chem, 2015,7 (10):473-478.
[8]Park CH, Kim KH, Lee IK, et al. Phenolic constituents of Acorus gramineus [J]. Arch Pharm Res,2011,34(8): 1289-1296.
[9]高海峰,郑兵兵,王蓟花,等.白皮锦鸡儿黄酮醇类化合物及其抗菌和抗氧化活性[J].天然产物研究与开发,2011,23(23):853-856.
[10]Luo C, Wang A, Wang X, et al. A new proline-containing flavonol glycoside from Caragana leucophloea Pojark[J]. Nat Prod Res,2015,29 (19):1811-1819.
[11]曹园,瞿慧,姚毅,等.鬼针草化学成分研究[J].中草药,2013,44 (24):3435-3439.
[12]Du K, Marston A,Vuuren SF, et al. Flavonolacyl glucosides from the aril of Schotia brachypetala sond and their antioxidant,antibacterial and antimalarial activities[J].Phytochem Lett,2014,10(4):123-128.
(本文编辑周芳)
Studies on the chemical constituents and antitumor activity of the aboveground part of Caragana turfanensis in vitro
DUGU Jiaxiu1,2, PAN Lan3, JIANG Zhe1, JIN Mei1, HU Yawen1,2, LI Xuezheng1,2, JIA Xiaoguang3
(1DepartmentofPharmacy,YanbianUniversityHospital,Yanji133000,China;2YanbianUniversityCollegeofPharmacy,Yanji133002,China;3XinjiangInstituteofChineseMaterialandEthnodrug,Urmqi, 830002,China)
ObjectiveTo study the chemical constituents and antitumor activities in vitro of the aboveground part of Caragana turfanensis (Krassn.) Kom. MethodsThe constituents were separated and purified by normal silica gel, reversed-phase silica gel column chromatography and preparation HPLC, and the structures were identified on the basis of spectral data. Using MTT assay, the antitumor activities of the ethanol extract in vitro were tested against A549 and Hela human cancer cell lines. Results6 compounds were yielded, and the structures were identified as 4′-O-Butein (Ⅰ), β-sitosterol (Ⅱ), 3-methylkaempferol (Ⅲ), 3-methoxylquercetin (Ⅳ), 3-O-methyl kaempferol-7-O-β-D-glucoside (Ⅴ), 3-O-methyquercetinl-7-O-β-D-glucoside (Ⅵ). The ethanol extract showed the significant antitumor activities against the above two cancer cell lines. ConclusionCaraganaturfanensisshows significant antitumor activity in vitro. Compound Ⅵ is firstly isolated from Caragana Fabr., and the compounds Ⅰ, Ⅱ, Ⅲ, Ⅳ are Ⅴ were isolated from this plant for the first time.
Caraganaturfanensis; chemical constituents; separation; identification; antitumor activities in vitro
国家自然科学基金-新疆联合基金(U1203202);新疆维吾尔自治区重点实验室开放课题(XJDX0201-2013-02)
独孤佳秀(1991-),女,在读硕士,研究方向:天然药物活性成分研究。
李雪征,女,副主任药师,硕士生导师,研究方向:天然药物活性成分研究,E-mail: xuezheng1977@163.com。
通信作者:贾晓光,男,研究员,硕士生导师,研究方向:中药民族药,E-mail:xgjia@vip.sina.com。
R28
A
1009-5551(2016)10-1226-04
10.3969/j.issn.1009-5551.2016.10.003
2016-04-28]
