蒜素与大豆蛋白源巯基肽的二硫键结合物的制备及其表征
2016-10-21陈海桥张彩猛华欲飞孔祥珍
陈海桥,张彩猛,华欲飞,孔祥珍
(江南大学 食品学院,江苏 无锡,214122)
蒜素与大豆蛋白源巯基肽的二硫键结合物的制备及其表征
陈海桥,张彩猛,华欲飞,孔祥珍*
(江南大学 食品学院,江苏 无锡,214122)
蒜素与谷胱甘肽等多肽中的半胱氨酸残基以二硫键形式结合被认为是葱属植物发挥其体内生理活性的第一步。蒜素和巯基肽体外均不稳定,制备蒜素与巯基的结合物有利于稳定发挥二者的生理活性。在制备还原或未还原大豆球蛋白、酶解物及其富集的巯基肽基础上,研究了蒜素与大豆蛋白源巯基肽的二硫键结合物的制备条件。结果表明:反应温度在24 ℃,反应pH 7.0,蒜素∶巯基摩尔浓度比=5∶4,反应时间1h条件下最佳,巯基反应完成度均达到95%以上。相同条件,还原后的蛋白比未还原的蛋白反应完成度更大。在最佳条件下,制得相应的产物,并对反应前后结合HPLC、MS-MS进行了一定表征,证明了结合物的结构。
蒜素;巯基肽;制备;表征
流行病学研究证明长期食用葱属植物(AlliumsativumL.)能降低许多人类疾病的风险[1],这主要归功于其体内的有机硫化物,即大蒜素(二烯丙基硫代亚磺酸酯)及其他硫代亚磺酸酯类[2]。大蒜素是由大蒜破碎后,由体内蒜氨酸裂解酶(Alliinase, EC 4.4.1.4)催化蒜氨酸裂解形成[3]。蒜素具有诸多生理功效,如抑菌、抗真菌;抑制胃癌、肠癌、前列腺癌[4]。然而,蒜素在体外极不稳定,在20 ℃经20 h后几乎完全分解为各种硫化物[5],这极大地限制了其利用价值。
生物活性实验表明,蒜素的生理功效源于其巯基修饰反应,在体内易和谷胱甘肽、蛋白质在内的半胱氨酸残基反应生成二硫键结合物。蒜素这些可能的代谢产物与葱属植物的生理活性相关[7]。ZHANG等证明蒜素的巯基二硫键结合物GSSA、CySSA 具有诱导细胞QR酶表达,抑制NO释放的功效[8]。JOSPEDRAZA-CHAVERR发现,CySSA能改善小鼠体内因庆大霉素所致的肾中毒及氧化和亚硝基化应激[9]。
巯基肽主要有谷胱甘肽、植物螯合肽、金属硫蛋白、抗菌肽,以及从蛋白酶解物中分离得到的肽。大豆球蛋白经水解制备的大豆多肽营养价值高,易消化,富含半胱氨酸残基,具有显著的抗氧化性、自由基清除、解毒作用[6]。富集的巯基肽段半胱氨酸残基不稳定、需保存在酸性低温环境,不利于生产与长期保存。
蒜素与小分子游离巯基如GSH反应迅速,受pH影响较大,RABINKOV报道[10]反应米氏常数K= 3.0 M-1s-1。目前尚无对蒜素和蛋白及多肽反应条件的报道,而这对于相应二硫键结合物的制备,以及后续通过产物活性证明蒜素可能发挥活性的机制有重要作用。本研究制备了大豆蛋白源的球蛋白,并通过还原、酶解、富集等方法制备了一系列巯基肽。其中以11S蛋白、以11S源富集的巯基肽为代表研究了蒜素和蛋白质及多肽的反应条件,并以巯基转化率对反应完成率进行了表征。
1 材料与方法
1.1材料
1.1.1原料与试剂
低脱脂豆粕,山东禹王集团;半胱氨酸(Cys),谷胱甘肽(GSH),4,4-二硫二吡啶(DPS),烯丙基溴,胃蛋白酶(4 000 U/mg),均购自Sigma公司;乙腈为色谱纯,购自J&K;C18填料购自Merck;巯丙基-琼脂糖 6B填料,购自GE Healthcare;其余试剂均为国产分析纯。
1.1.2仪器与设备
高效液相色谱仪1260系列带紫外检测器(variable wavelength detector,VWD)、ZORBAX SB C18色谱柱,美国Agilent科技有限公司;高速冷冻离心机,日本 Hitachi 公司;UV-Vis-2450型紫外可见分光光度计;DELTA320 pH计,METTLER TOLEDO(上海)。
1.2实验方法
1.2.1蒜素的制备
蒜氨酸参照CORBI[11]氧化脱氧蒜氨酸制得,脱氧蒜氨酸参照YU[12]通过半胱氨酸与烯丙基溴反应制得。蒜素通过蒜酶催化分离而得。
1.2.2大豆球蛋白(11S)的提取
采用碱溶酸沉法制备大豆球蛋白。将脱脂豆粕分散在含10 mmol/L 2-巯基乙醇的30 mmol/L pH 8.0的Tris-HCl缓冲液中,豆粕和缓冲液比例1∶10(g∶mL)。搅拌1.5 h后3层纱布过滤,取上清液,于9 500 r/min,4 ℃离心30 min。将上清液pH值调至6.2,在9 500 r/min,4 ℃离心30 min。得到的沉淀分散在水中,调节pH 6.2,5 000 r/min,4 ℃离心20 min,重复2~3次。将得到的沉淀分散于水中,调节pH 8.0,冷冻干燥即为11S。
1.2.3巯基肽的制备
用8 mol/L尿素溶液溶解5% 11S,加入30 mmol/L DTT,40 ℃还原1~2 h,还原完后调节pH 2.0,用pH 2.0的水进行透析2~3 d,期间换水8~10次,即得还原11S。
以还原/未还原的11S为原料,经循环水浴调节温度至37 ℃后预热搅拌15 min,调pH至2.0。分别加入胃蛋白酶(E/S=2%)进行恒温酶解,酶解过程中不断搅拌,用标准盐酸维持pH值恒定。酶解6 h,然后95 ℃水浴灭酶5 min,离心取上清,冻干即得水解物RHP/HP。
参考DING[13]取还原后的水解物RHP,经巯丙基-琼脂糖 6B富集巯基肽,经C18柱纯化分离出含巯基的肽段EP。
1.2.4蒜素和巯基肽结合物的制备
配制一定浓度的含大豆蛋白源巯基肽的水溶液,调节pH为2.0、3.0、4.0、7.0、8.0,固定反应温度4、15、24、40 ℃,控制巯基肽的巯基含量恒定,添加不同量的蒜素水溶液,使最终反应蒜素和巯基浓度摩尔比为0、0.125、0.5、0.75、1、1.25、1.5,控制反应时间0、5、15、30、60、120 min,测定反应过程巯基含量的变化。同时设置空白对照,即不加蒜素溶液,以扣除巯基氧化对巯基含量的损失。制备过程如图1。反应完成率按式(1)计算。

(1)
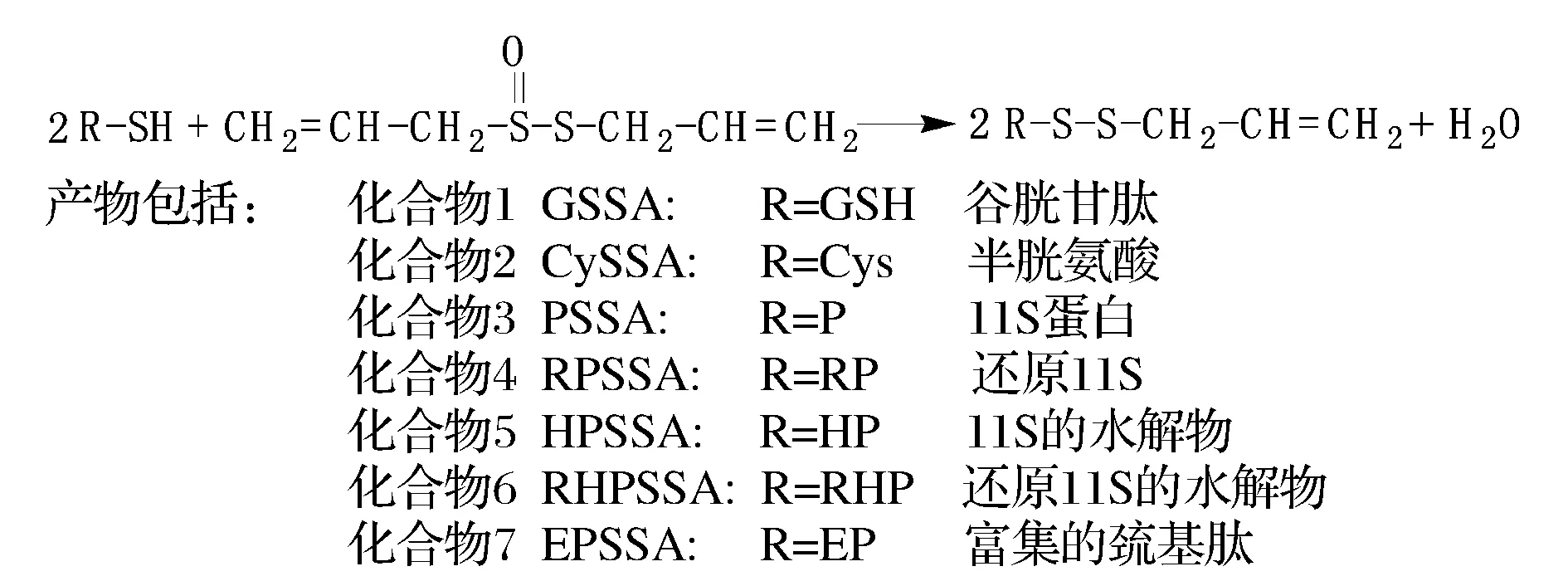
图1 蒜素与巯基的制备Fig.1 Preparation of conjugates between allicin and thiols
1.2.5巯基含量的测定
参照RIENER等[14]的方法采用DPS法测定酶解物巯基含量,配制一定浓度的样品,取0.2 mL,加入2.8 mL含有6 mol/L GuHCl,1 mmol/L EDTA的100 mmol/L pH 4.5 醋酸-醋酸钠缓冲液,加入125 μL的4 mmol/L DPS,室温反应30 min,测定A324。
1.2.6液相色谱条件
色谱柱:Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm);柱温:35 ℃;紫外检测器检测波长:214 nm;流动相A:超纯水(含TFA体积分数为0.1%),流动相B:纯乙腈(含TFA体积分数为0.1%)。流速设为1 mL/min,采用梯度洗脱:初始95% A;0~60 min,线性变换为40% A;60~65 min,线性变换为0%A;65~70 min,线性变换为95% A;70~75 min,维持95% A。流速:1 mL/min;进样量:20 μL。
1.2.7质谱分析
电喷雾离子化源,离子方式 ES+,毛细管电压 3.50 kV,锥孔电压20 V,离子源温度 110 ℃,脱溶剂气温度 400 ℃,碰撞能量 20 eV,质量范围 50~1 000 m/z,脱溶剂气流速 500 L/h。
1.2.8核磁共振(NMR)分析
取蒜素纯样品溶于氘代三氯甲烷,30 ℃ 下进行1H-NMR、13C-NMR 结构鉴定。实验仪器采用 Varian INOVA-600(600 MHz and 150 MHz,美国 Varian 公司)和AV-300(300 MHz和 75 MHz,瑞士 Bruker 公司)核磁仪。
1.3数据统计分析
研究中,所有实验均重复3 次以上,实验数据用(均数±标准差)表示,采用Excel 2007 作图。
2 结果与讨论
2.1TS(蒜素)的表征
分别采取HPLC、ESI-MS-MS、1H-NMR、13C-NMR验证了所制得蒜素的结构与纯度。其中,电喷雾离子化质谱离子碎片结果见图2。

图2 蒜素的离子碎片Fig.2 Ion fragments of allicin
蒜素的分子式为C6H10OS2,分子质量为162,它在质谱图中它的基准峰是m/z 163.05 [M+H]+,与此同时还有一系列的特征离子碎片产生。主要特征离子碎片有m/z 120.99 [M-C3H5]+,102.98 [M-C3H7O]+,87.00 [M-C2H3OS]-,73 [M-C3H5OS]+。
HPLC结果如图3,峰面积结果表明蒜素纯度大于97%。
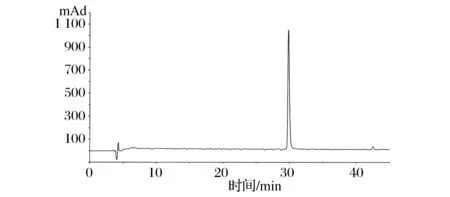
图3 蒜素的HPLC谱图Fig.3 The HPLC spectrum of allicin
此外,对TS进行了1H-NMR、13C-NMR表征,结果如下:
1H-NMR (400MHz, CDCl3, δ/ppm):δ3.7~3.9(4H, m,H4a、H4b、H3a、H3b);δ5.2~5.5(4H, m, H1a、H1b、H6a、H6b); δ5.85~6.65(2H, m,H2&H5)。
13C-NMR (100 MHz, CDCl3, δ/ppm):35.02 (C3, SCH2CH), 59.84 (C4, CHCH2SO), 119.05 (C1, CHCH2), 124.02 (C6, CH2CH), 125.82 (C2, CH2CHCH2), 132.90 (C5, CH2CHCH2)。
2.2反应温度对巯基与TS反应的影响
配制一定浓度11S、RP、EP水溶液,固定反应pH 7.0,分别控制温度在4、15、24、40 ℃下反应,反应比例为TS和巯基浓度比为理论摩尔比1∶2,反应一定时间,测定反应体系中剩余的巯基含量,同时设置空白对照,即不加TS,以扣除巯基氧化对巯基含量的损失。测定反应前后巯基含量变化。
如图4-A、图4-C、图4-D分别为不同温度下11S、RP、EP与蒜素反应的完成率,可以看出,1h内,24 ℃和40 ℃下反应基本完成,而4 ℃和15 ℃仍在进行,反应随着温度的上升,进行的速度和程度均增大。相比40 ℃,24 ℃反应比其慢,但是反应60min,二者反应程度相当。考虑到40 ℃温度过高,对巯基和TS 的稳定性均不利,因此,最佳反应温度为常温24 ℃。
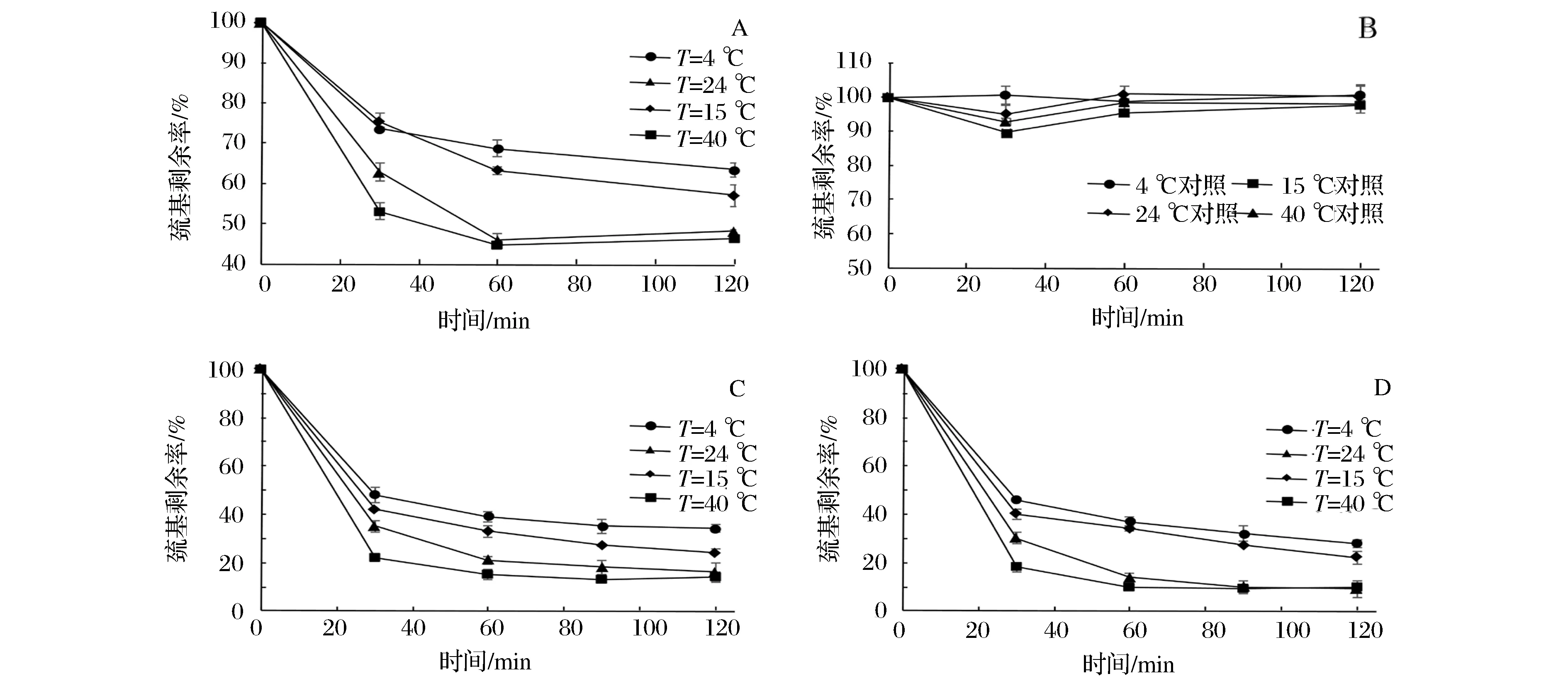
图4 温度对巯基与蒜素反应的影响Fig.4 Effect of different temperatures on reaction between 11S and allicin
其次,经过还原处理的RP和EP在相同条件下,反应完成率比11S大得多。如图图4-B为不同温度下11S与蒜素反应的空白对照,即不添加TS反应时11S自身氧化产生的巯基损失。图4中可以看出,在反应时间范围内,各温度条件下巯基损失很小。
2.3pH值和反应时间对巯基与TS反应的影响
大豆球蛋白(11S)富含半胱氨酸残基,来源广泛,后续巯基肽均由其还原/水解制备得到,因此选用11S作为巯基来源代表,与TS进行反应以研究不同因素的影响。11S等电点在5~6之间,因此选取pH范围为2.0、3.0、4.0、7.0、8.0,固定反应温度24 ℃,反应TS和巯基浓度比为理论摩尔比1∶2,分别反应0、5、15、30、60、120 min,测定反应体系中剩余的巯基含量,同时设置空白对照,即不加TS,以扣除巯基氧化对巯基含量的损失。
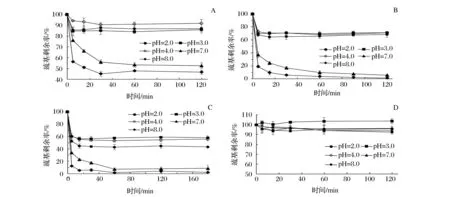
图5 pH值对不同巯基与蒜素反应的影响Fig.5 Effect of different pH on reaction between thiols and allicin
图5-A、图5-B、图5-C分别为不同pH值对大豆球蛋白11S、巯基肽EP、还原球蛋白RP与蒜素反应的影响。图5-D为11S与蒜素反应的空白对照,即不加蒜素时巯基损失。以11S为例,从图5-A中可以看出,相同条件下,酸性条件反应进行的速度和程度均小于碱性条件,反应完成度由小到大分别为pH 4.0<2.0<3.0<7.0<8.0。可能是因为更接近等电点,蛋白质聚集程度大,不利于反应的进行。
而碱性条件下巯基-二硫键交换反应更易进行,因此反应速度和完成率均大于酸性条件。这是因为蒜素与巯基化合物反应的过程中,巯基键能较弱,容易失去 H,同时大蒜素中的亚砜基又极易捕捉 H,因此大蒜素中的-S(O)S-键极易与巯基中的 H 结合,生成新物质。而碱性条件下,-S(O)S-键更易发生断裂,同时巯基中S2-的pka值更大,浓度更高,更易攻击硫代亚磺酸基团。
其次,理论上pH 8.0条件下巯基更容易氧化和交换,7.0下反应速度和完成率已经接近pH 8.0,且7.0更符合水解物的贮藏pH。因此,选取pH 7.0作为反应pH。
另外,图5-A、图5-B、图5-C对比可以看出,在相同条件下,未经还原的11S比经过还原的RP及EP反应完成率要小,这是因为蒜素更容易接触到还原后蛋白的游离巯基的结果。
2.4反应时间对巯基与TS反应的影响
反应时间在60 min,反应完成率基本恒定,巯基损失很小,有利于巯基全部与TS以二硫键形式结合(见图5-D)。
2.5蒜素与巯基物质摩尔浓度比对巯基与TS反应的影响
分别选取5种不同的巯基来源:11S、还原11S(RP)、11S水解物(HP)、还原11S水解物(RHP)、富集的巯基肽(EP),调节pH 7.0。控制巯基浓度相同,改变TS的添加量以控制不同的蒜素与巯基物质摩尔浓度比([TS]/[R-SH])0、0.125、0.5、0.75、1、1.25、1.5,在24 ℃下进行反应60 min;测定反应体系中剩余的巯基含量。

图6 不同蒜素和巯基比例下对不同巯基来源与蒜素反应的影响Fig.6 Effect of different ratios of TS/R-SH on reaction of different sourcing of peptides
图6可以看出,随着[TS]/[R-SH]摩尔比增加,反应完成率逐渐增加,其中Cys和GSH作为最简单的巯基来源之一,与蒜素反应呈直线形式,严格按照摩尔浓度比[TS]/[R-SH]=1∶2进行。其余巯基来源主要区分为还原和未还原,未还原的11S及其水解物HP在[TS]/[R-SH]摩尔比=5∶4时,各种巯基均能很完全地与TS 反应,因此[TS]/[R-SH]=5∶4是最佳比例;还原的11S即RP及其水解产物RHP和巯基肽EP基本在[TS]/[R-SH]摩尔比=1∶1时能达到最大完成度。显然,增加蒜素的比例,有助于蒜素攻击巯基,从而在相同条件达到更大的完成率。
2.6不同巯基来源对巯基与TS反应的影响
经过还原后的蛋白RP因为其疏水结构被打开,巯基暴露出来,相比未还原的11S,相同比例的TS,在pH 7.0下,反应1h,明显RP反应完成度更大(见图6)。原因是因为还原后,TS更容易接触到游离巯基。
而相比RP,被水解后的RP即RHP,因其肽段更小,理论上在相同的[TS]/[R-SH]下,巯基过量时,其反应完成度可能会大些,从图6可以看出,RHP与TS反应的完成率在各个比例下比RP大,却并不显著。可能是因为实验本身是固定相同巯基浓度,而水解后对于巯基与TS的反应影响不大,因为还原后巯基很容易与TS反应,5 min后,在pH 7.0时反应的完成度已经很接近最终完成度(见图5)。
其次,在低TS浓度下,大致表现出[TS]/[R-SH]摩尔比接近于1∶2,说明在最佳条件下,就还原的巯基来源,包括RP、RHP、EP,其反应完成率差异不大。
综上,得出蒜素与巯基反应的最佳条件为:反应温度24 ℃,反应pH 7.0,反应比例蒜素∶巯基(摩尔浓度比)=5∶4,反应时间1 h。
2.7蒜素与巯基二硫键结合物的表征
2.7.1半胱氨酸与蒜素反应的表征
如上述结果,配制一定浓度的Cys水溶液和TS水溶液,在最佳条件下反应1 h,反应结束用二氯甲烷洗涤残余未反应TS两遍,用氮气吹去残余二氯甲烷,进液相,结果见图7。
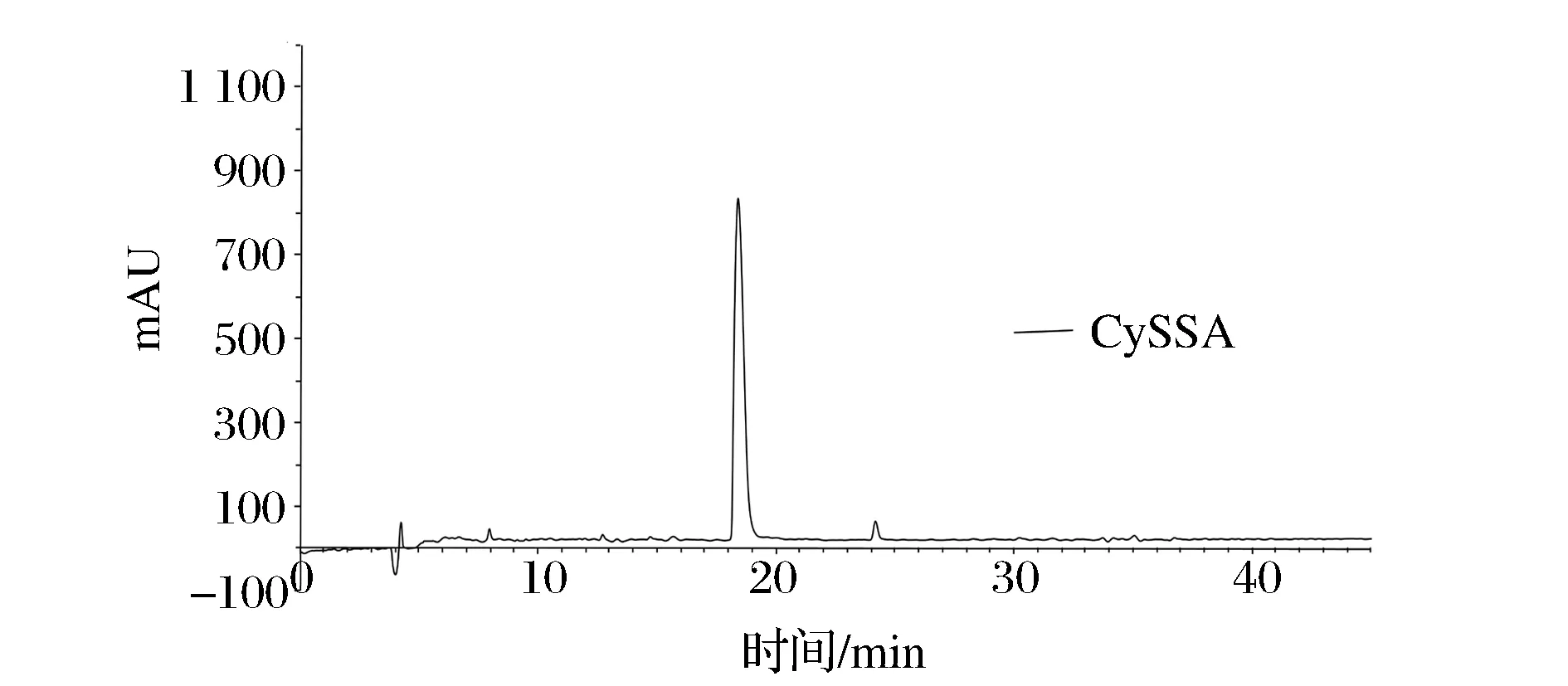
图7 CySSA的HPLC谱图Fig.7 The HPLC spectrum of CySSA
如图8所示,所制得CySSA纯度>97%,理论分子质量为193,对应的质谱结果基准峰为m/z=194.06 [M+H]+,与文献一致[8]。即所得产物为CySSA。

图8 CySSA的离子碎片Fig.8 Ion fragments of CySSA
2.7.2巯基肽(EP)与蒜素反应的表征
按最佳反应条件使EP与TS反应,制备EPSSA,并用二氯甲烷洗涤两遍除去残余TS,得到无TS的EPSSA-D,进液相,图9为EP反应前后的液相色谱图。
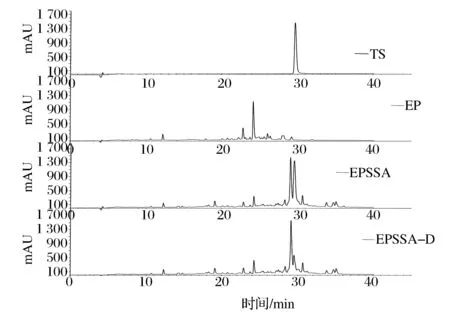
图9 巯基肽与蒜素反应前后的HPLC谱图Fig.9 The HPLC spectrum of reaction between EP and allicin
巯基肽EP实质上是许多含有巯基的多肽片段,所以C18分离出许多极性不同的肽段,与TS反应后,由于烯丙基基团与多肽以二硫键形式结合,疏水性增大,表现为峰形整体右移,如图9所示。经二氯甲烷处理后,残余TS消失,而峰形整体无变化,说明EPSSA的疏水分布并未受二氯甲烷影响。
3 结论
制备大豆11S蛋白及其还原和水解产物,得到了一系列含巯基的多肽,制备了蒜素,研究了反应pH、反应时间、反应温度、反应蒜素和巯基比例、不同巯基来源对巯基与蒜素反应的影响。结果表明,在反应pH 7.0,反应温度24 ℃,蒜素∶巯基摩尔浓度比=5∶4,反应时间1 h条件下最佳,巯基反应完成度均达到95%以上。此外,对反应前后的巯基及其二硫键结合产物进行了一定表征,结果显示,结合后疏水性增加,液相峰形整体右移。
[1]GALEONE C, PELUCCHI C, LEVI F, et al. Onion and garlic use and human cancer [J]. The American Journal of Clinical Nutrition, 2006, 84(5):1 027-1 032.
[2]ROSE P, WHITEMAN M, MOORE P K, et al. Bioactive S-alk (en) yl cysteine sulfoxide metabolites in the genus Allium:the chemistry of potential therapeutic agents [J]. Natural Product Reports, 2005, 22(3):351-68.
[3]STOLL A, SEEBECK E. Chemical investigations on alliin, the specific principle of garlic [J]. Advances in Enzymology and Related Areas of Molecular Biology, 2006,11:377-400.
[4]CHEN C, PUNG D, LEONG V, et al. Induction of detoxifying enzymes by garlic organosulfur compounds through transcription factor Nrf2:effect of chemical structure and stress signals [J]. Free Radical Biology and Medicine, 2004, 37(10):1 578-1 590.
[5]BRODNITZ M H, PASCALE J V, VAN DERSLICE L. Flavor components of garlic extract [J]. Journal of Agricultural and Food Chemistry, 1971, 19(2):273-275.
[6]王金艳. 大豆球蛋白酶解物的抗氧化性及巯基肽的制备 [D].无锡:江南大学, 2014.
[7]MIRON T, LISTOWSKY I, WILCHEK M. Reaction mechanisms of allicin and allyl-mixed disulfides with proteins and small thiol molecules [J]. European Journal of Medicinal Chemistry, 2010, 45(5):1 912-1 918.
[8]ZHANG G, PARKIN K L. A tissue homogenate method to prepare gram-scale Allium thiosulfinates and their disulfide conjugates with cysteine and glutathione [J]. Journal of Agricultural and Food Chemistry, 2013, 61(12):3 030-3 038.
[9]PEDRAZA-CHAVERRJ, BARRERA D, MALDONADO P D, et al. S-allylmercaptocysteine scavenges hydroxyl radical and singlet oxygeninvitroand attenuates gentamicin-induced oxidative and nitrosative stress and renal damageinvivo[J]. BMC Pharmacology and Toxicology, 2004, 4(1):5.
[10]RABINKOV A, MIRON T, MIRELMAN D, et al. S-Allylmercaptoglutathione:the reaction product of allicin with glutathione possesses SH-modifying and antioxidant properties [J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2000, 1 499(1):144-53.
[11]CORBI P P, MASSABNI A C, MOREIRA A G, et al. Synthesis, characterization, and biological activity of a new palladium (II) complex with deoxyalliin [J]. Canadian Journal of Chemistry, 2005, 83(2):104-109.
[12]YU T H, WU C M, ROSEN R T, et al. Volatile compounds generated from thermal degradation of alliin and deoxyalliin in an aqueous solution [J]. Annals of the New York Academy of Sciences, 1994,1 187(1):370-402.
[13]DING X, HUA Y, CHEN Y, et al. Heavy metal complexation of thiol-containing peptides from soy glycinin hydrolysates [J]. Int J Mol Sci, 2015, 16(4):8 040-8 058.
[14]RIENER C K, KADA G, GRUBER H J. Quick measurement of protein sulfhydryls with Ellman's reagent and with 4,4'-dithiodipyridine [J]. Analytical and Bioanalytical Chemistry, 2002, 373(4/5):266-276.
Preparation and characterization of conjugates of allicin and thiol-containing peptides from soy protein
CHEN Hai-qiao, ZHANG Cai-meng, HUA Yu-fei, KONG Xiang-zhen*
(School of Food Science, Jiangnan University, Wuxi 214122, China)
The disulfide-bonded conjugation between allicin and cysteine residues from glutathione, peptides and proteins is considered as the first step to play allicin’s physiological activitiesinvivo. Allicin and thiol-containing peptides in vitro are unstable, thus conjugating allicin with thiols is beneficial to exert both of their physiological activities. This paper studies the influence of reaction conditions on the conjugation of allicin and thiol-containing peptides. The results showed that pH 7.0, 24 ℃, the reaction ratio of allicin∶thiols = 5∶4 and reaction time of 1h were the optimal conditions, with a completion rate being more than 95%. Besides, compared with the unreduced protein, the reduced protein or peptides gained a greater degree of completion. Under these conditions, several corresponding products were prepared, and characterized by HPLC and MS-MS, which proves the structure of the conjugates.
garlic; thiol containing peptides; preparation; characterization
10.13995/j.cnki.11-1802/ts.201608014
硕士研究生(孔祥珍副教授为通讯作者,E-mail:xzkong@jiangnan.edu.cn)。
国家自然科学基金(31201380)
2015-12-,10改回日期:2016-01-15
