“一锅法”生物转化富马酸制备L-天冬酰胺
2016-10-21张奇姜增妍张露马玉岳徐友强裴疆森程池
张奇,姜增妍,张露,马玉岳,徐友强,裴疆森,程池*
1(中国食品发酵工业研究院,中国工业微生物菌种保藏管理中心,北京,100015) 2(山东省富马酸生物转化工程技术研究中心,山东 烟台,265709)
“一锅法”生物转化富马酸制备L-天冬酰胺
张奇1,姜增妍2,张露1,马玉岳2,徐友强1,裴疆森1,程池1*
1(中国食品发酵工业研究院,中国工业微生物菌种保藏管理中心,北京,100015)2(山东省富马酸生物转化工程技术研究中心,山东 烟台,265709)
L-天冬酰胺广泛应用于食品、医药、化工合成和微生物培养等领域。目前工业上主要依靠化学合成和直接提取方法制备。该研究首次采用双酶催化富马酸“一锅法”制备L-天冬酰胺。克隆来源于大肠埃希氏菌JM109的天冬酰胺合成酶A基因asnA,并于产L-天冬氨酸酶的E.coliCICC 11022S中表达,表达的蛋白分子质量约为37 kDa,与预期大小相符,比酶活力为1443.7 U/g。利用构建的工程菌E.coliCICC 11022S/pET28a(+)-asnA全细胞高密度催化富马酸生产L-天冬酰胺,以高效液相色谱法及PITC柱前衍生-高效液相法检测底物、中间产物和终产物,转化10 h,富马酸转化率为94.7%,L-天冬酰胺产量可达125.1g/L,生产速率为12.51 g/(L·h)。
一锅法;富马酸;天冬酰胺合成酶;L-天冬酰胺;生物转化
L-天冬酰胺(L-asparagine,L-Asn),又名天门冬酰胺、天门冬素、α-氨基丁二酸一酰胺,于1806年首次被法国化学家LOUIS和PIERRE从芦笋汁中分离,随后陆续在各种动植物体内发现并分离,广泛应用于食品、医药、化工合成和微生物培养等领域[1]。
L-天冬酰胺与糖能进行氨基-羰基反应,形成特殊的香味物质,可作为食品添加剂用于清凉饮料;同时,它也是微生物培养和动物细胞培养重要的添加剂[2]。L-天冬酰胺常用于氨基酸输液及降压、平喘、抗消化性溃疡和胃功能障碍等,并可用于治疗心肌梗死、心肌代谢障碍、心力衰竭、心脏传导阻滞和疲劳症等。它对于大脑的发育和其功能是必需的。此外,它能通过解除高谷氨酰胺抑制引发的细胞凋亡,进而实现肿瘤的治疗[3]。在寡糖转移酶的作用下,L-天冬酰胺能够与N-乙酰氨基葡糖在内质网内结合,对于蛋白质结构的稳定与功能的发挥至关重要,是蛋白质糖基化的重要形式[4-6]。
目前,L-天冬酰胺的制备主要采用提取法和化学合成法。提取法是通过从富含L-天冬酰胺的天然材料如白羽扇豆、草木樨等中分离[7]。该方法受原材料质量因素影响大,工艺复杂不易控制,且污染严重。化学合成法主要通过L-天冬氨酸与氨水进行酰胺化制得[8]。该方法存在污染大、副反应多等缺陷。
通过天冬酰胺合成酶催化铵离子或谷氨酰胺的氨基进行转移的生物合成过程为耗能过程,需要大量ATP参与(图1)[9-11],由此使生产成本大幅提升,限制了应用,因此国内外鲜有报道,但该过程反应条件温和、生产效率高、副产物少,同时对设备的要求低、投资小、生产过程简单,易于操控,仍具有一定的开发前景。本课题组前期构建了1株高产天冬酰胺合成酶的菌株大肠埃希氏菌CICC 11034S (EscherichiacoliCICC 11034S),采用活细胞自身糖酵解系统成功实现L-天冬氨酸转化生产L-天冬酰胺,有效解决了ATP成本过高的难题[12]。

图1 L-天冬酰胺生物合成Fig.1 Biosynthesis of L-asparagine
“一锅法”源于化学合成,指两步或两步以上的化学反应在一个反应体系中一次合成目的产物,具备操作简单、省时省力、成本低廉等优点。随着酶工程技术和分子生物学技术的发展,在一些特定目的产物的酶法合成中也引入了相应的方法,即在一个反应体系内加入多种酶,同步催化反应以获得目的产物[13]。
本研究在前期研究的基础上利用分子生物学手段,将大肠埃希氏菌JM109的天冬酰胺合成酶A基因(Asparagine Synthetase A gene,asnA)扩增并转化至高产天冬氨酸酶的E.coliCICC 11022S中,构建工程菌E.coliCICC 11033S,诱导表达后,利用菌体自身糖酵解功能合成的ATP,进行全细胞催化,实现从富马酸向L-天冬酰胺的双酶催化“一锅法”生物合成,有效节省生产时间,并解决了L-天冬酰胺生产过程中消耗ATP的高成本问题。
1 材料与方法
1.1材料与试剂
E.coliJM109、E.coliCICC11022S、pET28a(+)为实验室保藏;异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-1-Thiogalactopyranoside, IPTG)、硫酸卡那霉素(Kanamycin Monosulfate,Kan)、DNA Marker、蛋白质Marker、分子生物学试剂盒购于天根(北京);异硫氰酸苯酯(Phenyl isothiocyanate, PITC)、ATP购于生工(上海);培养基购于陆桥(北京);其他化学试剂均为国产分析纯或色谱纯。
1.2asnA基因克隆及工程菌构建
采用天根细菌基因组DNA提取试剂盒提取E.coliJM109基因组DNA,以此为模板,以AsnAU(5’-GCC GAA TTC ATG AAA ACC GCT TAC-3’,携带EcoRI酶切位点)和AsnAD(5’-GTT AAG CTT TTA CAG CAG AGA AGG GAC-3’,携带HindIII酶切位点)为引物PCR扩增asnA,经EcoRI和HindIII酶切后连接至相同酶切后的pET28a(+),转化至具备表达天冬氨酸酶能力的E.coliCICC11022S,随后筛选转化子进行PCR及酶切鉴定,选取阳性克隆测序分析。
1.3ASNA表达及分析
将构建的基因工程菌于LB/Kan(含50 μg/mLKan的LB培养基)中37 ℃,200 r/min,过夜培养后,1%转接LB/Kan培养液3 h后加入终浓度0.1 mmol/L IPTG 25 ℃,160 r/min,诱导6 h,收集菌体,超声破碎后离心收集上清液进行SDS-PAGE分析。
酶活力定义:在200 mmol/LL-天冬氨酸、10 mmol/L MgCl2、10 mmol/L NH4Cl、10 mmol/L ATP、100 mmol/L Tris-HCl (pH8.0)、菌体湿重20 mg/mL体系下,37 ℃催化反应30 min,以1 min催化L-天冬氨酸产生1 μmolL-天冬酰胺所需的酶量定义为1个酶活单位(U)。
1.4高效液相分析
底物富马酸采用高效液相色谱(HPLC)检测,色谱条件为:色谱柱,GRACE Prevail Organic Acid(25 mm× 4.6 mm);流动相,A∶B=95∶5(A:10 mmol/L KH2PO4(pH2.3);B:甲醇);检测器,VWD-3000RS;检测波长:210 nm;柱温:30℃;流速:0.6 mL/min;进样量:10 μL;进样质量浓度:5、10、20、50、100 mg/L。中间产物L-天冬氨酸及终产物L-天冬酰胺采用PITC柱前衍生-高效液相方法检测[12]。
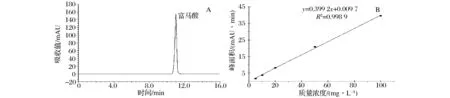
A:富马酸色谱图;B:富马酸定量标准曲线图2 底物富马酸HPLC分析Fig.2 Analysis of fumaric acid by HPLC
富马酸标准品(100 mg/L)的色谱图如图2A所示,根据不同浓度富马酸的峰面积绘制标准曲线(图2B),回归曲线方程为:Y=0.399 2X+0.009 7。以全细胞为酶原催化富马酸转化生产L-天冬酰胺,每1 h取样1次,以HPLC法测定富马酸,根据标准曲线计算富马酸含量。
1.5全细胞催化
配制全细胞催化反应体系,将1 mol富马酸加入800 mL水中,随后以氨水调pH至8.0,使其充分溶解,随后加入终浓度为20 mmol/L葡萄糖和2 mmol/L氯化镁;离心发酵液,收集菌体,无菌水清洗后,将菌体加入转化体系中,使菌体终浓度OD600 nm=12;最后将反应液体积定容至1 L,此时富马酸浓度为1 mol/L。37 ℃、50 r/min催化反应14 h,每1 h取样,以色谱法检测底物富马酸、中间产物L-天冬氨酸和终产物L-天冬酰胺。
2 结果与分析
2.1工程菌株构建
以E.coliJM109基因组DNA为模板进行PCR扩增,随后通过限制性内切酶酶切、回收并连接,转化至宿主菌E.coliCICC11022S中,筛选转化子进行PCR和酶切鉴定,结果如图3所示,经PCR扩增,可于1 000 bp处观察到明显的条带;筛选转化子,进行PCR和酶切鉴定,于1 000 bp处可见明显的目的基因PCR扩增条带和酶切条带,表明已成功构建含目的基因asnA的基因工程菌株,命名为E.coliCICC11022S/pET28a(+)-asnA,并于中国工业微生物菌种保藏中心保藏,保藏号:CICC 11033S。

M-DNA Marker;1-PCR产物;2-PCR鉴定;3-酶切鉴定图3 asnA基因克隆及转化子鉴定Fig.3 Amplification and identification of asnA gene
2.2天冬酰胺合成酶A表达及酶活力分析
将诱导表达的工程菌裂解液进行SDS-PAGE分析,结果如图4所示,与含pET28a(+)空载体的对照菌株E.coliCICC 11022S/pET28a(+)相比,E.coliCICC11022S/pET28a(+)-asnA裂解上清液与沉淀中均在约37 kDa处可见蛋白表达条带,与预期大小36.6 kDa相符,其表达后存在形式包括可溶性蛋白和包涵体两种。
以菌体细胞为酶原按酶活力定义所述方法测定表达的天冬酰胺合成酶A的酶活力,其比酶活力为1 443.7 U/g。

M-Marker;1-E. coli CICC11022S/pET28a(+)-asnA裂解上清液; 2-E. coli CICC11022S/pET28a(+)裂解上清液;3-E. coli CICC11022S/pET28a(+)-asnA裂解沉淀图4 SDS-PAGE分析Fig.4 SDS-PAGE analysis of ASNA expression
2.3转化过程监测
以PITC-HPLC法测定L-天冬氨酸和L-天冬酰胺,根据[12]报道的标准曲线计算反应体系中L-天冬氨酸和L-天冬酰胺浓度,绘制过程曲线,结果如图5所示,随着反应时间的延长,富马酸浓度逐渐降低;于此同时,L-天冬氨酸含量逐步提升,在4 h时,反应体系中L-天冬氨酸含量达最高,积累浓度达70 g/L以上,随后逐渐下降;反应体系中L-天冬酰胺的含量随着时间的延长持续上升,10 h时,L-天冬酰胺含量达高点,产量为125.1 g/L,综合生产速率为12.51 g/(L·h) ,此时富马酸的摩尔转化率达94.7%。

图5 转化过程中底物与产物含量分析Fig.5 Analysis of substrate and product
3 讨 论
天冬酰胺合成酶的结构包含催化活性区域和结合区域,即具有两个反平行β-折叠的负责水解谷氨酰胺的活性部位的N-末端和负责结合Mg2+、ATP和L-天冬氨酸的C-末端两部分。天冬酰胺合成酶可分为天冬酰胺合成酶A和天冬酰胺合成酶B,前者只可以利用铵离子进行L-天冬氨酸的酰胺化,后者的氨基既可来源于谷氨酰胺,也可以来源于铵离子。天冬酰胺合成酶A主要存在于微生物中,目前科研人员已经克隆并表达了多种微生物来源的天冬酰胺合成酶A基因[11]。本研究以E.coliJM109的基因组DNA为模板,成功克隆了asnA基因,与已知序列同源性为99.9%,仅一个碱基差异;蛋白序列同源性为100%。本研究构建的ASNA表达体系,能够成功表达可溶性蛋白,由于目的蛋白大部分为可溶解状态,尽管有部分蛋白质以包涵体存在于菌体裂解沉淀中,但不影响整个催化体系。
尽管天冬酰胺合成酶能催化L-天冬氨酸合成L-天冬酰胺,但由于其转化过程中需要ATP的参与,导致成本过高,因此采用该酶进行生物转化法生产L-天冬酰胺鲜有报道,而L-天冬酰胺生产技术也一直停留在化学合成法和直接提取法[1, 7-8]。本课题组前期报道了采用活细胞催化方式为从L-天冬氨酸到L-天冬酰胺转化提供所需ATP的关键技术[12]。本研究对前期工作进一步延伸,采用单菌双酶 “一锅法”催化,从底物富马酸直接转化生产L-天冬酰胺,在简化工艺、节省时间、节约人力成本的基础上进一步降低了底物成本。
本研究建立了一套“一锅法”生产L-天冬酰胺的生物转化工艺,通过克隆天冬酰胺合成酶A基因并构建高效表达该酶的基因工程菌株,实现从富马酸到L-天冬酰胺的生物酶法催化合成。以全细胞为酶原催化该反应,以葡萄糖替代ATP,通过菌体细胞自身的葡萄糖酵解体系和三羧酸循环,实现ATP的合成与再生,进而成功解决了L-天冬酰胺生物转化生产工艺中ATP成本过高的难题。
[1]李健, 查家华, 万宇. 化学合成L-天门冬酰胺的改进工艺:中国, CN95112751[P]. 1995-10-31.
[2]张维燕, 刘亚亚, 刘旭平, 等. 谷氨酰胺和天冬酰胺对CHO细胞生长、代谢及抗体表达的影响 [J]. 中国生物工程杂志, 2014, 34(4):9-15.
[3]ZHANG J, FAN J, VENNETI S, et al. Asparagine plays a critical role in regulating cellular adaptation to glutamine depletion [J]. Molecular Cell, 2014, 56(2):205-218.
[4]BURDA P, AEBI M. The dolichol pathway of N-linked glycosylation [J]. Biochimica et Biophysica Acta, 1999, 1 426(2):239-257.
[5]IMPERIALI B, O′CONNOR S E. Effect of N-linked glycosylation on glycopeptide and glycoprotein structure [J]. Current Opinion in Chemical Biology, 1999, 3(6):643-649.
[6]PATTERSON M C. Metabolic mimics:the disorders of N-linked glycosylation [J]. Seminars in Pediatric Neurology, 2005, 12(3):144-151.
[7]詹谷宇, 叶明, 田萍. 从草木樨芽提取天门冬酰胺 [J]. 氨基酸和生物资源, 1984(2):6-8.
[8]黄宜基, 周承文, 翟元凤, 等.L-天门冬氨酸胺一水合物的合成 [J]. 氨基酸和生物资源, 1984(2):4-5.
[9]RICHARDS N G, SCHUSTER S M. Mechanistic issues in asparagine synthetase catalysis [J]. Advances in Enzymology and Related Areas of Molecular Biology, 1998, 72(1):145-98.
[10] OHASHI M, ISHIYAMA K, KOJIMA S, et al. Asparagine synthetase1, but not asparagine synthetase2, is responsible for the biosynthesis of asparagine following the supply of ammonium to rice roots [J]. Plant and Cell Physiology, 2015, 56(4):769-778.
[11]MANHAS R, TRIPATHI P, KHAN S, et al. Identification and functional characterization of a novel bacterial type asparagine synthetase A:a tRNA synthetase paralog fromLeishmaniadonovani[J]. Journal of Biological Chemistry, 2014, 289(17):12 096-12 108.
[12]张奇, 张露, 徐友强, 等. 生物转化法制备L-天冬酰胺 [J]. 中国生物工程杂志, 2016, 36(1):63~67.
[13]LI L, LIU Y H, WAN Y, et al. Efficient enzymatic synthesis of guanosine 5’-diphosphate-sugars and derivatives [J]. Organic Letters, 2013, 15(21):5 528- 5530.
L-asparagine production by one-pot biotransformation method
ZHANG Qi1, JIANG Zeng-yan2, ZHANG Lu1, MA Yu-yue2,XU You-qiang1, PEI Jiang-sen1, CHENG Chi1*
1(China National Research Institute of Food & Fermentation Industries, China Center of Industrial Culture Collection, Beijing 100015, China)2(Shandong Biotransformation Engineering Research Center of Fumaric Acid, Yantai 265709, China)
L-asparagine was one of natural amino acids, which was widely used in food, medicine, chemical synthesis, microbial culture and so on, and mainly obtained by chemical synthesis or direct extraction methods. In this study, one-pot reaction was reported to synthesize L-asparagine by two kinds of enzyme. Asparagine synthetase gene A (asnA) fromEscherichiacoli(E.coli) JM109 was amplified and transformed intoE.coliCICC 11022S using molecular biological methods, and then the ASNA was expressed. The molecular weight of expressed protein was of about 37 kDa by SDS-PAGE, which was consistent with the expected size. After analyzing the ASNA activity, the enzyme activity was 1 443.7 U/g wet cell. Finally, the constructed strainsE.coliCICC 11022S/pET28a (+)-asnAwas applied on conversion from fumaric acid toL-asparagine. After catalyzing for 10 h, the substrate and product were detected by PITC column derivatization-high performance liquid. The conversion ratio of fumaric acid was 94.7%, the yield of L-asparagine was up to 125.1 g/L, and the production rate was 12.51 g/(L·h).
one-pot reaction; fumaric acid; Asparagine synthetase A;L-asparagine; biotransformation
10.13995/j.cnki.11-1802/ts.201608010
博士,副教授(程池教授级高级工程师为通讯作者,E-mail:cheng100027@163.com)。
2016-01-08,改回日期:2016-01-28
