肉毒碱脂酰转移酶基因沉默对高山被孢霉脂质积累的影响
2016-10-21杨华陈海琴郝光飞顾震南陈卫陈永泉
杨华,陈海琴,郝光飞,顾震南,陈卫,陈永泉
(江南大学 食品学院,江苏 无锡,214122)
肉毒碱脂酰转移酶基因沉默对高山被孢霉脂质积累的影响
杨华,陈海琴*,郝光飞,顾震南,陈卫,陈永泉
(江南大学 食品学院,江苏 无锡,214122)
高山被孢霉是一种工业化生产多不饱和脂肪酸的产油真菌。通过分析高山被孢霉脂肪酸氧化途径中相关基因的转录水平,发现肉毒碱脂酰转移酶(carnitine acyl-transferase,CAT)基因与高山被孢霉脂肪酸氧化紧密相关,进一步利用RNA干扰技术实现在高山被孢霉中CAT基因的沉默,分析发现,在高山被孢霉重组菌中,CAT活性下调了33.3%,总脂肪酸积累量相比野生型菌株提高38.1%,表明通过抑制β氧化途径可以提高高山被孢霉的脂质积累量,这为推动高山被孢霉在脂质生物合成工业化方面的应用奠定了理论基础。
β氧化;高山被孢霉;RNA干扰;肉毒碱脂酰转移酶
多不饱和脂肪酸(PUFAs)是指含有2个或2个以上双键、碳原子数为16-26的直链脂肪酸。PUFAs是人体所必需的脂肪酸,具有调节血脂[1],清理血栓[2],调节免疫功能[3],健脑补脑[4]等作用,对人类和动物的营养与健康具有十分重要的意义。由于传统来源的PUFAs已经无法满足日益增长的市场需求,所以能够积累多不饱和脂肪酸的微生物日渐成为食品、医药和化工领域的研究热点[5]。高山被孢霉(Mortierellaalpina)是一种工业化生产花生四烯酸(Arachidonic acid,AA)的产油真菌,可以以甘油三酯形式积累多种多不饱和脂肪酸,已经通过正式安全性评估[6],是脂质生物化学基础研究的重要模式菌[7-9]。
以往对于产油微生物脂质积累的研究多集中于过表达脂肪酸合成途径的相关基因(如乙酰辅酶A羧化酶、脂肪酸合成酶)来增加脂质产量,而脂肪酸氧化途径也是维持脂肪酸贮存与消耗动态平衡的重要步骤[10],从代谢工程的角度来看,通过阻断脂肪酸氧化途径,也可以提高脂质的产量。肉毒碱脂酰转移酶(carnitine acyl-transferase,CAT)在脂肪酸氧化途径中起着重要作用。脂酰辅酶A不能直接通过线粒体和过氧化物酶体膜,而CAT能够催化脂酰辅酶A生成酰基肉碱,酰基肉碱能够穿过线粒体或过氧化物酶体膜,从而实现脂肪酸在线粒体和过氧化物酶体内外的转运,促进β氧化的进行。研究发现,增强CAT活性或提高CAT表达量均可促进脂肪酸的β氧化[11],如在小鼠的饮食中加入L-肉毒碱可促进体内CAT的转录,改善因衰老引起的氧化效率降低现象[12],亦可以明显降低其细胞内甘油三酯含量[13]。在微生物研究方面,高弘等[14]通过对热带假丝酵母β氧化过程转运途径的代谢工程改造,敲除CAT基因后,酵母的产酸和烷烃转化率得到了明显的提高。因此,我们推测CAT在脂质代谢中发挥着重要作用,降低细胞内CAT活性将有助于抑制β氧化过程,提高产油真菌的脂质产量。本文采用了基因组信息比较全面[6]、遗传操作系统相对成熟[7]的M.alpinaATCC 32222为原始菌株,通过分析高山被孢霉脂肪酸氧化途径中相关基因的转录水平,选取在脂质代谢中发生明显变化的肉毒碱脂酰转移酶(CAT)基因为研究对象,通过根癌农杆菌介导的方法实现CAT基因的RNA干扰,提高重组菌株的脂质能力,这对于产油真菌高山被孢霉的基础理论研究及产品开发均具有重要的意义。
1 材料与方法
1.1菌株及载体
大肠杆菌(Escherichiacoli,E.coli)DH5α用于保藏重组载体,保藏于本实验室。购买于美国菌种保藏中心的高山被孢霉(M.alpinaATCC 32222)用于获得目的基因。本实验室构建的高山被孢霉尿嘧啶营养缺陷型菌株CCFM 501用于受体细胞。根癌农杆菌(Agrobacteriumtumefaciens)C58C1获赠于日本京都县立大学Yasuyuki Kubo教授,用作介导转化。遗传操作表达载体pBIG2-ura5s-Its来自本研究中心[7]。
1.2主要试剂
限制性内切酶Hind III、KpnI、XmaI、XhoI(NEB公司,美国),T4DNA连接酶(Promega公司,美国),KOD plus 高保真DNA聚合酶(TOYOBO公司,日本),TaqDNA聚合酶(康为世纪,中国),DNA分子量标准、质粒提取试剂盒、胶回收试剂盒(Fermentas公司,美国),抗生素、饱和酚(上海生工,上海),乙醇等化学试剂来自国药,引物由上海桑尼公司合成。
1.3培养基
肉汤培养基,其组成为:20 g/L葡萄糖,5 g/L酵母提取物,1 g/L KH2PO4,0.25 g/L MgSO4·7H2O,10 g/L KNO3,pH 6.0。
MM培养基,其组成为:1.74 g/L K2HPO4,1.37 g/L KH2PO4,0.146 g/L NaCl,0.49 g/L MgSO4·7H2O,0.078 g/L CaCl2,0.002 5 g/L FeSO4·7H2O,0.53 g/L (NH4)2SO4,1.8 g/L葡萄糖,0.5%甘油,pH 6.8。
SC固体培养基组成为:20 g/L葡萄糖,5 g/L酵母氮源无氨基酸和硫酸铵,1.7 g/L (NH4)2SO4,60 mg/L异亮氨酸,60 mg/L亮氨酸,60 mg/L苯丙氨酸,50 mg/L苏氨酸,40 mg/L赖氨酸,30 mg/L酪氨酸,20 mg/L腺嘌呤,20 mg/L精氨酸,20 mg/L组氨酸,10 mg/L甲硫氨酸,20 g/L琼脂,pH 6.8。
需要时,向培养基中加入卡那霉素(Kanamycin,Kana)、氨苄青霉素(Ampicillin,Amp)、利福平(Rifampicin,Rif)、尿嘧啶至终质量浓度为100 μg/mL,加入头孢噻肟钠(Cefotaxime Sodium,Cef)、壮观霉素(Spectinomycin,Spe)至终质量浓度为50 μg/mL。
1.4RNAi载体构建
根据高山被孢霉M.alpinaATCC 32222的CAT1和CAT2基因序列信息,利用Primer Premier 5.0软件设计PCR引物对,并添加酶切位点和保护碱基,具体引物序列见表1,下划线部分为酶切位点。以高山被孢霉cDNA为模板,用上述引物、KOD plus高保真DNA聚合酶,通过PCR对基因片段进行扩增,得到目的片段。PCR扩增片段经纯化后,与遗传操作表达载体pBIG2-ura5s-Its酶切连接获得RNAi载体。构建流程如下,连接产物电转入大肠杆菌DH5α保藏,进而通过电击法将质粒转化入根癌农杆菌C58C1,所得阳性克隆扩大培养,-80 ℃下保存菌液,用于后续转化实验。
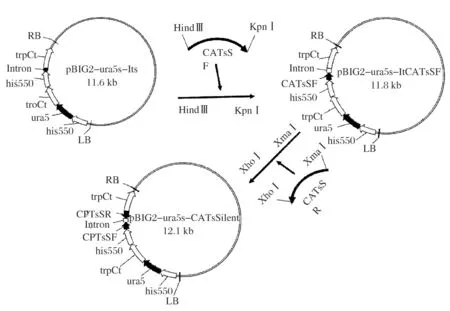
图1 二元表达载体pBIG2-ura5s-CATs Silent的构建Fig.1 Construction of binary vector pBIG2-ura5s-CATs Silent
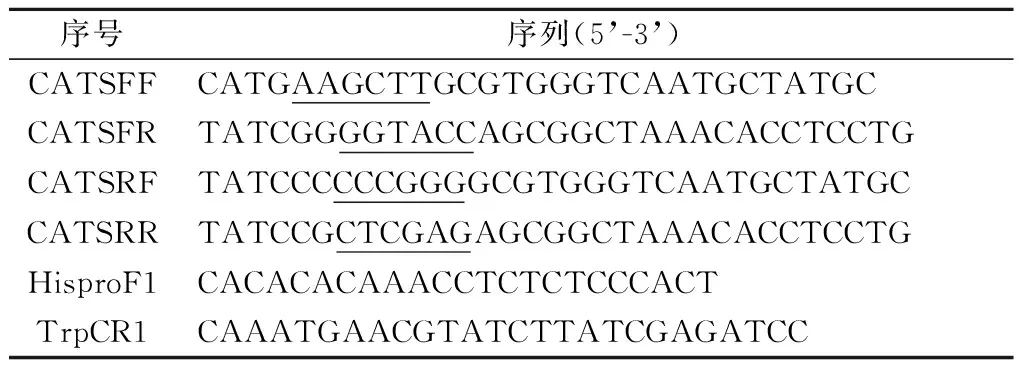
表1 引物序列
注:下划线表示酶切位点
1.5根癌农杆菌介导高山被孢霉转化
从-80 ℃冰箱中取出1.4中构建成功的重组根癌农杆菌,在100 μg/mL Kana和100 μg/mL Rif抗性的YEP液体培养基中活化,随后与高山被孢霉尿嘧啶营养缺陷型菌株CCFM 501共培养,利用含有100 μg/mL Spe和100 μg/mL Cef抗性的SC平板筛选阳性克隆。重复筛选3次,将稳定遗传的阳性菌株转移至GY平板,培养至其产孢。用生理盐水冲刷孢子,离心后保存在30%甘油中,-80 ℃冷藏。具体介导转化操作步骤参考文献有关根癌农杆菌转化方法报道[15]。
1.6鉴定转基因菌株
利用基因组提取试剂盒提取重组高山被孢霉的基因组DNA。 取1 μL DNA为模板进行PCR鉴定,根据遗传操作表达载体pBIG2-ura5s-Its的启动子和终止子序列设计引物对HisproF1/TrpCR1(表1)[7]来验证表达单元是否成功整合到基因组上。PCR 条件为:95 ℃ 5 min预变性,95 ℃变性30 s、 55 ℃退火30 s、 72 ℃延伸1 min,30个循环; 72 ℃延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测。
1.7基因转录水平分析
使用Trizol法提取总RNA[6]。提取得到RNA溶液后,根据Prime ScriptTM1st Stand Sythesis试剂盒产品说明书进行反转录制备cDNA。使用ABI-Prism 7900 sequence detection system (Applied Biosystems, CA) 按照SYBR Green PCR Master Mix (Applied Biosystems, CA) 的说明进行RT-qPCR反应。反应体系为:10 μL SYBR Green PCR Master Mix,两种引物各0.5 μL,8 μL无酶水,1 μL模板。PCR循环设置为 50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,40个循环。以高山被孢霉自身的18S rRNA为内参,根据2-ΔΔCt法来分析基因表达的相对变化。
1.8肉毒碱脂酰转移酶活性的测定
取0.2 g高山被孢霉菌体,加入液氮充分研磨至粉末,加入2 mL酶提取缓冲液(磷酸二氢钾/氢氧化钾缓冲液(pH 7.5)的质量浓度为100 mol/L,苯甲脒盐酸的浓度为1 mol/L,二硫苏糖醇的浓度为1 mol/L,甘油的质量分数为20%),吸取液体到1.5 mL离心管中,转速为10 000 r/min,4 ℃,离心5 min,上清液即粗蛋白提取液,转移到另一个1.5 mL离心管中。
CAT酶活测定的原理主要是利用DTNB试剂与CoA反应生成黄色物质,通过测定412 nm处可见光吸光度变化速率就可以计算出酶活性,具体方法参考文献[16-17]。酶活以1 mg蛋白单位时间内CoA的生成量表示。
1.9高山被孢霉菌体中脂肪酸组成及含量测定
称取一定质量真空冷冻干燥后的菌体,研磨充分至粉碎,并加入浓度为4 mol/L的HCl,在80 ℃/-80 ℃下反复冻融破壁。采用三氯甲烷和甲醇萃取总脂,氮吹后加入盐酸甲醇溶液进行甲酯化,随后用正己烷萃取,得到的脂肪酸甲酯使用气相检测。具体实验操作见文献[6]。
2 结果与讨论
2.1β氧化途径相关基因的转录调控
将高山被孢霉在5 L发酵罐中培养,选取氮源耗尽前后的时间点(A:8 h,B:18 h,E:19.5 h,K:21 h,L:32 h 和 M:68 h)进行取样,以E点时的样品作为对照组[6],分析β氧化途径相关基因转录水平,以确定其表达情况。如图2,当高山被孢霉处于脂质积累阶段时(K-L),参与脂肪酸β氧化的脂酰辅酶A脱氢酶(EC 1.3.99)、烯酰辅酶A水合酶(EC 4.2.1.17)和3-羟脂酰辅酶A脱氢酶(EC 1.1.1.35)等的转录水平一直处于一个相对稳定的状态,而肉毒碱脂酰转移酶(EC 2.3.1.7)基因表现出下调的趋势,这可能是为了减少脂肪酸转运到线粒体进行氧化[14],从而保证了合成的甘油三酯能被很好地积累起来。而其中肉毒碱脂酰转移酶2(CAT2)的转录水平出现了较小幅度的上调,这可能是由于脂质积累促进了脂质代谢的活跃程度。因此我们推测在高山被孢霉细胞内,肉毒碱脂酰转移酶与脂肪酸氧化紧密相关,故选定其作为研究对象。
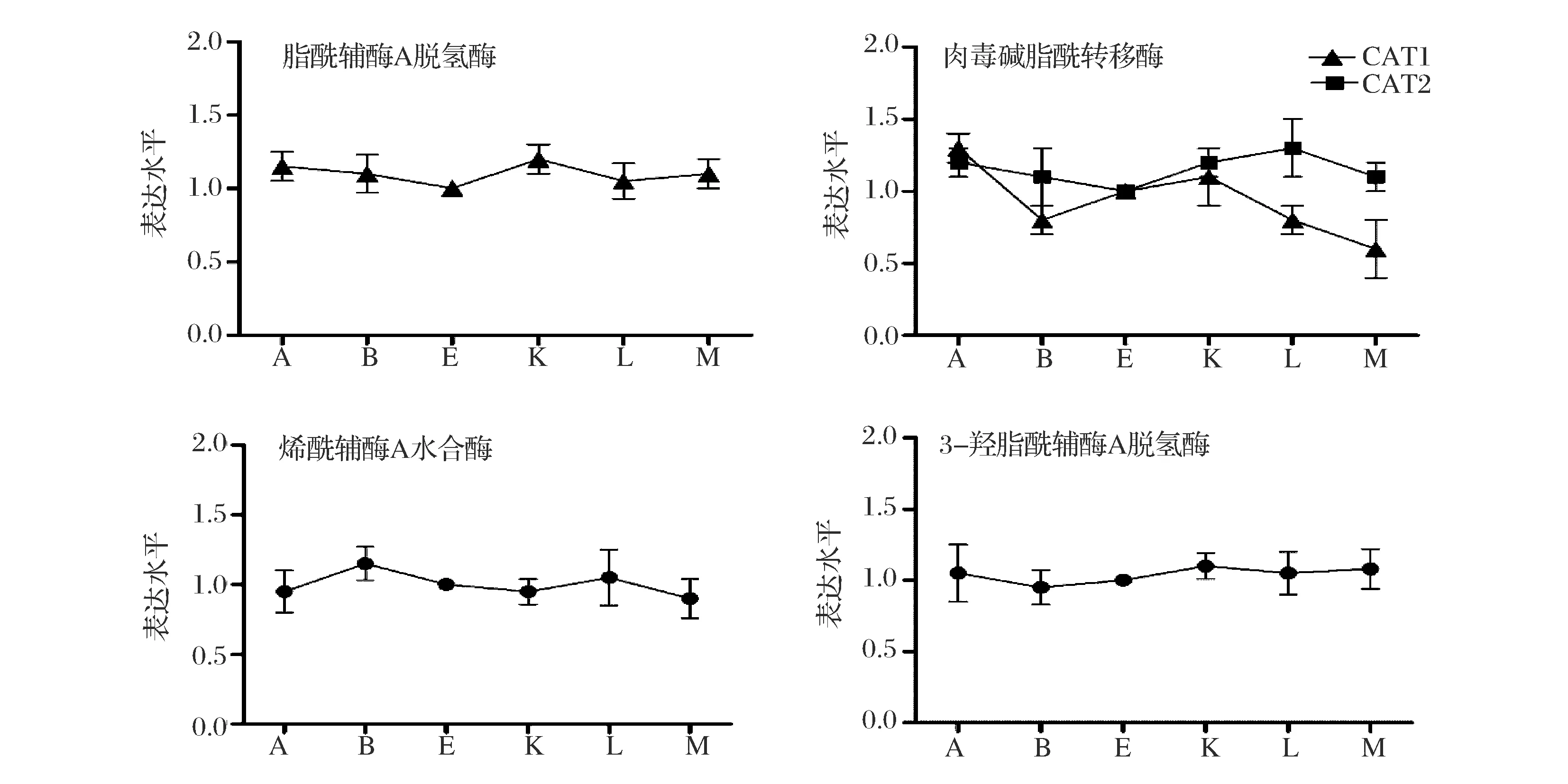
A-8 h; B-18 h; E-19 h; K-21 h; L-32 h; M-68 h图2 M. alpina中脂酰辅酶A脱氢酶、肉毒碱脂酰转移酶、烯酰辅酶A水合酶和3-羟脂酰辅酶A脱氢酶的转录水平变化Fig.2 Transcription levels of acyl-CoA dehydrogenase dehydrogenase, carnitine acetyltransferase, enoyl-CoA hydratase and 3-hydroxyacyl-CoA dehydrogenase in M. alpina
2.2高山被孢霉CAT的基因沉默
2.2.1重组菌株的构建及鉴定
以高山被孢霉cDNA为模板进行PCR扩增获得目的基因片段(图3),M为marker,1为CATsSF片段,2为CATsSR片段,与理论大小214 bp一致,并且测序验证正确。酶切连接获得CAT沉默载体pBIG2-ura5s-CATsSilent,并通过根癌农杆菌介导转化的方法将载体的T-DNA区域整合到高山被孢霉基因组中。其中T-DNA区域包含两个表达元件,作为筛选标记的ura5表达元件和沉默CAT基因的表达元件。从筛选得到的能够稳定遗传的阳性克隆中随机挑选3株转化子进行PCR验证。结果如图4,M为marker,N为高山被孢霉野生型对照菌株,1、2、3分别为转化的重组菌株。转化菌株只能得到一条818 bp的条带,为尿嘧啶基因表达元件,另一个表达元件由于形成发卡结构而无法通过PCR扩增得到片段,同时,对照组无条带,说明表达元件都已成功插入到高山被孢霉基因组,形成稳定遗传的重组菌株。

图3 纯化后的CATsSF和CATsSR基因片段Fig.3 Purification of CATsSF and CATsSR gene fragments
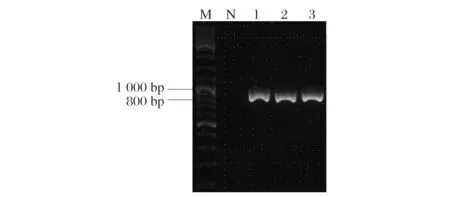
图4 M. alpina重组菌的PCR鉴定Fig.4 Verification of M. alpina transformants by PCR
2.2.2转化菌株中CAT基因表达量分析
分别取重组菌株和野生型菌株迅速置于液氮中,提取总RNA,分析CAT1和CAT2转录水平表明(图5),所有沉默重组菌株中肉毒碱脂酰转移酶基因的表达量均明显低于野生型,CAT1和CAT2编码基因的转录水平均下降了40%左右,表明在重组菌株中实现了对CAT基因的沉默。
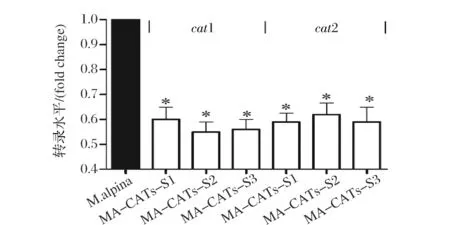
图5 M. alpina重组菌株中肉毒碱脂酰转移酶基因的转录水平Fig.5 The transcriptional level of CAT in M. alpina transformants
2.2.3转化菌株中CAT酶活分析
将选定的3株转化子以及野生型高山被孢霉在100 mL肉汤培养基中28 ℃,转速为200 r/min培养7 d后,收集菌体,破碎菌体后进行CAT酶活测定。结果如图6所示,重组菌株CAT酶活水平相比对照菌下调33.3%左右,这表明通过RNAi可影响肉毒碱脂酰转移酶的活性,本研究通过在高山被孢霉基因组中引入CAT基因的正向和反向特异性序列,使其转录后形成dsRNA来干扰高山被孢霉中CAT基因的转录量,进而影响CAT酶活。
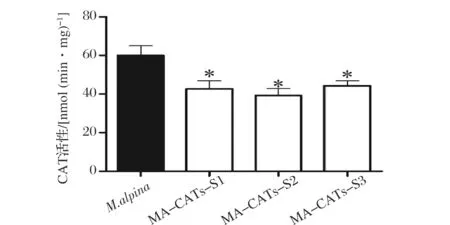
图6 M. alpina重组菌株中肉毒碱脂酰转移酶活性Fig.6 CAT activities in M. alpina transformants
2.3重组高山被孢霉转化子脂肪酸的分析
将选定的3株CATs沉默菌株与野生型高山被孢霉在100 mL肉汤培养基中28 ℃,转速为200 r/min培养10 d后收集菌体,对脂肪酸含量进行分析。如表2所示,相比于野生型高山被孢霉,重组菌株脂肪酸组成并没有变化,这表明在高山被孢霉细胞内,脂肪酸氧化代谢的发生对于脂肪酸碳链长度没有偏好性。从表2可以看出沉默菌株生物量与对照菌相比没有显著差异,表明CAT酶的转录干扰对生物量影响极小。高山被孢霉在脂质积累期内脂肪酸氧化产生的能量主要用于多余热量的产生[14],因此CAT活性的降低不影响菌体的正常生长。但脂肪酸总量较野生型有所变化,在MA-CATs-S3沉默菌株中,脂肪酸的含量达到了细胞干重的38.4%,而对照菌株中的脂肪酸含量仅占细胞干重的27.8%左右,这表明CAT基因转录水平和酶活性的下降使脂肪酸的含量提高了约38.1%,是调控高山被孢霉脂肪酸氧化过程的重要酶,这也很好地验证了2.1中的转录分析结果。综合以上结果可以看出,在产油真菌高山被孢霉中,CAT的活性对维持细胞内脂肪酸氧化代谢的活跃程度十分重要,抑制其活性能够抑制脂肪酸氧化过程,从而显著提高细胞的脂质积累。同时也应该注意到,除了直接参与β氧化过程的酶之外,还存在着其他可以间接影响氧化代谢途径的酶。过氧化物酶体生物合成因子(pex10)在最近被发现可能与脂肪酸合成密切相关,pex10的失活影响了解脂酵母细胞内的脂肪酸氧化过程,从而提高了脂质产量[18]。然而,这些基因在高山被孢霉进入脂质积累期后并没有发生明显的变化,其作用仍需进一步探讨。

表2 高山被孢霉菌株脂肪酸组成
注:*表示与对照相比差异显著。
3 结论
本文通过对高山被孢霉脂质积累期参与β氧化的相关基因表达水平分析,预测出影响脂肪酸氧化的关键酶,并成功构建了高山被孢霉CAT基因沉默重组菌株,实现了肉毒碱脂酰转移酶活性的降低,从而达到抑制脂肪酸氧化的目的,最终使高山被孢霉总脂肪酸含量提高约38.1%。这为提高高山被孢霉脂质产量提供了新的思路,也为研究其脂质合成代谢途径提供了理论基础。
[1]杭晓敏, 唐涌濂, 柳向龙. 多不饱和脂肪酸的研究进展[J]. 生物工程进展, 2001, 21(4):18-21.
[2]黄建忠,施巧琴,周晓兰,等. 提高深黄被孢霉菌丝细胞油脂合成总量及其不饱和脂肪酸酯含量的研究[J].食品与发酵工业, 1998, 24(2):27-31.
[3]STOLL B A. N-3 fatty acids and lipid peroxidation in breast cancer inhibition [J]. British Journal of Nutrition, 2002, 87(3):193-198.
[4]吴时敏. 胎儿、婴幼儿的功能性多不饱和脂肪酸需要概况 [J]. 中国乳品工业, 2001, 29(3):21-23.
[5]BEOPOULOS A, CHARDOT T, NICAUD J M.Yarrowialipolytica:A model and a tool to understand the mechanisms implicated in lipid accumulation[J]. Biochimie, 2009, 91(6):692-696.
[6]WANG Lei, CHEN Wei, FENG Yun, et al. Genome characterization of the oleaginous fungusMortierellaalpina[J]. Plos One, 2011, 6(12):1-16.
[7]HAO Guang-fei, CHEN Hai-qin, WANG Lei, et al. Role of malic enzyme during fatty acid synthesis in the oleaginous fungusMortierellaalpina[J]. Applied And Environmental Microbiology, 2014, 80(9):2 672-2 678.
[8]HAO Dan-hui, CHEN Hai-qin, HAO Guang-fei, et al. Production of conjugated linoleic acid by heterologous expression of linoleic acid isomerase in oleaginous fungusMortierellaalpina[J]. Biotechnology Letters, 2015, 37(10):1 983-1 992.
[9]HAO Guang-fei, CHEN Hai-qin, GU Zhen-nan, et al. Metabolic engineering ofMortierellaalpinafor arachidonic acid production with glycerol as carbon source [J]. Microbial Cell Factories, 2015, 14(1):1-10.
[10]周华龙,陈家丽,张新. 不饱和脂肪酸的氧化机理研究[J]. 皮化材料, 2002, 24(4):23-28.
[11]BRUCE C R, HOY A J, TURNER N, et al. Overexpression of carnitine palmitoyltransferase-1 in skeletal muscle is sufficient to enhance fatty acid oxidation and improve high-fat diet-induced insulin resistance [J]. Diabetes, 2009, 58(3):550-558.
[12]SAHEKI T, LI M X, KOBAYASHI K. Antagonizing effect of AP-1 on glucocorticoid induction of urea cycle enzymes:a study of hyperammonemia in carnitine-deficient, juvenile visceral steatosis mice [J]. Molecular Genetics And Metabolism, 2000, 71(4):545-551.
[13]TORAL M, ROMERO M, JIMENEZ R, et al. Carnitine palmitoyltransferase-1 up-regulation by PPAR-beta/delta prevents lipid-induced endothelial dysfunction [J]. Clinical Science, 2015, 129(9):823-837.
[14]高弘,黄英明,刘铭,等. CAT基因敲除对热带假丝酵母产DCA13代谢网络的影响[J]. 化工学报, 2006, 57(9):2157-2160.
[15]ANDO A, SUMIDA Y, NEGORO H, et al. Establishment of agrobacterium tumefaciens-mediated transformation of an oleaginous fungus, Mortierella alpina 1S-4, and its application for eicosapentaenoic acid producer breeding [J]. Applied And Environmental Microbiology, 2009, 75(17):5 529-5 535.
[16]FRITZ I B, SCHULTZ S K, SRERE P A. Properties of partially purified carnitine acetyltransferase [J]. Journal of Biological Chemistry, 1963, 238(7):2 509-2 517.
[17]FRITZ I B, SCHULTZ S K. Carnitine acetyltransferase II. Inhibition by carnitine analogues and by sulfhydryl reagents [J]. Journal of Biological Chemistry, 1965, 240(5):2 188-2 192.
[18]XUE Zhi-xiong, SHARPE P L, HONG S P, et al. Production of omega-3 eicosapentaenoic acid by metabolic engineering ofYarrowialipolytica[J]. Nature Biotechnology, 2013, 31(8):734-742.
Effect of carnitine acyl-transferase suppression on fatty acid accumulation inMortierellaalpina
YANG Hua, CHEN Hai-qin, HAO Guang-fei, GU Zhen-nan,CHEN Wei, CHEN Yong-quan
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Mortierellaalpinais a type of fungus used for the industrial production of polyunsaturated fatty acids. Transcription levels of most of the β-oxidation-related genes were analyzed, and carnitine acyl-transferase was speculated to be the key enzyme involved in the oxidation. To suppress the oxidation of fatty acids, RNA interference technology was used to achieve gene silence of the key enzyme inMortierellaalpina. Enzyme activity analysis showed that the specific activity decreased by 33.3%. Lipid analysis revealed that there was a 38.1% increase in the fatty acid content compared to the wild-type, which indicated that suppression of β-oxidation could significantly increase fatty acid accumulation inMortierellaalpina. These results provided theoretical support for implications for industrial production of fatty acids inMortierellaalpina.
β-oxidation;Mortierellaalpine; RNA interference (RNAi); carnitine acyl-transferase
10.13995/j.cnki.11-1802/ts.201608003
硕士(陈海琴教授为通讯作者,E-mail:haiqinchen@jiangnan.edu.cn)。
国家自然科学基金(21276108)。
2016-03-01,改回日期:2016-03-30
