产细菌素的饲用乳酸菌的分离与鉴定
2016-10-21王娟蔡国林方华陆健
王娟,蔡国林,方华,陆健
1(江南大学, 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学, 生物工程学院,江苏 无锡,214122) 3(江南大学, 粮食发酵工艺及技术国家工程实验室,江苏 无锡,214122) 4(上海源耀生物股份有限公司,上海,201316)
产细菌素的饲用乳酸菌的分离与鉴定
王娟1,2,3,蔡国林1,2,3,方华4,陆健1,2,3
1(江南大学, 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学, 生物工程学院,江苏 无锡,214122)3(江南大学, 粮食发酵工艺及技术国家工程实验室,江苏 无锡,214122)4(上海源耀生物股份有限公司,上海,201316)
禽畜产品中的抗生素残留严重威胁人类的健康,推行无抗养殖的重要途径就是发展发酵饲料。从饲料原料中分离得到能够抑制大肠杆菌生长的乳酸菌,通过排除发酵液中有机酸和H2O2的干扰,初步确定4株具有较强抑菌功能的乳酸菌。分别采用胰蛋白酶、蛋白酶K和胃蛋白酶处理发酵上清液后,其抑菌活性减小,初步确定抑菌活性物质为细菌素。进一步通过耐酸、耐胆盐和耐热实验确定1株适合动物肠道定植的乳酸菌R16,生理生化实验和16S rDNA基因序列分析鉴定该菌株为乳酸片球菌R16。筛选获得具有抑菌功能的、适合动物肠道定植和耐饲料加工的饲用乳酸菌对开发无抗发酵饲料具有重要的实用价值。
乳酸片球菌;细菌素;分离;鉴定
饲料在运输、储存过程中容易携带大肠杆菌、沙门氏菌等病原微生物,这些病原微生物随着饲料进入动物体内,会引起动物肠道传染病,对动物的健康构成严重威胁[1]。目前,在解决这一问题上使用最广泛的仍然是抗生素。随着抗生素的应用,细菌耐药性日益普遍,同时,抗生素的药物残留问题也逐渐引起了人们的注意[2]。世界许多畜牧发达国家和地区对抗生素的使用提出限制,研究和开发绿色饲料添加剂产品,已经成为世界性的研究课题[3]。
发酵饲料作为一种生态健康型饲料,不仅可以改善饲料营养的吸收水平、降解饲料原料中可能存在的抗营养因子和有毒有害物质,还可以促进动物生长、维持动物体肠道内微生态平衡、增强机体免疫力[4],是中国目前发展较快的绿色饲料,可以减少饲喂过程中抗生素的使用。细菌素也是一种重要的抗生素替代品,具有无副作用、无残留、无抗药性,不污染环境等优点,除此之外,还具有热稳定性,耐酸,耐低温贮藏等特性[5]。因此,如果在发酵饲料的同时,积累具有抑菌功能的活性物质,全面减少抗生素的使用,不仅可以提高饲料的品质,从而较好的保持饲料的营养价值和风味,而且可以抑制病原微生物的生长,增加饲料安全性[6]。然而,在现有细菌素产生菌的研究中缺乏适合肠道定植、耐饲料加工方面的研究[7],而现有发酵饲料用乳酸菌也主要是针对原料抗营养因子降解方面进行研究,对其代谢积累细菌素和肠道定植方面的研究尚属空白[4]。因此,综合研究细菌素的代谢积累和乳酸菌的肠道定植与耐饲料加工,不仅可以使乳酸菌发酵饲料发挥抑制病原菌的作用,而且可以对原料中的抗营养因子进行降解,改善饲料品质。
本研究从饲料原料中分离产细菌素的乳酸菌,并通过耐酸、耐胆盐和耐热性试验筛选动物肠道定植能力强和能够耐受饲料加工过程中的高温处理的乳酸菌,为饲料行业开发绿色饲料产品提供一个有效途径。
1 材料与方法
1.1材料与试剂
1.1.1样品
玉米秸秆,麸皮和豆粕等样品由上海源耀生物股份有限公司提供。
1.1.2指示菌
大肠埃希氏菌(Escherichiacoli),为上海源耀生物股份有限公司提供。
1.1.3培养基及试剂
MRS液体培养基(g/L):牛肉膏10.0,蛋白胨10.0,酵母膏5.0,葡萄糖20.0,吐温80 1.0,磷酸氢二钾2.0,乙酸钠5.0,柠檬酸三铵2.0,MgSO40.2,MnSO4·H2O 0.05,pH 6.8。121 ℃灭菌20 min。
MRS固体培养基(g/L):MRS液体培养基加琼脂2%,pH 6.8,121 ℃灭菌20 min。
MRS-CaCO3固体培养基(g/L):MRS液体培养基加琼脂2%,CaCO30.2%,pH 6.8,121 ℃灭菌20 min。
LB液体培养基(g/L):酵母膏5,胰蛋白胨10,NaCl 10,pH 7.0,121 ℃灭菌20 min。
LB固体培养基(g/L):LB液体培养基加琼脂2%,pH 7.0,121 ℃灭菌20 min。
PYG培养基(g/L):胰蛋白胨10,酵母膏10,葡萄糖 10,无机盐溶液40。
盐溶液成分(g/L):NaHCO310.0,K2HPO41.0,KH2PO41.0,NaCl 2.0,MgSO420.0,无水CaCl20.2。
培养基中使用的药品,胃蛋白酶和牛胆盐购自国药集团化学试剂有限公司;细菌基因组DNA提取盒,蛋白酶K和胰蛋白酶购自生工生物工程股份有限公司。
1.1.4PCR引物
27F:AGAGTTTGATCM TGGCTCAG,1492R:TACGGY TACCTTGTTACGACTT[8]。由上海生工生物工程技术服务有限公司合成。
1.2实验方法
1.2.1饲料原料中乳酸菌的筛选
将饲料原料与MRS液体培养基以1∶3的比例混合,置于37 ℃恒温培养箱中培养5 d,吸取培养液1 mL,用无菌生理盐水依次稀释至10-6倍,每个稀释度取100 μL涂布于MRS-CaCO3固体培养基,37 ℃厌氧培养24~48 h,挑选有溶钙圈的菌落在相应的培养基上划线直至纯菌落,4 ℃冰箱保存备用。
1.2.2指示菌的培养
将大肠杆菌接种于LB液体培养基中,于摇床上30 ℃,200 r/min振荡培养8 h,4 ℃保藏备用。
1.2.3产细菌素乳酸菌的筛选
将乳酸菌活化培养后,以1%接种量接种于MRS液体培养基中,37 ℃静置培养48 h,12 000 r/min,4 ℃离心15 min,收集上清液,过0.45 μm的膜,4 ℃保藏备用。
运用牛津杯法做抑菌实验:将LB固体及半固体培养基加热融化,置于50 ℃水浴中保温。先倾注10 mL LB固体培养基于平皿中,待其凝固后,倾注8 mL含107CFU/mL指示菌的LB半固体培养基,待其凝固后,轻轻放上牛津杯,5 min后取200 μL上清液加入牛津杯,4 ℃冰箱扩散1 h,置于30 ℃恒温箱中培养16 h,观察并测量抑菌圈。
1.2.4产细菌素乳酸菌的复筛
(1)排除有机酸的干扰
利用HPLC分析发酵液中主要有机酸的组分,配置相同浓度的有机酸混合液,调其pH与发酵上清液相同,以发酵上清液为对照,设3组平行,做抑菌实验[9]。
(2)排除过氧化氢的干扰
将发酵上清液置于80 ℃水浴10 min,以发酵上清液为对照,设3组平行,做抑菌实验[10]。
(3)酶处理对抑菌活性的影响
分别用胰蛋白酶、胃蛋白酶和蛋白酶K(浓度200 μg/mL)处理发酵上清液,在37 ℃水浴处理2 h,以未经酶处理的发酵上清液为空白对照,设3组平行,做抑菌实验[11]。
1.2.5产细菌素且能够耐酸耐胆盐乳酸菌的筛选
将活化的乳酸菌接种到MRS液体培养基中,37 ℃过夜培养,取1 mL过夜培养的菌液,10 000 r/min离心2 min,收集菌体,用PBS缓冲液(pH7.0)冲洗2次,分别用pH2.0、3.0、4.0、7.0的PBS缓冲液和含有0.1%、0.2%、0.3%猪胆盐的MRS重悬。以原菌液为对照,将不同pH(除pH7.0)和胆盐浓度的菌液在37 ℃处理3 h。将pH7.0含菌体的PBS缓冲液置于80 ℃处理30、60、90、120 s,处理的菌液进行梯度稀释,每个稀释度设3个重复,并涂板[12]。根据高鹏飞的方法对菌株的存活率进行计算[13]。
1.2.6产细菌素乳酸菌的鉴定
(1)生理生化特性鉴定
按照API 50 CHL试剂盒(购自生物梅里埃中国有限公司)说明书对所选菌株进行生理生化特性鉴定。
(2) 16S rDNA基因测序分析
细菌DNA按照细菌DNA小量抽提试剂盒(购自上海生工生物工程技术服务有限公司)的说明提取。提取的细菌DNA进行PCR,PCR引物和反应条件均参考RAHMAN等人的方法[14]。得到PCR扩增序列后,由上海生工生物工程技术服务有限公司测序,最后将基因序列在NCBI上(http://www.ncbi.nlm.nih.gov)进行Blast比对,对其进行分析鉴定。
(3)系统发育树构建
根据LPSN(http://www.bacterio.cict.fr/)公布的片球菌属(Pediococcus)标准菌株,通过MEGA 5.0 软件的邻位相连法,利用16S rDNA 序列构建系统发育树[15]。
2 结果与分析
2.1产细菌素乳酸菌的筛选
从玉米秸秆、麸皮和豆粕中共筛得52株具有溶钙圈的菌株,表明这些菌株可能产生乳酸,对这些菌株做抑菌试验,获得具有抑菌效果的菌株34株,这些菌株的抑菌效果频数分布如图1所示。由图1可知,具有抑菌效果的34株菌中抑菌圈直径大于5 mm的有32株,其中抑菌圈直径大于15 mm的有16株。考虑到发酵液中有机酸具有一定的抑菌效果,因此选取抑菌圈直径大于15 mm的菌株进行下一步实验。
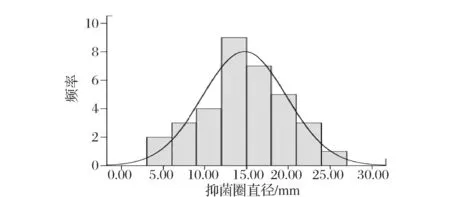
图1 有抑菌效果菌株的频率分布直方图Fig.1 The frequency distribution histogram of bacteriostatic strains
2.2产细菌素乳酸菌的复筛
通过排除过氧化氢、有机酸实验以及不同酶对抑菌活性的影响实验,选取有机酸、 过氧化氢对抑菌圈
影响小且不同酶对抑菌活性影响明显的菌株4株。以菌株R16为例,菌株R16排除过氧化氢实验如图2所示,对照的抑菌圈直径为(20.46 ±0.18) mm(图2.A),发酵上清液经80 ℃水浴处理过后的抑菌圈直径为(18.70 ±0.13) mm(图2.B),80 ℃水浴可以去除溶液中的过氧化氢,发酵上清液处理前后抑菌圈大小基本一致,说明菌株R16的抑菌效果不是由过氧化氢引起。菌株R16排除有机酸实验如图2.A/C所示,有机酸的抑菌圈明显小于菌株R16发酵上清液的抑菌圈,分别为(15.68±0.12) mm(图2.C)和(20.46 ±0.18) mm(图2.A),R11,R13和R17的结果与R16基本一致,由此可以判断菌株R11、R13,R16和R17的发酵液中除了有机酸对大肠杆菌有抑制作用外,还有另外一种物质在起作用。
不同酶对抑菌活性的影响实验如图3所示。从图3可以看出,胰蛋白酶,蛋白酶K和胃蛋白酶对4株菌株的抑菌活性均有不同的影响。其中菌株R11和R13对蛋白酶K最为敏感,抑菌直径只有7.98 mm和7.05 mm;菌株R16和R17对胰蛋白酶最为敏感,抑菌直径只有7.34 mm和7.26 mm,菌株R16除了对胰蛋白酶敏感外,对蛋白酶K也具有一定的敏感性。说明具有抑菌活性的物质是一种蛋白质。综合以上实验及相关文献可以初步确定菌株R11、R13,R16和R17为细菌素产生菌。
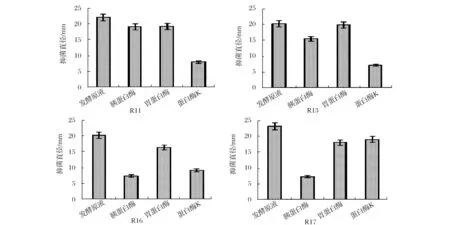
图3 不同酶处理对不同菌种抑菌活性的影响Fig.3 Effect of different enzymes on the antibacterial activity of different strains
2.3产细菌素且能够耐酸耐胆盐乳酸菌的筛选
乳酸菌能够调节动物肠道功能,因此作为直接饲喂微生物,所筛选的乳酸菌必须具有较强的胃酸及胆盐耐受性,以便能够长时间在肠胃中存活,除此之外,乳酸菌在添加到饲料中时要能够耐受饲料在加工过程中高温处理时的温度,因此对菌株的耐高温能力有一定的要求。菌株R11、R13、R16、R17在低酸、高胆盐和高温下的菌种存活情况如表1所示。由表1可知,经过37 ℃温育3 h之后,菌株R13和R16对酸和胆盐均具有一定的耐受性,在低pH和高胆盐条件下存活率都很高且都满足活菌数为106CFU/mL的要求[16],适合肠道定植;在80 ℃处理30、60、90、120 s后,菌株R13的生长明显减弱,说明高温对其存活率有较大的影响,而菌株R16表现出良好的耐受性,在温度为75~85 ℃,持续时间为1~2 min的制粒过程中[17],能够保证活菌数满足106CFU/mL。因此,将R16确定为目标菌。
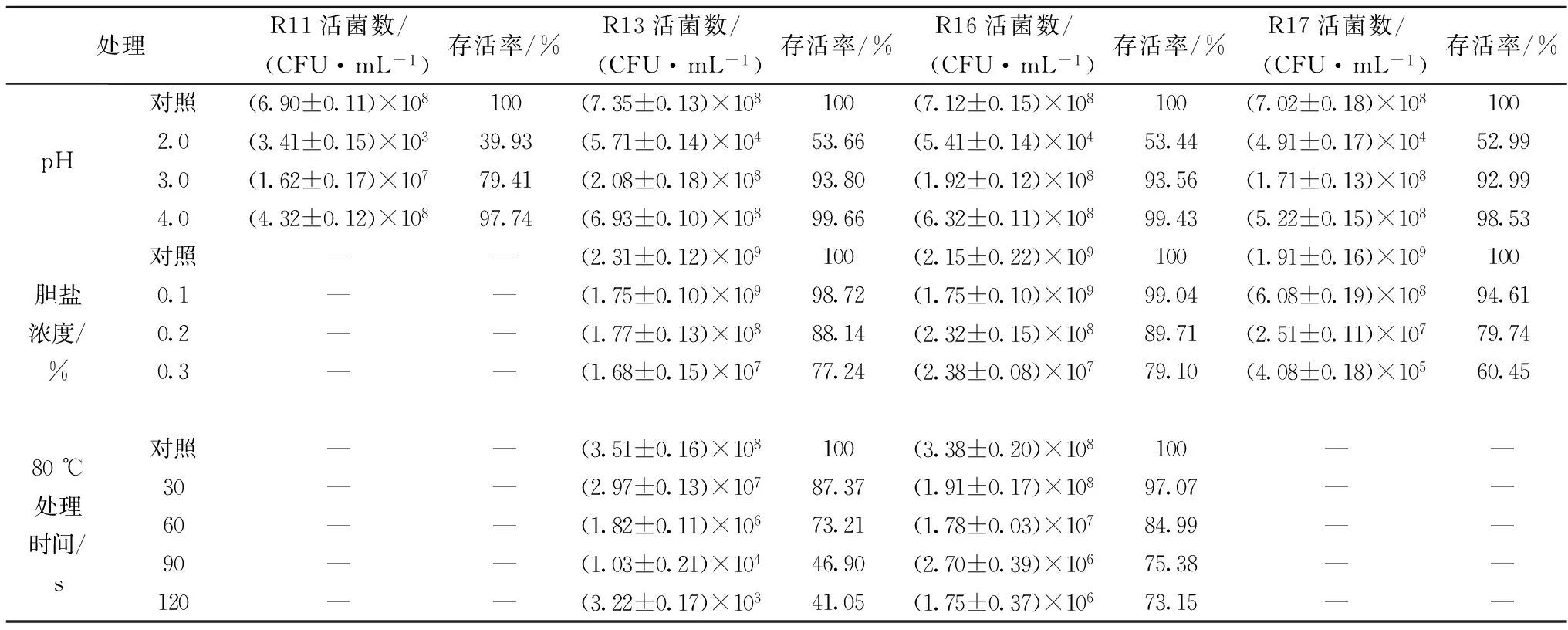
表1 菌株R16在不同条件下的存活情况
2.4产细菌素乳酸菌的鉴定
通过镜检可知,R16为革兰氏阳性菌、球型。通过过氧化氢酶测定和运动性检验试验可知菌株R16接触酶阴性,无运动性。采用梅里埃API 50 CHL试剂盒对菌株R16的生理生化鉴定结果如表2所示,由表2可知R16不但能够利用常规的葡萄糖和果糖,还能够利用植物原料纤维素和半纤维素的组成糖,如L-阿拉伯糖、D-木糖,半乳糖、甘露糖和D-纤维二糖等其他糖类。
在通用引物27F和1492R的扩增下,将其16SrDNA序列在NCBI上(http://www.ncbi.nlm.nih.gov)进行Blast比对,与PediococcusacidilacticiLAB2(注册号:JN039348.1)的序列一致性最高,为99%。依据菌株R16的形态、生理生化特性、16S rDNA序列分析,鉴定菌株R16为Pediococcusacidilactici,并将其命名为:PediococcusacidilacticiR16,符合农业部《饲料添加剂品种目录》2013规定的饲用微生物范畴。

表2 菌株R16的生理生化鉴定结果
注:+可发酵,-不可发酵,W弱发酵。
2.5系统发育树构建
根据片球菌属内的不同种16S rDNA序列,通过MEGA 5.0 软件的邻位相连法构建菌株R16的系统发育树,见图4。
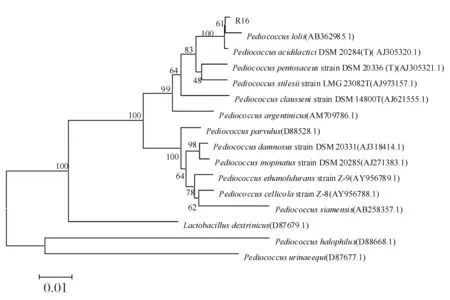
图4 菌株R16的系统进化树Fig.4 The phylogenetic tree of strain R16
由图4可知,菌株R16与PediococcusloliiAB362985.1的同源性最高,PediococcusloliiAB362985.1未见产细菌素的报道。
3 结论
从玉米秸秆中筛选出1株能够有效抑制大肠杆菌生长的乳酸菌。通过排除过氧化氢、有机酸对抑菌效果的影响,向发酵上清液中分别加入胃蛋白酶、蛋白酶K和胰蛋白酶,发现此物质对胰蛋白酶和蛋白酶K敏感,确定该物质为蛋白类物质。通过革兰氏染色、运动性检验、生理生化特性测定、16S rDNA序列测定和构建系统进化树对所筛选的菌株进行了菌种鉴定,发现所筛选的菌株与乳酸片球菌(Pediococcusacidilactici)的相似度高达99%,将其命名为乳酸片球菌R16(PediococcusacidilacticiR16)。符合农业部《饲料添加剂品种目录》(2013)规定的饲用微生物范畴。通过耐酸、耐胆盐实验和温度耐受性实验,发现乳酸片球R16具有很好的pH、胆盐和温度耐受性。筛选获得具有抑菌功能的、适合动物肠道定植和耐饲料加工的饲用乳酸菌对开发无抗发酵饲料具有重要的实用价值。
[1]王娟.禽畜产品中致病菌污染的危害、现状与对策[J].公共卫生,2013,30(12):24-28.
[2]郭洋,何利昆,马晓威,等.五种中药对仔猪白痢大肠杆菌的体外抑制试验[J].现代牧兽医,2009(4):54-55.
[3]王莹,万伶俐.绿色饲料添加剂的研究进展及其应用现状[J].现代农业科技,2009(9):241-244
[4]王晓伟,高鹏飞,姚国强,等.乳酸菌发酵饲料的优势及其在禽畜养殖中的应用[J].粮食与饲料工业,2015(7):47-55.
[5]田晓乐,孟庆繁,周杰,等.微生物防腐剂—细菌素的研究与应用[J].食品工业科技,2004,25(1):120-123.
[6]卢春晓,苗安顺,顾沛沛,等.细菌素在饲料中的应用及展望[J].养殖技术顾问,2007(7):106-107.
[7]郑邓祥.抗菌肽的来源、功能及其在禽畜生产中的应用[J].养殖与饲料,2014(7):33-35
[8]WEI G F,PAN L,DU H M,et al.ERIC-PCR fingerprinting-based community DNA hybridization to pinpoint genome-specific fragments as molecular markers to identify and track populations common to healthy human guts[J].Microbiological Methods,2004,59 (1):91-108.
[9]李洁,李晓然,宫路路,等.乳酸片球菌发酵液中主要有机酸及其抑菌性研究[J].食品与发酵工业,2014,40(5):124-129.
[10]李俊霞.产细菌乳酸菌的筛选、鉴定及培养基的优化[D].郑州:河南工业大学,2010.
[11]方芳.产细菌素乳酸菌的筛选、细菌素的纯化及其特性研究[D].呼和浩特:内蒙古农业大学,2008.
[12]王建设,赵海燕,王凡,等.乳酸片球菌的分离鉴定与益生功能的初步研究[J].中国农学通报,2012,28(24):201-206.
[13]高鹏飞,孙志宏,麻士卫,等.蒙古族儿童源益生特性双歧杆菌的筛选及鉴定[J].微生物学报,2009,39(2):210-216.
[14]ABDEL-RAHMAN M A,TASHIRO Y,ZENDO T,et al.Isolation and characterization of lactic acid bacterium for effective fermentation of cellobiose into optically pure homoL-(+)-lactic acid[J].Applied Microbiology and Biotechnology,2011,89(4):1 039-1 049.
[15]SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4(4):406-425.
[16]刘宏宇,汪立平,艾连中,等.乳酸菌的抗氧化活性和耐酸耐胆盐性能研究[J].食品工业科技,2014,35(2):92-96.
[17]郝生宏,谷春涛,萨仁娜,等.高温处理对三种益生菌的影响[J].饲料工业,2004,25(6):27-28.
Isolation and identification of a lactobacillus strain producing antibacterial material
WANG Juan1, 2, 3, CAI Guo-lin1, 2, 3,FANG Hua4LU Jian1, 2, 3*
1(The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology,Jiangnan University, Wuxi 214122, China) 2(School of Biotechnology, Jiangnan University, Wuxi 214122, China)3(National Engineering Laboratory for Cereal Fermentation Technology, JiangnanUniversity, Wuxi 214122, China)4(Shanghai Yuanyao Invertment Co, Shanghai201316, China)
Residual antibiotic in livestock products is a great threaten to human health. Therefore, the most effective way for implement of aquaculture without antibiotics is to develop fermented feed. In the present study, four lactic acid bacteria strains were isolated from feedstuff and identified to be active againstEscherichiacoliby excluding the disruption of organic acid and H2O2. By treating with trypsin, proteinase K and pepsin, the active substance was preliminarily identified as a bacteriocin secreted in LAB culture. Among the four LAB strains, the R16 strain was found to be resistant to acid, bile salt and high temperature and thus was suitable for colonization in intestinal tracts. This strain was then identified asPediococcusacidilacticibased on its physiological and biochemical characteristic and 16S rDNA gene sequence. Based on these results, it was of great practical value to isolate special LAB strains with bacteriostatic efficacy, engraftment capacity in animal intestinal and resistance to feed processing, for implement of aquaculture without antibiotics.
Pediococcusacidilactici; bacteriocin; isolation; identification
10.13995/j.cnki.11-1802/ts.201608007
硕士(陆健教授为通讯作者,E-mail:jlu@jiangnan.edu.cn)。
工业生物过程高效转化与系统集成的科学基础研究,973项目(2013CB733602);江苏高校优势学科建设工程资助项目。
2015-11-04,改回日期:2016-01-28
