高效液相色谱-质谱/质谱法测定茶叶中的草甘膦和氨甲基膦酸残留
2016-10-13肖泳唐吉旺袁列江林源吴海智
肖泳,唐吉旺,袁列江,林源,吴海智
(湖南省产商品质量监督检验研究院,湖南 长沙,410007)
高效液相色谱-质谱/质谱法测定茶叶中的草甘膦和氨甲基膦酸残留
肖泳*,唐吉旺,袁列江,林源,吴海智
(湖南省产商品质量监督检验研究院,湖南 长沙,410007)
建立了高效液相色谱-质谱/质谱法测定茶叶中的草甘膦(PMG)和氨甲基膦酸(AMPA)残留量的测定方法。样品采用超纯水提取、氯甲酸-9-芴基甲酯衍生,再经HLB柱净化后上机测定,并以内标法定量。结果表明:草甘膦和氨甲基膦酸在0.001~0.5 mg/L内线性良好,相关系数(R2)分别为0.999 9和0.999 8,平均回收率和相对标准偏差分别为78.2 %~103.4 %和2.1 %~6.2 %,方法的定量下限分别为1.0 μg/kg和7.5 μg/kg。该方法基质干扰小、灵敏度高、准确可靠,适用于茶叶中草甘膦及氨甲基膦酸残留量的定量检测。
草甘膦;氨甲基膦酸;茶叶;高效液相色谱-质谱/质谱
草甘膦(glyphosate,也简称PMG),是一种广效型的有机磷除草剂,因其高效、低成本,得以普遍推广使用,茶叶地也不例外。PMG及其主要代谢产物氨甲基膦酸(aminomethylphosphonic acid,AMPA)易被茶叶的叶片吸收,导致茶叶中草甘膦残留量超标,影响消费者的食用安全及茶叶的出口贸易。
目前,PMG和AMPA残留的检测方法有气相色谱法[1-2]、液相色谱法[3-9]、离子色谱法[10-14]、气相色谱-质谱法[15-17]、液相色谱-串联质谱法[18-25];常用的提取溶剂有纯水、水/二氯甲烷、NaOH溶液等,CAO等[24]研究发现,纯水的提取效果最好;净化常用的固相萃取柱有C18柱、CAX阳离子交换柱、MAX阴离子交换柱等,ZHOU等[4,24]研究表明C18柱对板栗、稻米样品具有较好的净化作用。针对茶叶样品中PMG和AMPA残留的检测,现有国标主要采用SN/T 1923—2007,该标准采用的是CAX阳离子交换柱,实验发现,洗脱时由于洗脱液中水占比例大,不易浓缩蒸干,需耗费大量的时间和精力;艾普锐生物科技有限公司研制的IPRE Qclean PMG 蓝柱和红柱[26],可吸附杂质,起到浓缩和较好的净化作用。基于已有的实验研究,本试验优化、对比研究了4种不同的前处理方式,旨在建立一种高效、灵敏的茶叶中PMG和AMPA残留量检测的液相色谱-质谱/质谱法。
1 材料与方法
1.1仪器与设备
Thermo Scientific TQS Quantum U1tra-AM高效液相色谱-质谱/质谱仪;SK-1快速混匀仪,常州澳华仪器有限公司;MTN-2800W氮吹仪,天津奥特赛恩斯仪器有限公司;超声波清洗器,杭州汇尔仪器设备有限公司;Millipore Elix® Essential 3超纯水仪,法国默克密理博公司;TG16-WS台式高速离心机,长沙维尔康湘鹰离心机有限公司;Minispin迷你高速离心机,Eppendorf 中国有限公司。
1.2试剂与材料
草甘膦(纯度99.9 %),Fluka公司;氨甲基膦酸(纯度99.0 %),Dr.Ehrenstorfer GmbH公司;草甘膦-13C215N(PMG(IS),(纯度98 %),Fluka公司;氯甲酸-9-芴基甲酯(FMOC-Cl,纯度99.0 %),Fluka公司;HLB固相萃取小柱(60 mg/3 mL),Waters公司;C18-SPE小柱(200 mg/3 mL),Agela公司;四硼酸钠(Na2B4O7,分析纯),上海强顺化学试剂有限公司。
1.3标准溶液及衍生试剂的配制
准确称取10 mg的PMG和AMPA标准品,用水定容至50 mL,配成质量浓度为200 μg/mL的混合标准储备液,使用时用水逐级稀释至所需浓度;准确称取5 mg的PMG(IS),用水定容至50 mL,配成质量浓度为100 μg/mL的标准储备液,再用水稀释成1 μg/mL的标准工作液;用乙腈将衍生试剂FMOC-Cl配成质量浓度分别为0.5、2、25 g/L的工作液。
1.4样品前处理
称取2.0 g粉碎均匀的茶叶样品置于50mL具塞离心管中,加入1.0 μg的PMG(IS)标准工作液,混匀静置10 min,加入20 mL超纯水,混匀并超声提取30 min,离心,取上清液过0.45 μm水系滤膜,待净化衍生。
方法一:取200 μL上述提取液,加质量分数5%NaOH水溶液调pH值至7~9(用pH试纸,约加5 μL),加水至600 μL,加200 μL 5%硼酸盐缓冲溶液,混匀,再加入200 μL衍生试剂,充分混匀,衍生一定的时间,高速离心后取上清液过0.45 μm有机滤膜,上机测定。
方法二:取C18固相萃取小柱,用3 mL甲醇、3 mL水活化,弃去透过液。缓慢加入1 mL上述提取液,收集透过液,再加入1.5 mL水洗脱并收集,混匀后加5%NaOH水溶液调pH值至7~9(用pH试纸,约加5 μL),加水定容至3 mL,混匀。取600 μL净化液加200μL 5%硼酸盐缓冲溶液,混匀,再加入200 μL衍生试剂,充分混匀,衍生一定的时间,高速离心后取上清液过0.45 μm有机滤膜,上机测定。
方法三:按方法一衍生一定的时间后,加入甲酸(约50 μL)调pH值至3,混匀,高速离心取上清液备用;取HLB固相萃取小柱,用3 mL甲醇、3 mL质量分数2%的甲酸水溶液活化,将备用液过柱,加入3 mL水淋洗并减压抽干2~3 min,再加入3 mL正己烷淋洗并减压抽干2~3 min,用6 mL 5%的氨水-甲醇溶液洗脱,收集洗脱液于40 ℃缓慢氮吹至干,加1 mL质量分数10%乙腈水溶液(含0.1%甲酸)溶解残渣,过0.45 μm有机滤膜,上机测定。
方法四:取C18固相萃取小柱,按方法二处理,衍生一定的时间后按方法三处理。
1.5液相色谱-质谱/质谱条件
1.5.1色谱条件
色谱柱:色谱柱:Thermo Hypersil Gold 柱(100 mm×2.1 mm,1.9 μm);柱温:40 ℃;进样体积:10 μL;流速:0.5 mL/min;流动相:A为0.1%甲酸水溶液,B为乙腈;梯度洗脱程序:0~1.0 min,10~40% B;1.0~4.5 min,40%~95% B;4.5~5.0 min,95% B;5.0~5.1 min,95%~10% B;5.1~7.0 min,10 % B。
1.5.2质谱条件
离子源:电喷雾电离源(ESI);扫描极性:正离子;扫描方式:多反应监测(MRM);毛细管温度:350 ℃;蒸发温度:300 ℃;鞘气压力45.0 Arb;辅助气压力:10.0 Arb;喷雾电压:3 500 V;其他质谱条件见表1。

表1 PMG、PMG(IS)和AMPA的保留时间及多反应监测质谱参数
注:*定量离子。
2 结果与分析
2.1衍生反应条件的优化
选用PMG、 AMPA、PMG(IS)混合标准溶液(最终浓度均为10 ng/mL)进行试验,衍生试剂的浓度分别为0.5、2、25 g/L,按试验方法一进行衍生净化,衍生时间分别为衍生20 min(超声),衍生1、2、3、5、24 h(超声20 min),试验结果如图1~图3所示。
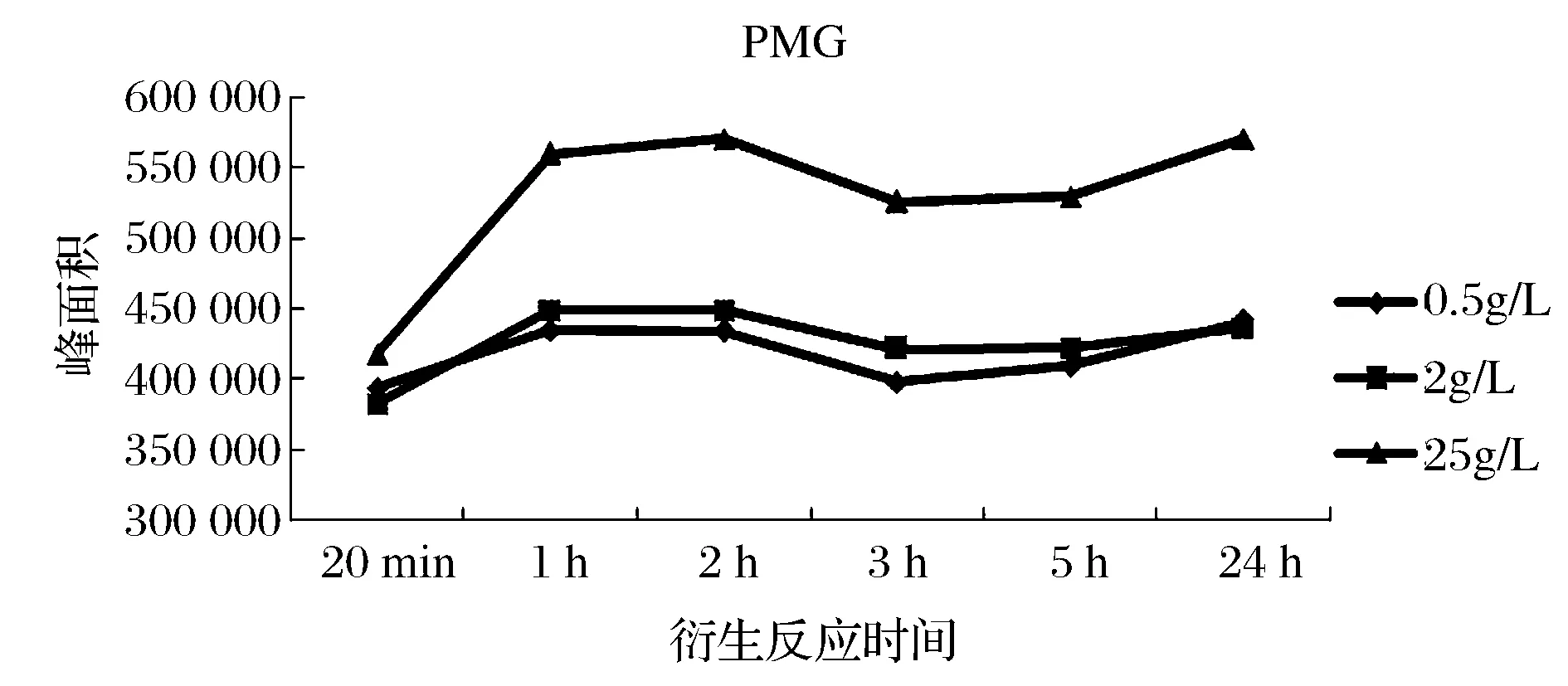
图1 衍生试剂浓度和衍生时间对PMG衍生效率的影响Fig.1 Effect of derivative reagent concentration andderivatization time on the derivative efficiency of PMG
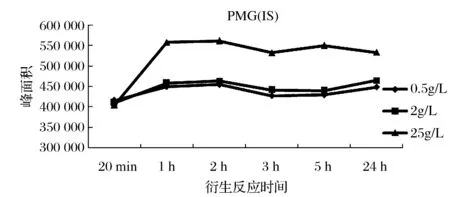
图2 衍生试剂浓度和衍生时间对PMG(IS)衍生效率的影响Fig.2 Effect of derivative reagent concentration andderivatization time on the derivative efficiency of PMG(IS)
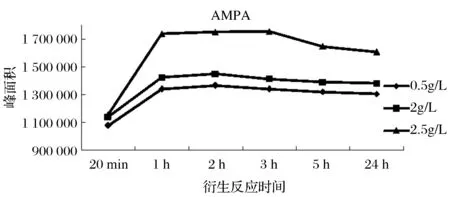
图3 衍生试剂浓度和衍生时间对AMPA衍生效率的影响Fig.3 Effect of derivative reagent concentration andderivatization time on the derivative efficiency of AMPA
由图1~图3可知,当衍生时间为1 h(超声20 min)时, PMG、PMG(IS)、AMPA均衍生完成,此后随着时间的增加,衍生产率变化不明显;当衍生试剂浓度为0.5 g/L和2 g/L时,PMG、PMG(IS)、AMPA的衍生产率基本接近,当选择25 g/L浓度时,三者的衍生产率均明显高于低浓度时;通过内标法计算,无论选取何种浓度的衍生试剂、衍生多久的时间,标准溶液中PMG/PMG(IS)、AMPA/PMG(IS)的峰面积比值间均无显著性差异。因此,为保证衍生反应充分,选取衍生时间为1 h(超声20 min)。
考虑到茶叶样品色素杂质较多,基质较复杂,在选择衍生试剂浓度时,进一步选取茶叶加标样品进行试验(最终加标浓度均为5 ng/mL),按方法三进行衍生净化,衍生时间为1 h(超声20 min),其样品加标图谱如图4~图6所示。

图4 衍生试剂0.5 g/L时PMG、AMPA的定量离子色谱图Fig.4 The quantitative ion chromatogram of PMG and AMPA in 0.5 g/L of derivative reagent

图5 衍生试剂2 g/L时PMG、AMPA的定量离子色谱图Fig.5 The quantitative ion chromatogram of PMG and AMPA in 2g/L of derivative reagent

图6 衍生试剂25 g/L时PMG、AMPA的定量离子色谱图Fig.6 The quantitative ion chromatogram of PMG and AMPA in 25g/L of derivative reagent
由图4~图6可知,随着衍生试剂浓度的增加,PMG、 AMPA衍生产物的响应逐渐提高,且当衍生试剂浓度为25 g/L时,AMPA的峰形更好,基质干扰更小。因此,结合图1~图6,选择衍生试剂浓度为25 g/L。
2.2净化方式的选择
选取空白茶叶样品进行加标,按前处理中方法一、二、三、四进行提取、净化、测定,最终加标浓度分别为10、50、100 ng/mL,每个水平重复5次;对于标准溶液,分别吸取一定体积的混合标准工作液,调pH值至7~9后加水至0.6 mL,按方法一、三进行衍生、净化、测定,最终浓度分别为1、2、5、10、50、100、200、500 ng/mL,再采用内标法,分别以定量离子的峰面积比值对浓度绘制标准曲线,所有样品、标样中内标物质的最终浓度均为10 ng/mL;对于方法的定量限,通过称取2.0 g空白样品加标测试,计算得出4种前处理方法的PMG、AMPA的定量下限(LOQ,S/N=10)。4种前处理方法的线性关系、相关系数、加标回收率、精密度、定量限见表2。

表2 四种前处理方法的线性关系、相关系数、加标回收率、精密度(RSD)及定量限
由表2可知,在1 ~ 500 ng/mL内,PMG和AMPA均呈良好的线性关系,其R2均超过0.999;对于PMG,茶叶加标样品经4种前处理方法处理后,其加标回收率均超过了90%,且其RSD均小于10%,定量限均为1.0 μg/kg,说明这4种方法均能用于茶叶样品中PMG的检测;对于AMPA,方法三回收率最高,且定量限低于其他方法,说明HLB柱能有效降低茶叶样品的基质干扰,增强灵敏度,而C18柱对茶叶样品的除杂效果不明显;通过批量试验发现,茶叶提取液衍生后颜色较深,直接上机会造成离子源污染,需经常清洗离子源,且由于待测溶液中含有较高浓度的缓冲盐,易导致离子源喷针堵塞,而衍生后的样液经HLB柱净化后基本无色,且能除去样液中的缓冲盐,有效降低仪器的损耗。
综合试验结果表明,茶叶中PMG和AMPA的最佳衍生净化方法为:样品经纯水提取后采用25 g/L的衍生试剂衍生反应1 h(超声20 min),再经HLB柱净化后上机测定。该方法在1 ~ 500 ng/mL内,PMG和AMPA均呈良好的线性关系,其相关系数(R2)分别为0.999 9和0.999 8;在加标10~100 ng/mL内,PMG的平均回收率为93.8%~103.4%,RSD为2.1% ~ 5.9%,其定量限为1.0 μg/kg;AMPA的平均回收率为78.2%~84.3%,RSD为3.4%~6.2%,其定量限为7.5 μg/kg,均能够满足GB/T 27404—2008《实验室质量控制规范食品理化检测》的检测要求。
2.3实际样品的测定
按所建立的方法对15批次茶叶样品中PMG和AMPA的实际残留量进行测定,并对其中一个批次的茶叶样品进行加标(加标浓度为0.01 μg/mL),以用于过程控制。结果表明,所测样品中有2份检出了PMG和AMPA,PMG含量分别为0.57、0.040 mg/kg,AMPA含量分别为0.11、0.015 mg/kg;实际样品及其加标图谱如图7所示,经计算PMG的回收率为98.5%,AMPA的回收率为82.1%,表明该批样品测定结果稳定、可靠。

图7 实际样品及其加标样品中PMG和AMPA的定量离子色谱图Fig.7 The quantitative ion chromatograms of PMG and AMPA in the actual and standard samples
3 结语
本文建立了高效液相色谱-质谱/质谱法检测茶叶中草甘膦及氨甲基膦酸残留量的检测方法,方法以内标法定量,采用纯水提取、氯甲酸-9-芴基甲酯试剂衍生,再经HLB柱净化后上机测定。结果表明,方法具有基质干扰小、灵敏度高、准确可靠等特点,适用于茶叶中草甘膦及氨甲基膦酸残留量的定量检测,可为茶叶的安全监管及质量控制提供技术支持。
[1]胡继业,赵殿英,宁君,等.气相色谱-氮磷检测器测定草甘膦在土壤和苹果中的残留量[J].农药学学报,2007,9(3):285-290.
[2]楼正云,朱国念,吴慧明. 池塘水中草甘膦残留检测方法的研究[J].宁波高等专科学校学报,2001,13(3):141-144.
[3]AOAC Official Method 991.08. Glyphosate and aminomethylphosphonic acid (AMPA) in Environmental Water-Liquid Chromatographic Method[S].
[4]周艳明,李娜,赵瑛博,等.板栗中草甘膦残留量测定的高效液相色谱方法研究[J].食品科学,2008,29(9):461-464.
[5]吴晓红,杨文远.用反相高效液相色谱法测定农药草甘膦含量的研究[J].宁夏大学学报, 2006,27(4):351-353.
[6]陈际,袁晓静,胡家琦,等.柱后衍生-高效液相色谱法测水中草甘膦[J].化工管理, 2014(9):44-45.
[7]汪立高,杨仁斌,魏 凤.土壤中残留草甘膦检测方法及其消解动态研究[J].湖南农业科学, 2011,(23):85-88.
[8]石宏宇,张海柱,韩艳艳,等.配体交换色谱法测定草甘膦[J].分析化学,2009,37(5): 737-740.
[9]周艳明,李娜,牛森,等.液相色谱法检测水中草甘膦残留量的研究[J].中国测试技术, 2007,33(3):114-116.
[10]刘美平,徐荣,张凌云,等.离子交换色谱法测定水体中的草甘膦[J].供水技术,2011,5(4):52-54.
[11]王莹,魏慧珠,马颖.离子色谱法测定水源水和生活饮用水中的草甘膦[J].供水技术,2012,6(1):53-55.
[12]吴杰,方黎,苏宇亮.离子色谱法同时检测饮用水中的2,4 滴和草甘膦[J].给水排水,2008,34(2):30-31.
[13]张雄波,吴孟李.抑制型电导检测饮用水中草甘膦的研究[J].广东化工,2010,37(6):206-207.
[14]刘玉欣,李锦,常凤启,等.离子色谱法检测饮用水中的草甘膦[J].岩矿测试,2011,30(3):361-363.
[15]AOAC Official Method 2000.05. Determination of Glyphosate and Aminomethylphosphonic Acid (AMPA) in Crops-Gas Chromatography with Mass-Selective Detection[S].
[16]NY/T 1096—2006.食品中草甘膦残留量测定[S].
[17]GB/T 23750—2009.植物性产品中草甘膦残留量的测定-气相色谱-质谱法[S].
[18]李波,邓晓军,郭德华,等.高效液相色谱-串联质谱法检测食品中的草甘膦及其主要代谢物氨甲基膦酸残留[J].色谱,2007,25(4):486-490.
[19]郭浩,张松,宋胜利,等. 亲水性相互作用色谱-串联质谱联用法检验鱼塘水中的草甘膦[J].分析试验室,2013,32(6):93-96.
[20]郑和辉,李洁,魏建荣,等.液相色谱串联质谱法直接进样测定水中呋喃丹、草甘膦、灭草松和2,4-滴[J].卫生研究,2009,38(3):302-303.
[21]郑和辉,卞战强,田向红,等.正相色谱串联质谱法直接进样测定水体中的草甘膦和2,4-滴残留[J].环境卫生学杂质,2014,4(4):395-397,402.
[22]SN/T 1923—2007.进出口食品中草甘膦残留量的检测方法-液相色谱-色谱/质谱法[S].
[23]莫佳琳,缪璐,干宁军.超高效液相色谱-串联质谱法检测甘蔗中的草甘膦残留量[J].现代食品科技,2011,27(9):1 143-1 145,1 156.
[24]曹赵云,牟仁祥,陈铭学.液相色谱-串联质谱法测定稻米中的草甘膦和氨甲基膦酸残留[J].色谱,2010,28(8):743-748.
[25]周爽,徐郭明, 林立毅,等.反反相色谱-串联质谱法直接测定植物源性食品中草甘膦及其代谢物残留[J].分析测试学报,2013,32(2):199-204.
[26]IPRE Science & Technology.草甘膦、氨甲基膦酸、草铵膦的检测方法[EB/OL]. [2013-10-15]. http://www.servicetech.com.cn/down/html/?16.html.
Determination of glyphosate and aminomethylphosphonic acid residues in tea using high performance liquid chromatography-mass spectrometry/mass spectrometry
XIAO Yong*,TANG ji-wang,YUAN Lie-jiang,LIN Yuan,WU hai-zhi
(Hunan Province Produce Commodity Quality Supervision Testing & Research Institute, Changsha 410007,China)
A method was developed for the determination of glyphosate (PMG) and aminomethylphosphonic acid (AMPA) residues in tea using high performance liquid chromatography-mass spectrometry / mass spectrometry. The sample was extracted with water and 9-Fluorenylmethyl chloroformate derivatives, and purified by HLB solid phase extraction cartridge and then determined, and quantified by internal standard method. The results showed that the linearity of PMG and AMPA were in the concentration range from 0.001 to 0.5 mg/L, the correlation coefficient (R2) were 0.9999 and 0.9998, the average recoveries ranged from 78.2% to 103.4%, and the relative standard deviations ranged from 2.1% to 6.2%; the lower limit of quantification of the method were 1.0 ug/kg and 7.5 ug/kg, respectively. This method had less matrix interference, high sensitivity. It is accurate and reliable, suitable for the quantitative detection of PMG and AMPA residues in tea.
glyphosate;aminomethylphosphonic acid;tea;HPLC-MS/MS
10.13995/j.cnki.11-1802/ts.201609037
硕士(本文通讯作者,E-mail:xy882008@163.com)。
2016-01-27,改回日期:2016-03-02
