植物乳杆菌B002冻干工艺的条件优化
2016-10-13曹珂珂张立丰李妍
曹珂珂,张立丰,李妍
(蚌埠学院, 生物与食品工程系,安徽 蚌埠,233030)
植物乳杆菌B002冻干工艺的条件优化
曹珂珂,张立丰,李妍
(蚌埠学院, 生物与食品工程系,安徽 蚌埠,233030)
以植物乳杆菌B002为目标,研究了该菌株在冻干过程中菌泥和保护剂平衡时间、预冷冻时间和冻干保护剂对菌粉存活率的影响。结果表明,在以质量浓度100 g/L脱脂乳为基础保护剂的条件下,4 ℃,6 000 r/min离心15 min,菌泥和保护剂在室温下平衡40 min,厚度5 mm,-45 ℃预冷冻2 h,复合保护剂为质量浓度100 g/L的脱脂乳、80 g/L麦芽糊精、30 g/L谷氨酸钠和100 g/L海藻糖,在上述条件下真空冷冻干燥24 h,植物乳杆菌B002冻干存活率达到75.9%。
植物乳杆菌;真空冷冻干燥;保护剂
随着研究人员对乳酸菌益生功能的不断发现和机理的不断研究,乳酸菌类产品的用途越来越广泛[1]。蔬菜发酵专用乳酸菌剂的制备,不仅可以高效发酵蔬菜,缩短生产周期,而且还能降低成本,提高生产效率[2]。乳酸菌剂可以通过喷雾干燥、真空干燥、冷冻干燥等方法制备,其中真空冷冻干燥效果相对较好。真空冷冻干燥用于微生物冻干菌粉制备是利用微生物的生理生化特点,冻干后微生物代谢减缓,生长繁殖受抑制,处于休眠状态,因而能保持菌株原有特性[3]。但冷冻干燥会对细胞造成机械损伤,溶质损伤,细胞膜通透性改变,蛋白质变性,DNA损伤,造成菌粉存活率下降[4-5],因此提高菌粉存活率是关键。
影响菌粉存活率的因素有很多,比如菌种、细胞性状、细胞生长状态、离心条件、预冷冻时间和温度、保护剂系统、复水介质等[6]。保护剂可以改变细胞在冻干过程中的物理、化学环境,减轻菌体在冷冻和复水时受到的损伤,尽可能保护菌种的原有特性[7]。在前期研究中,笔者从酸黄瓜中分离到植物乳杆菌B002(LactobacillusplantarumB002),该菌具有一定的产酸,耐盐,降低亚硝酸盐含量和胆固醇的能力,在MRS增殖培养基中能实现高密度培养,其冻干菌粉可以用于蔬菜发酵中。本试验对植物乳杆菌B002冷冻干燥条件和冻干保护剂进行优化,以期为提高菌粉冻干存活率及开发商品化蔬菜发酵专用乳酸菌剂提供理论基础。
1 材料与方法
1.1材料与试剂
1.1.1菌种
植物乳杆菌B002(L.plantarumB002 )分离自酸黄瓜,由蚌埠学院微生物菌种保藏室保存。
1.1.2培养基
MRS液体培养基(g/L):蛋白胨10,牛肉膏10,酵母膏5,葡萄糖20,乙酸钠5,柠檬酸二铵2,KH2PO42,吐温-80 1,MnSO40.25,MgSO40.58,pH 6.5。MRS固体培养基:在MRS液体培养基中加入20 g/L的琼脂。MRS增殖培养基:在MRS液体培养基中,添加体积分数为5%的番茄汁,质量浓度为30 g/L的葡萄糖和25 g/L的胰蛋白胨。
1.2试剂与设备
1.2.1试剂
海藻糖(上海凯尔生物科技有限公司)、谷氨酸钠(国药集团化学仪器试剂公司)、麦芽糊精(上海强顺化学试剂有限公司)等均为生化试剂级;甘油(天津市永大生化试剂有限公司)、VC(国药集团化学仪器试剂公司),均为分析纯。
1.2.2设备
BHC-1300ⅡA/B2生物洁净安全柜,苏州净化设备有限公司;DW-HL328超低温冷冻储藏箱,中科美菱低温科技有限公司;BSD-YX2200立式智能精密摇床,上海恒讯实业有限公司医疗设备厂;JW-3021高速离心机,安徽嘉文仪器装备有限公司;YM50压力蒸汽灭菌器,上海申安医疗器械厂;ALPHA1-2LD冷冻干燥机,德国CHRIST公司。
1.3实验方法
1.3.1实验流程
菌种活化→菌种增殖培养→离心→加保护剂→预冷冻→真空冷冻干燥→冻干菌粉复水→活菌计数。
1.3.2菌种活化
将植物乳杆菌B002按照体积分数3%的接种量,接入到100 mL MRS液体培养基中,37 ℃培养12 h。
1.3.3菌体增殖培养及菌泥的收集
将活化好的菌悬液以体积分数5%的接种量接种到100 mL MRS增殖培养基中,37 ℃培养20 h。然后将菌悬液放置于离心管中,4 ℃,6 000 r/min离心15 min,用等量的生理盐水洗涤沉淀2次,在同样的条件下离心15 min,弃去上清液,收获菌泥。
1.3.4菌泥和保护剂平衡时间的选择
将菌泥悬浮于等体积的质量浓度100 g/L脱脂乳保护剂中,混合后取0.1 mL稀释涂平板,37 ℃培养48 h,计活菌数。余下的菌悬液在室温下平衡10、20、30、40、50、60 min,放置于平皿中,冻干厚度5 mm,-45 ℃的冰箱中预冷冻2.5 h,并对冻干后的样品进行活菌计数。
1.3.5预冷冻时间的选择[8-9]
重复1.3.4的操作,菌泥和保护剂在室温下平衡40 min,在-45 ℃的冰箱中预冷冻1、1.5、2、2.5、3 h,并对冻干后的样品进行活菌计数。
1.3.6单一冻干保护剂的选择[10]
取2 mL含有脱脂乳的菌悬液与2 mL添加不同浓度的冻干保护剂(脱脂乳、可溶性淀粉、甘油、谷氨酸钠、蔗糖、海藻糖、VC和麦芽糊精)混合均匀,根据上述试验结果,选择最优的菌泥和保护剂平衡时间和预冷冻时间,-65 ℃真空冷冻干燥24 h,冻干后加入与冻干前等体积的无菌生理盐水复水,稀释涂平板,活菌计数。
1.3.7复合保护剂的优化
根据单因素试验结果进行冻干保护剂的筛选,选择对植物乳杆菌B002冻干存活率影响较大的4个因素即A脱脂乳、B麦芽糊精、C谷氨酸钠和D海藻糖进行4因素3水平的正交试验。正交试验因素水平表如表1。

表1 正交因素水平表
1.3.8冻干存活率的计算
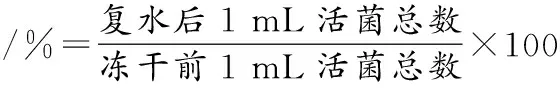
(1)
2 实验结果与分析
2.1菌泥和保护剂的平衡时间对冻干存活率的影响
菌泥和保护剂的平衡时间长短会影响保护剂进入菌泥的程度,进而影响冻干存活率。平衡时间对冻干存活率的影响结果如图1所示。随着平衡时间的延长,冻干存活率逐渐增加,在室温下平衡40 min后,植物乳杆菌B002的冻干存活率最大。随着时间的进一步延长,冻干存活率有所下降,可能是对植物乳杆菌B002的保护性降低,也可能出现负效应[11]。
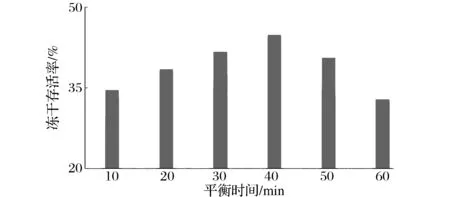
图1 菌泥和保护剂平衡时间对冻干存活率的影响Fig.1 Effect of bacteria and protective agent balance time for freeze-dried survival rate
2.2预冷冻时间对冻干存活率的影响
菌体悬浮于保护剂中后,要先进行预冷冻使其完全冻结再进行真空冷冻干燥。这是由于细胞在冷冻过程中细胞膜通透性发生改变,部分细胞会因此而受损或死亡。预冷冻是将细胞中的游离水固化,使产品冻干前后形态保持一致,减少因温度降低而引起的物质可溶性降低和生命特征的变化[11-12]。冷冻速度较慢,细胞外部形成冰晶,胞内水分会外渗到胞外,溶质会受损;冷冻速度较快,胞内水分还来不及外渗就被冻成冰晶因而会损伤细胞[8],因此应选择最佳的冷冻速率来保护细胞。冻干时间过长会造成能源浪费。由图2可知,植物乳杆菌B002的冻干存活率随着预冻时间的延长会产生变化,预冷冻可以促进菌体的低温应激反应,提高菌体存活率,同时预冷冻时加入保护剂也在一定程度上保护了菌体的活性。-45 ℃预冷冻2 h冻干存活率相对较高,再延长预冷冻时间,冻干存活率变化趋势并不很明显,所以本实验选择-45 ℃预冷冻2 h。
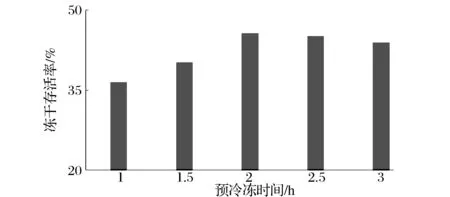
图2 预冷冻时间对冻干存活率的影响Fig.2 Effect of pre-freezing time of freeze-dried survival rate
2.3冻干保护剂的选择
2.3.1单一保护剂的选择
对每种单一保护剂设计不同的浓度,测其对菌体冻干存活率的影响,其中每种保护剂的最佳保护浓度和对菌体冻干存活率的影响结果如表2所示。相比较,脱脂乳、麦芽糊精和海藻糖的冻干效果较好。
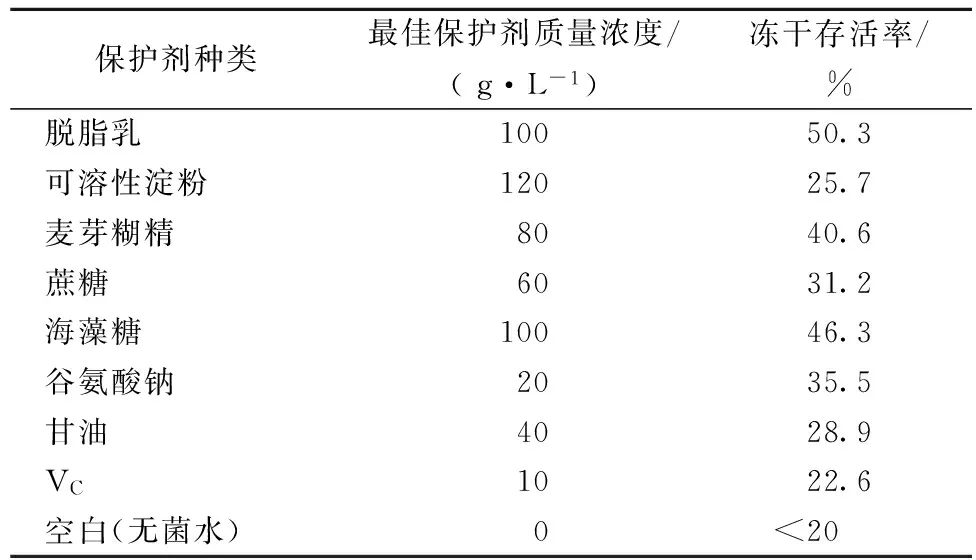
表2 单一保护剂对菌体冻干存活率的影响
冻干保护剂可以改变生物制品在冻干过程中的理化环境,减少冻干及复水时对细胞的损伤,尽可能保持其原有的生理活性和生物学性质[13-14]。冻干保护剂可以分为大分子冻干保护剂,如可溶性淀粉、糊精、脱脂乳;小分子保护剂如糖醇类、氨基酸类。不同的保护剂有不同的特点。从表2可以看出,大分子保护剂效果相对较好,尤其是脱脂乳,可能是脱脂乳含有乳清蛋白,能在细胞表面形成膜对细胞进行保护,并能固定酶类,防止细胞壁由于蛋白质破坏而造成的胞内物质泄漏;同时脱脂乳中还含有乳糖,也可以对细胞进行保护[15]。麦芽糊精以“包裹”的方式保护菌体[8]。海藻糖的保护效果优于蔗糖,可能是海藻糖是一种天然的非还原性双糖,高粘度、低流动性,并且具有较高的玻璃化转化温度,在冻干过程中,能有效的阻止冰晶的形成,稳定细胞膜和蛋白质的结构,其作为保护剂效果非常显著[16]。谷氨酸钠和甘油也有一定的保护作用[17],可能是谷氨酸钠能进入细胞,调节细胞内部理化平衡,同时还能联合保护剂中的其他成分,对菌体进行保护;甘油能渗透到细胞内,将细胞内溶质浓度提高,使得细胞外的渗透压减小,大大减少细胞的水分流失;在细胞外,甘油也可以与水分子结合,从而发生水合作用,进而达到弱化水的结晶过程的目的,减轻细胞外溶质浓度升高对细胞的损伤。
2.3.2复合保护剂的优化
不同的保护剂有不同的保护原理和特点,单一保护剂效果相对低于复合保护剂,所以为了寻找适合植物乳杆菌B002的复合保护剂,本研究根据单因素试验选择不同类型、保护效果相对较好的脱脂乳、海藻糖、麦芽糊精和谷氨酸钠进行4因素3水平的正交优化实验。正交试验结果如表3。

表3 正交试验结果
由表3可以看出,复合保护剂较单一保护剂效果要好,可能是复合保护剂中不同种类的物质通过不同的方式对菌体进行保护。同时,这些保护剂间又具有协同作用。如果复合保护剂中的各种保护剂比例和质量浓度达到协调,将会加速干燥,且能在保存期间维持较高的细胞存活率,达到最佳的保护效果。
根据冻干保护剂正交试验结果可知,优化后的最佳保护剂组合是A2B2C3D2,即质量浓度为100 g/L的脱脂乳、80 g/L的麦芽糊精、30 g/L的谷氨酸钠和100 g/L的海藻糖。
2.3.3验证试验
优化后的最佳保护剂组合是A2B2C3D2没有出现在正交试验表中,为了验证该组合是否是最优的冻干保护剂组合,将组合A2B2C3D2和正交试验表中存活率最高的组合A2B3C1D2在相同条件下再次同时进行冷冻干燥试验,结果为优化组合A2B2C3D2所测得的冻干存活率为75.9%,高于A2B3C1D2的冻干存活率73.1%,因此,最佳复合保护剂是A2B2C3D2组合,即质量浓度为100 g/L的脱脂乳、80 g/L的麦芽糊精、30 g/L的谷氨酸钠和100 g/L的海藻糖。
3 结论
本实验以植物乳杆菌B002为出发菌株,研究了该菌株在冻干过程中菌泥和保护剂平衡时间、预冷冻时间和冻干保护剂对菌粉存活率的影响,结果表明,在以10%脱脂乳为基础保护剂的条件下,4 ℃,6 000 r/min离心15 min,菌泥和保护剂在室温下平衡40 min,厚度5 mm,-45 ℃预冷冻2 h后,-65 ℃真空冷冻干燥24 h,菌粉存活率相对较高。本实验通过单因素和正交试验优化了保护剂配方,即质量浓度为100 g/L的脱脂乳、80 g/L的麦芽糊精、30 g/L的谷氨酸钠和100 g/L的海藻糖,在上述条件下真空冷冻干燥,菌粉存活率达到75.9%。
[1]HONGPATTARAKERE T, RATTANAUBON P, BUNTIN N.Improvement of freeze-driedLactobacillusplantarumsurvival using water extracts and crude fibers from food[J]. Food and Bioprocess Technology, 2013,6(8):1 885-1 896.
[2]王韵.蔬菜发酵专用乳酸菌选育及其菌剂制备核心技术[D].南昌:南昌大学,2010:5-7.
[3]刘彩虹,邵玉宇,任艳,等.高密度发酵和真空冷冻干燥工艺对乳酸菌抗冷冻性的影响[J].微生物学通报,2013,40(3):492-499.
[4]COULIBALY I, AMENAN A Y,LOGNAY G,et al.Survival of freeze-driedLeuconostocmesenteroidesandLactobacillusplantarumrelated to their cellular fatty acids composition during Storage[J].Applied Biochemistry and Biotechnology,2009,157(1):70-84.
[5]宋金慧.高活力益生菌发酵剂的制备及产品开发[D].北京:中国农业科学院,2009:12-13.
[6]陈涛.真空冷冻干燥制备高效浓缩型两歧双歧杆菌酸奶发酵剂[D].呼和浩特:内蒙古农业大学,2011:5-7.
[7]王磊.嗜酸乳杆菌高密度培养及冻干保护剂的研究[D].西安:陕西科技大学,2011:6-8.
[8]许女,习傲登,张玢.真空冷冻干燥工艺参数对植物乳杆菌MA2活性的影响[J].中国酿造,2011(11):34-38.
[9]苏萍,董英,程新,等.植物乳杆菌冻干保护剂的优化及其保护机制[J].中国食品学报,2014,15(1):56-63.
[10]吴满刚,庄涛,王小兰,等.植物乳杆菌增殖培养及其浓缩型冻干发酵剂的制备[J].食品与发酵工业,2014,40(1):72-79.
[11]古元懿.乳酸菌高密度培养及冻干工艺的研究[D].哈尔滨:东北林业大学,2008.
[12]HAN B, BIOCHOF J C.Direct cell injury associated with eutectic crystallization during freeing[J].Cryobilogy,2004,48(1):8-21.
[13]徐丽萍.嗜酸乳杆菌冻干菌粉保护剂选择的研究[J].食品工业科技,2007,28(5):119-122.
[14]雷欣宇.乳酸菌活性干燥菌剂制备工艺的研究[D].重庆:西南大学,2013:11-12.
[15]韩德全,杨丽娟,孙庆申.响应面法优化植物乳杆菌冻干保护剂[J].食品科学,2010,31(5):219-224.
[16]李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学.2011:5.
[17]郭峰.植物乳杆菌制粉及其软胶囊产品的开发[D].大庆:黑龙江八一农垦大学,2014:16-17.
Optimization for freeze-drying technology ofLactobacillusplantarumB002
CAO Ke-ke, ZHANG Li-feng,LI Yan
(Department of Biology and Food Engineering,Bengbu University, Bengbu 233030,China)
UsingLactobacillusplantarumB002 as a target strain, the influences of protective agent balance time, pre-freezing time and preservative formula on the survival rate during process of freeze-drying bacteria were studied. The results showed that the survival rate ofL.plantarumB002 reached 75.9% after treatments as follows: it was centrifuged with 6 000 r/min at 4 ℃ for 15 min using 100 g/L skim milk as basic protectant, , then the centrifugal mud and protective agent were balanced at room temperature for 40 min to reach material thickness of 5 mm, then it was pre-freezed at -45 ℃ for 2 h using the optimal preservative containing skim milk powder 100 g/L, maltodextrin 80 g/L, monosodium glutamate 30 g/L and trehalose 100 g/L, finally it was vacuum freeze-dried for 24 h.
Lactobacillusplantarum;vacuum freeze-drying;protective agent
10.13995/j.cnki.11-1802/ts.201609020
硕士,讲师。
安徽省高校自然科学研究一般项目(KJ2013Z194);蚌埠学院“优秀中青年骨干教师”支持计划
2016-01-13,改回日期:2016-05-09
