羊乳表皮生长因子(EGF)在人工模拟胃肠液中的稳定性
2016-10-13云丹张富新侯院林于玲玲雷飞艳高佳媛王银徐连应
云丹,张富新,侯院林,于玲玲,雷飞艳,高佳媛,王银,徐连应
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
羊乳表皮生长因子(EGF)在人工模拟胃肠液中的稳定性
云丹,张富新*,侯院林,于玲玲,雷飞艳,高佳媛,王银,徐连应
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
文中在研究羊乳EGF和EGF标品在人工胃液、人工肠液和人工胃肠液中消化稳定性的基础上,研究添加乳成分和食源性蛋白酶抑制剂的EGF标品在人工胃液和人工肠液中的稳定性。结果表明:羊乳中EGF浓度在人工胃液、人工肠液或人工胃肠液中消化1 h内迅速下降,消化1 h后基本稳定,但与纯EGF消化程度相比,羊乳中EGF消化速度明显降低;通过研究添加乳成分的EGF样品在人工胃肠液中的消化稳定性,发现在人工胃液中,乳清和乳清液对EGF的消化有保护作用,而酪蛋白和乳清蛋白对EGF的消化无保护作用,在人工肠液中,乳清、乳清液、酪蛋白和乳清蛋白均能对EGF的消化产生保护作用;通过研究添加食源性蛋白酶抑制剂和乳清液的EGF样品在人工胃肠液中的消化稳定性,发现在人工胃液中,乳清液(GMSF)对EGF的消化有保护作用,而大豆蛋白酶抑制剂(SBTI)、青豆蛋白酶抑制剂(LBTI)、蛋清蛋白酶抑制剂(EWPI)对EGF的消化无保护作用;在人工肠液中,大豆蛋白酶抑制剂(SBTI)、青豆蛋白酶抑制剂(LBTI)、蛋清蛋白酶抑制剂(EWPI)和乳清液(GMSF)对EGF的消化均产生保护作用。
羊乳;表皮生长因子;人工胃肠液;稳定性
羊乳营养价值丰富,组分与人奶接近,易于被人体消化吸收、不含过敏原。羊乳可增强人体免疫力、促进婴幼儿生长发育,对胃肠炎、肺病、肾病、肝病等有治疗和促进康复作用等医疗保健功能,因而成为母乳的最佳替代品[1-2]。羊乳中含有与母乳相同的活性因子——表皮生长因子(epidermal growth factor,EGF),EGF通过与EGF受体结合,相邻受体相互靠近形成二聚体,启动一系列的级联反应催化、维持与细胞增长、增殖有关的一系列生化过程[3-4]。“常饮羊乳,色如处子”,原因就是羊乳中具有抗氧化和美容养颜功效的EGF。此外,EGF可以帮助呼吸道和消化道的上皮黏膜细胞修复,提高人体对感染性疾病的抵抗力[5]。大量研究表明,作为羊乳中主要的活性因子之一,EGF在胃肠道疾病的预防和治疗中发挥着重要的作用[6],然而EGF在人体内生理功能的表达与其在胃肠液中的稳定性密切相关,虽然国内外对EGF在人工胃肠液中的稳定性研究较多,但对羊乳中的EGF在人工胃液和肠液中的稳定性却未见报道。因此,本试验通过模拟人工胃液和肠液,研究其对羊乳EGF浓度的影响,以探明羊乳EGF在不同消化条件下的稳定性。
1 材料与方法
1.1材料
1.1.1羊乳
选择西北农林科技大学羊场健康奶山羊的乳样。采取人工挤奶方式取样,采样时弃去前3把奶,取挤奶中段的乳样。采样后立即将乳样在-40 ℃下冷冻储存。
1.1.2试剂盒
山羊表皮生长因子酶联免疫试剂盒,购于美国R&D公司,最低检测浓度为1.0 pg/mL。EGF标准品由美国R&D公司提供。
1.1.3人工胃液的制备[7-8]
人工胃液:NaCl 2 g/L、胃蛋白酶(pepsin)3.5 g/L,用浓度为1 mol/L的HCl调整pH值为2.0、3.0、4.0、5.0后备用。
1.1.4人工肠液的制备[9-10]
人工肠液:将下述a液和b液以体积比2∶1混合即为人工肠液。
a.胰腺液:重碳酸钠NaH(O3)质量浓度为11 g/L,NaCl为2 g/mL,胰蛋白酶为1 g/L,用浓度为1 mol/L的NaOH调节pH值至8.0。
b.胆汁液:Bile Salts(Difco)1.8 g/L,用浓度为1 mol/L的NaOH调节pH值至8.0。
1.1.5EGF标品的制备
将1 mg/mL的EGF标准品用无菌的18 mΩ-cm水稀释至32 ng/mL,使得其浓度与羊乳中EGF浓度相近,在4 ℃冷藏备用。
1.2仪器与设备
MDF-U5411型低温冰箱,日本三洋电机有限公司;JND-50型培养箱,宁波江南仪器有限公司;TGL-16gR型高速冷冻离心机,上海安亭科学仪器厂;Multiskan Go型全波长酶标仪,美国热电公司;KQ3200B型超声波清洗器,昆山市超声仪器有限公司;移液枪(100~1 000 μL,10~100 μL,0.5~10 μL),德国eppendorf 公司;隔水式恒温培养箱:上海博讯实业有限公司医疗设备厂;ML104型电子天平,梅特勒-托利多仪器(上海)有限公司;GZX-9146 MBE型数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;LS-B型立式压力蒸汽灭菌器,上海申安医疗器械厂;pHS-3C型雷磁精密pH酸度计,上海精密科学仪器有限公司;XMTD型数显恒温水浴锅,上海福玛实验设备有限公司。
1.3EGF的人工胃液稳定性
分别取1 mL乳样和稀释至相同浓度的EGF标品,于37℃水浴中预热10 min,添加9 mL模拟的人工胃液,分别在恒温摇床上消化水解0.5、1、2、3、4 h后取样,然后用质量分数为10%的Na2CO3调节乳液pH值至7灭酶,测定EGF的浓度。计算EGF标品和羊乳中EGF在人工胃液中消化后的浓度及活性保留率。

(1)
1.4EGF的人工肠液稳定性
分别取1 mL乳样和稀释至相同浓度的EGF标品,于37℃水浴中预热10 min,添加9 mL模拟的人工肠液,分别在恒温摇床上消化水解0.5、1、2、3、4 h后取样,取样后立即加入1滴胰蛋白酶抑制剂(PMSF,1 g/L,无水乙醇溶解)抑制胰蛋白酶活性,测定EGF的浓度。计算EGF的保留率。
1.5EGF体外模拟胃肠道消化
取1 mL乳样和稀释至相同浓度的EGF标品,于37℃水浴中预热10 min,添加9 mL模拟的人工胃液,在37 ℃恒温摇床上消化水解1.5 h,然后用l mol/L的NaOH调节乳液pH值至7灭酶。取1mL经胃液消化后的样品,添加9 mL模拟的人工肠液,在37 ℃恒温摇床上消化水解2 h取样,立即加入1滴胰蛋白酶抑制剂(PMSF,1 g/L,无水乙醇溶解)抑制胰蛋白酶活性,测定EGF浓度。计算EGF在胃肠道中的保留率。
1.6乳成分对EGF在人工胃肠液中消化稳定性的影响
取1 mL乳样在5 000 g下低温(4 ℃)离心10 min,去除上层脂肪,得乳清和酪蛋白。再将1 mL乳样分离得到的乳清在80 ℃下加热1 h,离心后得到乳清蛋白和去除乳清蛋白的乳清液。然后分别将1 mL乳样获得的乳清、酪蛋白、乳清液、乳清蛋白加入到浓度为32 ng/mL的EGF标品中,制成EGF样品液(EGF浓度与羊乳样品相同)。取1 mL样品液加入到9 mL人工胃液或人工肠液中,于37 ℃下消化1 h,测定EGF浓度。研究乳成分对EGF在人工胃肠液中消化稳定性的影响。
1.7食源性蛋白酶抑制剂对EGF在人工胃肠液中消化稳定性的影响
在1 mL浓度为32 ng/mL 的EGF标品中添加1.8 mg大豆蛋白酶抑制剂(soya bean trypsin inhibitor,SBTI)、青豆蛋白酶抑制剂(lima bean trypsin inhibitor,LBTI)、蛋清蛋白酶抑制剂(egg white trypsin inhibitor,EWPI)后,分别在9 mL人工胃液或9 mL人工肠液中消化1 h,测定EGF浓度,计算保留率,并与未添加抑制剂、添加乳清液(goat milk-soluble fraction,GMSF)的EGF标品进行对比。
1.8EGF浓度测定
1.8.1样品处理
按照OSLISLO[11]的方法并加以改进。将冷冻的乳样在4 ℃解冻后,用移液枪吸取一定量的乳样加入配制的人工胃液和肠液中消化一定的时间后,吸取1 mL在5 000 g下低温(4 ℃)离心10 min,去除上层乳脂,取上清液,用ELISA试剂盒测定EGF浓度。
1.8.2EGF浓度的检测
将EGF试剂盒从4 ℃的冰箱取出后室温(20 ℃)平衡20 min,取出试剂盒中的板条。用移液枪取10 μL处理后的乳样加入板条反应孔中,再加样本稀释液40 μL,随后加入辣根过氧化物酶(HRP)标记的检测抗体50 μL,用封板膜封住反应孔后,在37 ℃保温60 min。然后弃去反应孔中液体,并在吸水纸上拍干,加入预先稀释好的洗涤液(用蒸馏水按体积比=1∶20稀释)350 mL,静置1 min,弃去洗涤液,在吸水纸上拍干,如此重复洗板5次。在洗涤后的反应孔中加入底物A、B各50 μL,37℃保温15 min后加入终止液50 μL,15 min内在450 nm波长处测定各孔的吸光度值。每个样品重复3次。
1.8.3标准曲线绘制
将山羊表皮生长因子(EGF)酶联免疫试剂盒中浓度为1 000 pg/mL的EGF标准品用试剂盒中的标品稀释液依次稀释成浓度为1 000、500、250、125、62.5、0 pg/mL的溶液。各取50 μL加入标准孔,按照1.8.2的方法检测标品在450 nm处的吸光度值,然后以标准品的浓度作为横坐标(x),对应吸光度值作为纵坐标(y),绘制EGF标准曲线,计算线性回归方程,按照线性回归方程计算不同样品中的EGF浓度。
1.9数据的处理
所有数据均采用DPS软件进行处理,并采用Duncan新复极差法进行显著性检验分析。
2 结果与分析
2.1EGF的人工胃液稳定性
将EGF标品和羊乳在人工胃液中分别消化0.5、1、2、3、4 h后,测定EGF浓度及保留率,结果见表1。

图1 人工胃液(不同pH值)消化后EGF浓度的变化Fig.1 Changes of EGF concentration after digestion with artificial gastric juice

样品消化时间/hpH值2345保留率/%0.564.8770.1380.2786.41146.0256.6064.4673.66EGF标品233.2944.8954.7564.45320.7334.0145.2354.22421.2427.9639.7846.490.586.1482.9893.8198.67165.7875.2282.6184.07羊乳262.1574.9876.7373.65366.9670.1578.8574.79465.0371.5176.5177.88
由图1可知,在人工胃液中,随着消化时间的延长,EGF标品的浓度一直降低(P<0.05),而在羊乳中先降低后基本保持不变,当消化液pH为2~4时,消化前1 h内,羊乳中EGF浓度下降显著(P<0.05),消化时间超过1 h后,羊乳中EGF趋于稳定(P>0.05),同时当消化液pH为5时,羊乳中EGF浓度在消化0.5 h内无显著性变化(P>0.05),消化0.5~2 h时,羊乳中EGF浓度有所降低(P<0.05),但当消化2 h后,羊乳中EGF浓度趋于稳定(P>0.05)。在整个消化期间,羊乳中的EGF浓度始终高于EGF样品中的浓度,表明羊乳中的EGF比EGF标品在胃液中更稳定。
由表1可以看出,在pH值为2的人工胃液中,1 h后EGF标品和羊乳中的EGF活性保留率分别为46.02%、65.78%,到4 h时EGF标品保留率为21.24%,但羊乳中依然有高达65.03%的活性。在pH值为3的人工胃液中,1 h后EGF标品和羊乳中的EGF活性保留率分别为56.60%、75.22%,到4 h时羊乳中的EGF活性显著高于EGF溶液(P<0.01)。但是当pH值达到4和5时,在EGF标品和羊乳中,在人工胃液中消化4 h后,EGF的保留率分别为39.78%、76.51%和46.49%、77.88%,这种现象表明人工胃液的酸度越高,则EGF越容易被降解,稳定性越差,同时可以看出,EGF标品比羊乳中的EGF更易被胃液消化,由此可以推测,羊乳中的某些成分可能会增强EGF对胃液消化的耐受性。
生理pH条件下EGF在胃液中可被酸和胃蛋白酶作用降解。PLAYFORD[12]在研究胃液对EGF降解时发现完整的EGF1-53在胃液中可被降解为EGF1-49和EGF1-46片段,胃蛋白酶有特定的断裂位点,可作用于那些含有芳香族氨基酸的多肽,使得EGF结构上的Tryp49-Tryp50键快速断裂,使完整的EGF1-53分子生物活性减少。成年人在未进食时胃液pH值为2.0左右,但在进食后pH值可升至4.5~5.0[13],然而人胃液中胃蛋白酶活性在pH为2.5~3时最大,pH>4时快速下降,说明胃液的pH值对EGF的降解也有一定的影响,在进食后EGF对胃液消化的耐受性更好,这也可以用来解释EGF为何在胃液pH值为2时消化率达到最高。
2.2EGF的人工肠液稳定性
将EGF标品和羊乳分别在人工肠液中消化0.5、1、2、3、4 h后,测定EGF的浓度及活性保留率,结果见图2及表2。

图2 人工肠液中EGF浓度的变化Fig.2 Changes of EGF concentration after digestion with artificial intestinal juice
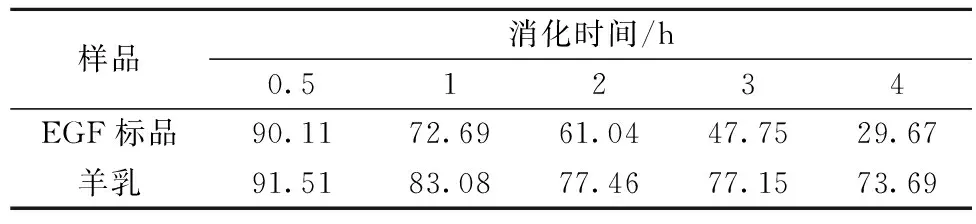
表2 EGF标品和羊乳EGF在人工肠液中的保留率 单位:%
随着消化时间的延长,EGF标品的浓度一直降低(P<0.05),而在羊乳中下降幅度较小,羊乳在肠液中消化1 h时EGF浓度迅速下降(P<0.05),而在消化1 h后羊乳中的EGF浓度变化不大(P>0.05),当消化4 h时,EGF标品中EGF活性仅剩初始浓度的29.67%,而羊乳中EGF的活性保留率高达73.69%,说明羊乳中可能含有某些物质能增强EGF的肠液耐受性。SHEN等[14]研究了EGF在断乳猪和吮乳猪胃肠道的稳定性,表明EGF在吮乳猪的肠液中的降解率显著减少,说明乳成分能够减少EGF的降解。
2.3EGF体外模拟胃肠道消化
将EGF标品和羊乳分别在人工胃液中消化1.5 h后,再在人工肠液中消化2 h,测定EGF在人工胃肠液中的浓度变化及活性保留率,结果见表3。

表3 EGF在人工胃肠液中的浓度变化
由表3可以看出,EGF标品和羊乳中的EGF对人工胃肠液的耐受性有所不同。经胃肠液消化后羊乳中的EGF浓度显著高于EGF标品(P<0.01),从保留率来看,经胃肠液消化后,羊乳中EGF保留率为58.82%,而EGF标品保留率仅为26.17%。由此可见,羊乳中可能含有某些成分可以增强EGF对胃肠液的耐受性。EGF在胃肠液中的稳定性与蛋白水解作用有关。胃蛋白酶参与胃液中EGF的降解,胰蛋白酶和糜蛋白酶参与肠液中EGF的降解,胃肠液中的多肽酶和蛋白酶可将EGF降解成为氨基酸和小分子肽,失去它本身的活性[15]。
2.4乳成分对EGF在人工胃肠液中消化稳定性的影响
将从1 mL乳样中分离得到的乳清、酪蛋白、乳清液、乳清蛋白分别加入到浓度为32 ng/mL的EGF标品液中(与羊乳中浓度一致)。取1 mL加入乳成分的EGF标品液,加入到9 mL人工胃液或9 mL人工肠液,在37℃下消化1 h,分别测定其在人工胃液和人工肠液中的EGF浓度,结果见图3和图4。
由图3可知,在人工胃液中,EGF标品经1 h消化后浓度从起初的32 ng/mL降低至(14.73±0.78) ng/mL,活性保留率仅为46.02%。而添加酪蛋白、乳清蛋白、乳清、乳清液的EGF标品经人工胃液消化1 h后浓度分别为(14.69±0.81)、(14.51±0.83)、(18.89±0.49)、(18.32±1.28) ng/mL,活性保留率分别达到45.90%、45.34%、59.04%、57.25%。虽然添加乳成分的EGF样品在人工胃液中均可明显消化,但与未添加乳成分的EGF标品相比,添加酪蛋白和乳清蛋白的样品在人工胃液中消化1 h后,其浓度无明显差别(P>0.05),而添加乳清和乳清液的样品经胃液消化1 h后,其EGF浓度显著高于未加入乳成分的EGF标品(P<0.05)。说明乳清、乳清液可对EGF在胃液中的消化起保护作用,酪蛋白和乳清蛋白均无保护作用,由此推测乳清或乳清液中可能含有抑制EGF降解的成分[14]。
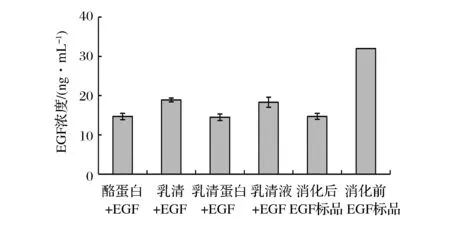
图3 乳成分对EGF在人工胃液中消化(0 h)稳定性的影响Fig.3 Effects of milk composition on the stability of EGF in artificial gastric juice
由图4可知,在人工肠液中,EGF标品经1 h消化后浓度从起初的32 ng/mL降低至(21.81±1.63) ng/mL,活性保留率仅为68.15%,而添加酪蛋白、乳清蛋白、乳清和乳清液的EGF标品经人工肠液消化1 h后浓度分别为(24.92±0.30)、(24.71±0.67)、(27.35±1.06)、(26.28±0.91) ng/mL,活性保留率分别为77.86%、77.21%、85.47%、82.12%。虽然添加乳成分的EGF样品在人工肠液中均可明显消化,但与未添加乳成分的EGF标品相比,在人工肠液中消化1 h后EGF浓度明显较高,说明乳成分可对EGF在肠液中起保护作用。SHEN[14]等研究表明,乳的酸溶性部分和酪蛋白可显著减少EGF的降解,摄入其他食源性蛋白质,也可能会因为竞争性抑制消化酶活性,减少EGF的分解。
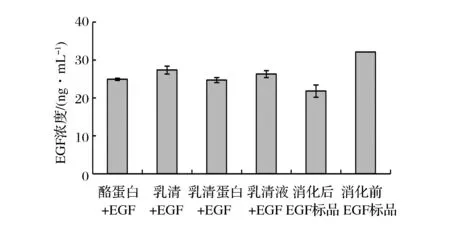
图4 乳成分对EGF在人工肠液中消化(1 h)稳定性的影响Fig.4 Effects of milk composition on the stability of EGF in artificial intestinal juice
2.5食源性蛋白酶抑制剂对EGF在人工胃肠液中消化稳定性的影响
分别在1 mL EGF标品(32ng/mL)中添加1.8 mg大豆蛋白酶抑制剂(soya bean trypsin inhibitor,SBTI)、青豆蛋白酶抑制剂(lima bean trypsin inhibitor,LBTI)、蛋清蛋白酶抑制剂(egg white trypsin inhibitor,EWPI)后,分别在9 mL人工胃液或9 mL人工肠液中消化1 h,测定EGF的浓度,并与未添加抑制剂的EGF标品、添加乳清液(goat milk-soluble fraction,GMSF)的EGF标品进行对比。结果见图5和图6。

图5 食源性蛋白酶抑制剂对EGF在人工胃液中消化(0 h)稳定性的影响Fig.5 Effects of food-borne protease inhibitors on the stability of EGF in artificial gastric juice
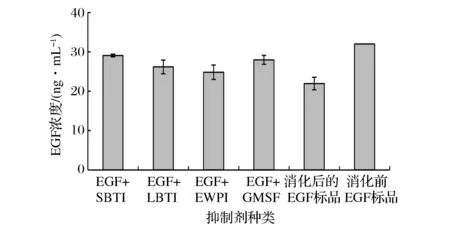
图6 食源性蛋白酶抑制剂对EGF在人工肠液中消化(1 h)稳定性的影响Fig.6 Effects of food-borne protease inhibitors on the stability of EGF in artificial intestinal juice
由图5可知,在人工胃液中,EGF标品浓度由消化前的32 ng/mL降低至(15.95±1.08) ng/mL,添加大豆蛋白酶抑制剂(soya bean trypsin inhibitor,SBTI)、青豆蛋白酶抑制剂(lima bean trypsin inhibitor,LBTI)、蛋清蛋白酶抑制剂(egg white trypsin inhibitor,EWPI)、乳清液(goat milk-soluble fraction,GMSF)的EGF标品经人工胃液消化1 h后,浓度分别为(15.34±0.73)、(15.75±1.02)、(16.06±1.13)、(20.58±0.18) ng/mL。添加GMSF的EGF样品在胃液中消化后,其EGF浓度明显高于未添加抑制剂的EGF标品(P<0.05),而添加SBTI、LBTI、EWPI的EGF样品与未添加抑制剂的EGF样品在人工胃液中消化1 h后,其EGF浓度无显著性差异(P>0.05),表明乳清液可减少EGF在胃液中的消化,食源性抑制剂对EGF在胃液中的消化无明显保护作用,猜测乳清液中可能含有其他成分可以抑制EGF在胃液中的降解。
由图6可知,在人工肠液中,EGF标品浓度由消化前的32 ng/mL降低至(21.94±1.60) ng/mL,活性保留率达到68.55%,而在添加大豆蛋白酶抑制剂(soya bean trypsin inhibitor,SBTI)、青豆蛋白酶抑制剂(lima bean trypsin inhibitor,LBTI)、蛋清蛋白酶抑制剂(egg white trypsin inhibitor,EWPI)、乳清液(goat milk-soluble fraction,GMSF)的EGF样品中,经人工肠液消化1 h后浓度分别为(29.07±0.35)、(26.19±1.74)、(24.82±1.82)、(27.96±1.12) ng/mL,活性保留率分别达到90.83%、81.83%、77.57%、87.39%。添加SBTI、LBTI、EWPI和乳清液的EGF样品经肠液消化1 h后其EGF浓度显著高于未添加任何成分的EGF标品中的浓度(P>0.05),说明食源性蛋白酶抑制剂和乳清液均能抑制EGF在肠液消化过程中的降解。
EGF在胃肠道中能够被降解成小分子的肽段[12]。在胃液中,抑制剂对EGF的降解无保护作用,而在肠液中抑制剂对EGF有保护作用,其原因可能是抑制剂抑制了肠液中的胰蛋白酶、糜蛋白酶等蛋白消化酶的活性,从而降低了肠道中蛋白消化酶对EGF的降解。而乳清液中的活性成分不但对胃液中胃蛋白酶具有抑制作用,而且对肠液中的蛋白消化酶也具有抑制作用。
3 讨论
EGF是生物体中一种重要的生物活性物质,具有促进胃肠道生长,改善胃酸分泌及肠道酶活性水平,催化肠上皮细胞对金属离子的转运和糖代谢,保护胃肠道黏膜等作用,这些作用只有EGF进入体内才能发挥,因此,通过口服作用进入人体在消化过程中保持生物活性是发挥EGF生理作用的关键。通常EGF在幼畜的胃肠道中经过胞饮作用被完整吸收利用。对于成人来说,EGF要经过胃肠液的消化作用而被吸收。目前有研究报道,乳源性EGF在酸和胃蛋白酶、肠道消化酶存在时可发生降解。KLAGSBRUN[16]指出,母乳在混合的胰蛋白酶和糜蛋白酶环境下培养的Balb/c3T3细胞中EGF刺激生长作用减少到15%以下。一些研究表明EGF在鼠和人的胃液中稳定存在,在肠液中会降解至一个变量范围[17]。另外,其他的研究表明EGF在胃液中可以降解,尽管将胃液调节至更高的pH保护作用也比较微弱[13]。还有一些研究表明这种肽可在胃肠道内稳定存在,初生动物能完整吸收。EGF主要是在肠关闭后通过结合胃肠道细胞表面的受体被吸收,当到达其他组织时这种结合能力便会消失。服用125I-EGF后在脑、胃肠壁、皮肤等多个组织中均能检测出放射性EGF,说明口服EGF可通过血液循环作用于胃肠外的组织。此外,若摄入膳食蛋白可减少EGF的分解,因为它们可能对消化酶的分解有竞争性抑制作用。
4 结论
在人工胃液、人工肠液或人工胃肠液中,羊乳中EGF浓度在消化1 h内迅速下降,消化1 h后基本稳定,但与纯EGF消化程度相比,羊乳中EGF消化速度明显缓慢,表明羊乳中有保护EGF降解的物质存在。通过研究添加乳成分的EGF样品在人工胃肠液中的消化稳定性,发现在人工胃液中,乳清和乳清液对EGF的消化有保护作用,而酪蛋白和乳清蛋白对EGF的消化无保护作用;在人工肠液中,乳清、乳清液、酪蛋白和乳清蛋白均能对EGF的消化产生保护作用。通过研究添加食源性蛋白酶抑制剂和乳清液的EGF样品在人工胃肠液中的消化稳定性,发现在人工胃液中,乳清液(GMSF)对EGF的消化有保护作用,而大豆蛋白酶抑制剂(SBTI)、青豆蛋白酶抑制剂(LBTI)、蛋清蛋白酶抑制剂(EWPI)对EGF的消化无保护作用;在人工肠液中,大豆蛋白酶抑制剂(SBTI)、青豆蛋白酶抑制剂(LBTI)、蛋清蛋白酶抑制剂(EWPI)和乳清液(GMSF)对EGF的消化均产生保护作用。
[1]HAENLEIN G F W. Goat milk in human nutrition[J]. Small Ruminant Research, 2004, 51(2): 155-163.
[2]AHMED A S, EL-BASSIONY T, ELMALT L M, et al. Identification of potent antioxidant bioactive peptides from goat milk proteins[J]. Food Research International, 2015, 74: 80-88.
[3]SIXTINA G S,HIJAZI A,COLOMBEL M. Increased basal cell proliferation and EGF receptor expression in benign hypertrophy compared to normal prostate[J]. J Urol,1993,149: 243.
[4]HOLT S J, ALEXANDER P, INMAN C B, et al. Epidermal growth factor induced tyrosinephosphorylation of nuclear proteins associated with translocation of epidermal growth factor receptor into the nucleus[J]. Biochemical Pharmacology, 1994, 47(1): 117-126.
[5]廖小金. 表皮生长因子结构和生物学效应[J]. 海峡药学, 2006, 18(5): 14-17.
[6]MURPHY M S. Growth factors and the gastrointestinal tract[J]. Nutrition, 1998, 14(10): 771-774.
[7]RUI-GUO W, XIAO-OU S U, XIA F A N, et al. Liquid chromatography-tandem mass spectrometry for determination of aflatoxin B 1, deoxynivalenol and zearalenone in artificial porcine gastrointestinal digestive Juice[J]. Chinese Journal of Analytical Chemistry, 2015, 43(1): 1-6.
[8]张和平, 孟和, 毕力格, 等. 分离自内蒙古传统发酵酸马奶中L.caseiZhang 潜在益生特性的研究[J]. 中国乳品工业, 2006, 34(4): 4-10.
[9]CHARTERIS W P, KELLY P M, MORELLI L, et al. Development and application of an in vitro methodology to determine the transit tolerance of potentially probiotic Lactobacillus and Bifidobacterium species in the upper human gastrointestinal tract[J]. Journal of Applied Microbiology, 1998, 84(5): 759-768.
[10]KOS B,GORETA J. Effect of protectors on the viability ofLactobacillusacidophilusM92 in simulated gastrointestinal conditions[J]. Food Technology and Biotechnology, 2000, 38(2): 121-127.
[11]OSLISLO A, CZUBA Z, SLAWSKA H, et al. Decreased human milk concentration of epidermal growth factor after preterm delivery of intrauterine growth-restricted newborns[J]. Journal of Pediatric Gastroenterology and Nutrition, 2007, 44(4): 464-467.
[12]PLAYFORD R J, MARCHBANK T, CALNAN D P,et al. Epidermal growth factor is digested to smaller, less active forms in acidic gastric juice[J].Gastroenterology,1995,108:92-101.
[13]DRESSMAN J B, BERARDI R R, DERMENTZOGLOU L C, et al. Upper gastrointestinal (GI) pH in young, healthy men and women[J]. Pharmaceutical Research, 1990, 7(7): 756-761.
[14]SHEN W H, XU R J. Stability of epidermal growth factor in the gastrointestinal lumen of suckling and weaned pigs[J]. Life Sciences, 1996, 59(3): 197-208.
[15]RAO R K, BAKER R D, BAKER S S. Bovine milk inhibits proteolytic degradation of epidermal growth factor in human gastric and duodenal lumen[J]. Peptides, 1998, 19(3): 495-504.
[16]KLAGSBRUN M. Human milk stimulates DNA synthesis and cellular proliferation in cultured fibroblasts[J]. Proceedings of the National Academy of Sciences, 1978, 75(10): 5 057-5 061.
[17]BRITTON J R, GEORGE-NASCIMENTO C, KOLDOVSKY O. Luminal hydrolysis of recombinant human epidermal growth factor in the rat gastrointestinal tract: segmental and developmental differences[J]. Life Sci,1988, 43:1 339-1 347.
Study on the stability of goat milk EGF in simulated gastrointestinal fluid
YUN Dan,ZHANG Fu-xin*,HOU Yuan-lin,YU Ling-ling,LEI Fei-yan,GAO Jia-yuan,WANG Yin,XU Lian-ying
(College of Food Engineering and Nutritional Science, Shanxi Normal University, Xi'an 710119,China)
The digestion stability of goat milk EGF and EGF standard in artificial gastric, intestinal juice and artificial gastrointestinal juice were studied and based on its result, the stability of EGF standard which has goat milk composition and food protease in artificial gastrointestinal fluid was investigated. The results showed that EGF concentration in goat milk digested rapidly in artificial gastric, intestinal juice and artificial gastrointestinal within 1 hour. It became stable after 1 h, but compared with the pure EGF, EGF digestion rate was significantly lower in goat milk. the digestive stability of EGF with milk composition in artificial gastrointestinal fluid showed that whey and whey liquid protected the digestion of EGF in the artificial gastric juice, while casein and whey protein did not have the protective effect. Whey, whey liquid, casein and whey protein all had protective effect on the digestion of EGF in artificial intestinal juice. The digestive stability of EGF with food protease inhibitor and goat milk-soluble fraction in artificial gastrointestinal fluid showed that goat milk-soluble fraction had protective effect on the digestion of EGF in artificial gastric juice while soya bean trypsin inhibitor, lima bean trypsin inhibitor and egg white trypsin inhibitor had no protective effect. Meanwhile, soya bean trypsin inhibitor, lima bean trypsin inhibitor, egg white trypsin inhibitor and goat milk-soluble fraction all had protective effect on EGF in artificial intestinal juice.
goat milk; epidermal growth factor; artificial gastrointestinal fluid; stability
10.13995/j.cnki.11-1802/ts.201609012
硕士研究生(张富新教授为通讯作者,E-mail:fuxinzh@snnu.edu.cn)。
“十二五”农村领域国家科技计划项目(2013BAD18B04);陕西省农业攻关项目(2014K01-17-05);农业部公益性行业(农业)科研专项(201103038);重大科技成果转化引导专项(2016KTCG01-12)
2015-11-30,改回日期:2016-04-08
