浓缩乳蛋白的离子交换脱钙及其对酪蛋白胶束的影响
2016-10-13胡锦华徐雨婷刘大松李珺珂张捷周鹏
胡锦华,徐雨婷,刘大松,李珺珂,张捷,周鹏
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡, 214122)
浓缩乳蛋白的离子交换脱钙及其对酪蛋白胶束的影响
胡锦华,徐雨婷,刘大松,李珺珂,张捷,周鹏*
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡, 214122)
研究了浓缩乳蛋白的离子脱钙技术,以及部分脱钙对截留液中酪蛋白存在形式及酪蛋白胶束水合率的影响。研究确定了离子交换树脂的平衡脱钙时间为2 h,并通过改变树脂添加量得到了0、5%.5%、10.5%、19.6%、29.6%、38.7%、49.9%、63.8%和83.6%系列脱钙程度的截留液。随着脱钙程度的增加,截留液超离心上清中游离酪蛋白的含量逐渐增加,而超离心沉淀的胶束酪蛋白减少,说明酪蛋白逐渐从酪蛋白胶束中游离出来。当脱钙程度为0~29.6%时,酪蛋白胶束的水合率从2.6 g/g(干基)增加到4.1 g/g(干基),而脱钙程度从29.6%进一步增加到83.6%时,酪蛋白胶束水合率则变小至3.3 g/g(干基)。浓缩乳蛋白的钙离子含量以及酪蛋白的存在状态决定了其在应用时的功能特性,研究对开发新型的浓缩乳蛋白配料具有重要的指导意义。
浓缩乳蛋白;离子交换;脱钙;胶束态酪蛋白;游离酪蛋白;水合率
浓缩乳蛋白(milk protein concentrate,MPC),是脱脂牛乳经超滤和洗滤后,再通过蒸发浓缩和喷雾干燥所得到的一类高蛋白粉,其蛋白质干基含量介于50%~85%。MPC蛋白组成与牛乳几乎完全相同,其中酪蛋白与乳清蛋白的比例约为8∶2[1]。MPC具有良好的风味、口感和功能特性,因而作为一种重要的蛋白配料被广泛的用于功能性乳制品、婴儿食品、焙烤食品以及运动营养食品中[2-4]。
MPC的蛋白含量较高,导致其储藏稳定性较差,主要表现为,新生产的MPC在室温条件下溶解性较低,且在贮藏过程中溶解性会进一步的降低[5-6]。较低的溶解性会影响MPC在应用时的功能性质,包括凝胶性、起泡性以及乳化性等。比如,MPC作为蛋白强化剂应用到高蛋白乳制品(酸奶和乳酪等)的生产中时,较低的复溶程度会导致最终的产品中形成结块,影响产品的品质,进而阻碍了其在食品工业中的应用。
研究发现,导致MPC储藏稳定性变差的主要原因是蛋白质在储藏过程中形成交联物,而这种蛋白质交联现象通常是由体系中钙离子介导的离子键引起的[7-8]。因此,通过部分脱钙抑制蛋白交联,进而提高MPC贮藏稳定性已成为研究热点。目前,研究中常用的脱钙方式主要是在脱脂乳中加入NaCl或酸化剂,使部分钙从酪蛋白胶束结构中解离,进而在后续的超滤工艺中被去除,从而降低MPC体系中钙离子的含量[9-12]。但是,这些方法脱钙程度有限,而且加入盐或酸一方面会增加MPC截留液的黏度,降低膜过滤的效率,另一方面会对透过液造成污染,影响后续工艺中乳糖等其他成分的分离。因此,高效清洁的脱钙方法对开发新型的MPC配料尤为重要。
离子交换树脂凭借其绿色、环保、高效的优点在水处理工业中已有广泛的应用。部分阳离子交换树脂可吸附体系中的钙离子并将自身原本的钠或钾离子交换到体系中去[13-14]。本文旨在通过离子交换树脂脱钙来抑制MPC在储藏过程中溶解度下降——首先通过比较强酸型和弱酸型2种不同类型离子交换树脂的脱钙效率,选择了适用于工业生产的最优树脂,并通过单因素试验分别确定了平衡脱钙时间以及脱钙所需树脂量,在此基础上制备了一系列不同脱钙程度的MPC截留液,并研究了不同脱钙程度对MPC中酪蛋白的存在状态及酪蛋白胶束水合率的影响。
1 实验材料与方法
1.1实验仪器
超滤系统,三达膜科技(厦门)有限公司;超速离心机,美国Beckman Coulter公司;分析天平,美国Mettler Toledo公司;Spectr AA 220原子吸收光谱分析仪,美国Varian公司;磁力搅拌器,德国IKA集团;Mettler Toledo SevenEasy pH计,瑞士Mettler Toledo公司;K1302自动定氮仪,上海晟声公司。
1.2实验材料
巴氏杀菌脱脂乳,上海光明集团;罗门哈斯Amberlite SR1L Na树脂,美国Dow’s化学品公司;Duolite C433树脂,英国Alfa Aesar公司;浓HNO3、浓HCl、高HClO4、氧化镧(La2O3)、叠氮化钠,中国国药集团化学试剂有限公司。
1.3实验方法
1.3.1MPC截留液的制备
以添加0.01%的脱脂乳为原料,采用10 kDa截留分子质量的聚醚砜超滤膜进行超滤,待浓缩3倍后,补水稀释至原脱脂乳体积,重复上述浓缩和补水步骤2次,最后将样品浓缩3倍,得到MPC截留液,在截留液中加入0.025%叠氮化钠以防止微生物生长。
浓缩前后样品的蛋白含量根据FIL~IDF standard 20B (1993)标准凯式定氮法测定,氮含量乘以6.38转化为蛋白含量[15]。离子交换前后MPC截留液的pH值使用pH计在室温下测定。
1.3.2离子交换条件的确定
1.3.2.1离子交换树脂的类型
研究选取两种不同类型的阳离子交换树脂,分别为强酸型阳离子交换树脂Amberlite SR1L Na和弱酸型阳离子交换树脂Duolite C433,厂家提供的相关技术信息见表1。
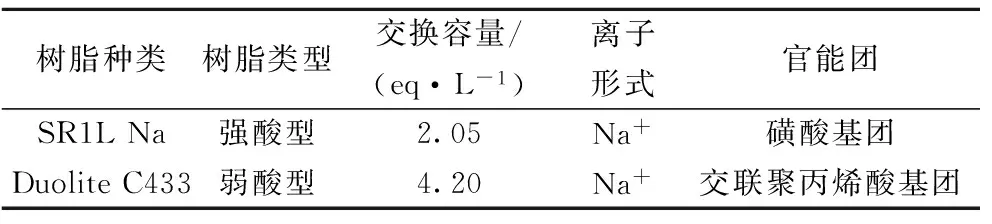
表1 离子交换树脂类型与相关技术信息
1.3.2.2脱钙率与离子交换时间的关系
截留液(100 g)中分别加入8 g强酸型树脂SR1L Na和4 g弱酸型树脂Duolite C433,在搅拌转速1 300 r/min以及25 ℃下离子交换4 h,在离子交换时间点为0、10、30、60、120和240 min取样,分别测定钙含量。根据脱钙率与离子交换时间的关系曲线确定两种离子交换树脂的平衡脱钙时间。
1.3.2.3脱钙率与离子交换树脂加入量的关系
截留液(100 g)中分别加入0、2、4、6、8、10、12和16 g离子交换树脂,在1 300 r/min转速以及25 ℃下离子交换2 h,取样测定钙含量,得出脱钙率与离子交换树脂加入量的关系曲线。
1.3.2.4树脂交换容量与加入量的关系
通过截留液脱钙率与添加树脂量的关系,进一步可得到加入树脂量与所对应的树脂交换容量 Q(eq/L)的关系,
(1)
其中:ρ为树脂的密度 ,g/mL;E为钙离子的电荷量,2eq/mol;D为脱钙率,%;C为未脱钙MPC截留液的钙含量,%;mM为MPC截留液的质量,g;MCa为钙的相对原子量,40g/mol;mR为加入树脂的质量,g。
1.3.3脱钙MPC截留液的制备
截留液(100 g)中分别加入0、0.5、1、2、3、4、6、8和16 g离子交换树脂Amberlite SR1L Na,搅拌转速1 300 r/min以及25 ℃下离子交换2 h,得到了一系列不同脱钙程度的MPC截留液。
1.3.4钙含量的测定
准确称取1~1.5 g MPC截留液,加入20 mL浓硝酸以及5 mL HClO4高温消化至剩余2~3 mL,超纯水定容至50 mL。取5 mL定容样品加入1 mL镧溶液并再次定容至50 mL。稀释样品用Spectr AA 220原子吸收光谱分析仪测定其钙含量。
1.3.5胶束态酪蛋白含量的测定
准确称得MPC截留液在100 000 g离心力下超速离心1.5 h,分离可溶性蛋白上清液与胶束态酪蛋白沉淀物。分离得到的胶束态酪蛋白沉淀置于105 ℃烘干7 h,称量沉淀烘干后的干基质量为mmicelle,胶束酪蛋白质量占MPC截留液总质量的百分比n(%)可由公式(2)表示:
(2)
式中:mmicelle表示胶束肽酪蛋白沉淀的干基质量,g;mretentate表示浓缩乳蛋白截留液的总质量,g。
1.3.6胶束态酪蛋白的水合率[15]
如方法1.3.5中所述,超离心分离出的沉淀酪蛋白烘干前后的质量分别为mwet与mmicelle,由(3)式计算得水合率H(g/g干物质):
(3)
1.3.7游离酪蛋白含量与成分的测定
超离心分离所得上清液的蛋白成分采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳法(SDS-PAGE)测定。上清液用超纯水稀释10倍后与电泳样品缓冲液体积比1∶1混合均匀,沸水浴3 min后迅速冷却,在10 000 g,3 min高速离心条件下分离得到上清液制得测试样品。样品上样量为30 μL,采用4%的浓缩胶和13%的分离胶,在电流分别为25和45 mA的条件下进行电泳测试。
1.3.8树脂的再生
将阳离子交换树脂移入烧杯中,用1 mol/L HCl 3倍体积处理漂洗3次,搅拌并浸泡24 h,将盐酸溶液排尽,去离子水洗至中性,再用1 mol/L NaOH 3倍体积处理漂洗3次,水洗直至中性。长期不用,需保存在10%~15% NaCl或碱性条件下,以防止微生物生长,但使用前需再一次水洗。
2 结果与讨论
2.1离子交换平衡脱钙时间的确定
浓缩前市售脱脂乳的蛋白浓度为(32.0±1.3)mg/mL,浓缩后MPC截留液的蛋白浓度为(90.0±2.2)mg/mL。MPC截留液的脱钙率与离子交换时间的关系曲线如图1所示。
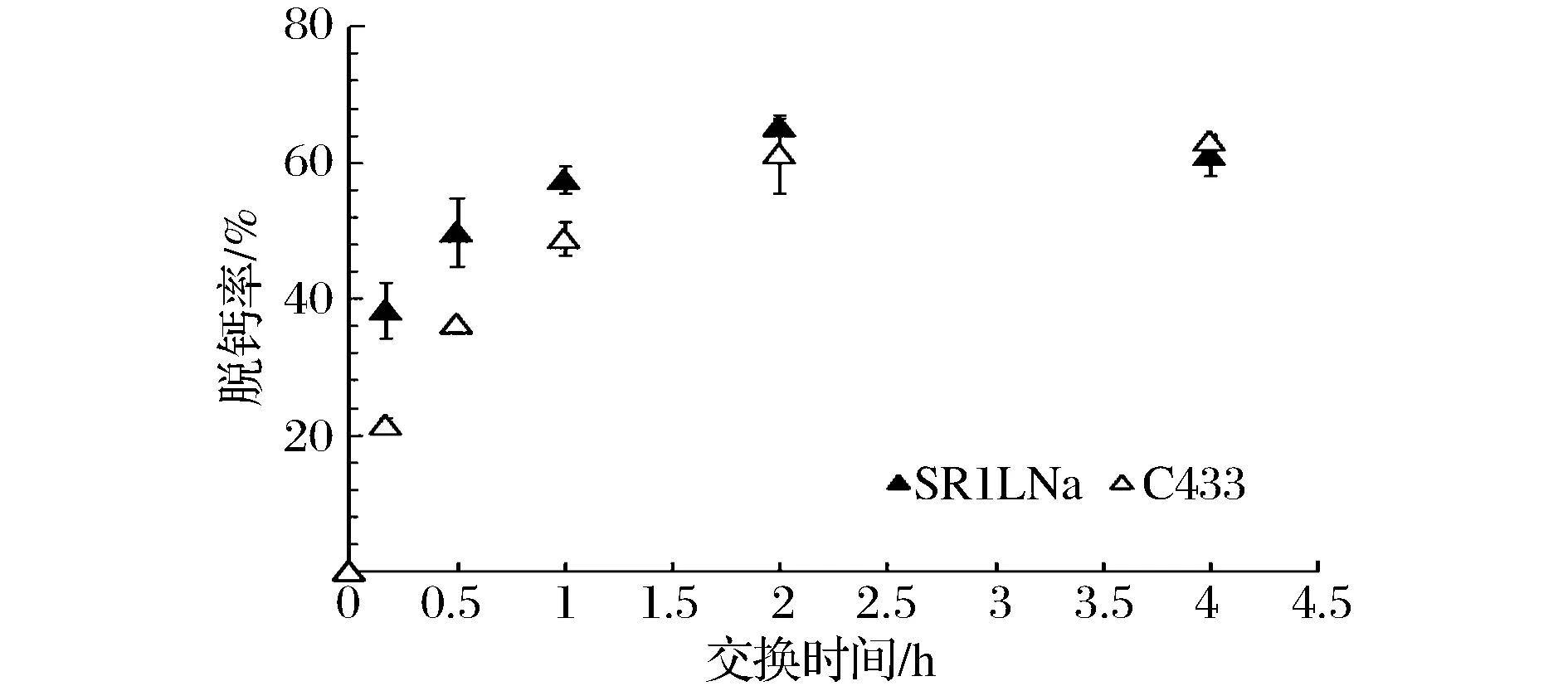
图1 MPC截留液脱钙率与离子交换时间的关系曲线Fig.1 The decalcification ratios of MPC retentates at different ion exchange time
从图1中可看出,离子交换初始1 h内,2种树脂的离子交换速率较高,但SR1L Na的脱钙率明显高于C433。离子交换1~2 h内,离子交换速率明显变缓并逐渐趋于平衡, SR1L Na的脱钙率依然高于C433,但两者的脱钙率差值逐渐减小。离子交换2~4 h内,2种树脂的脱钙率达到平衡并趋于相同的值。由此,确定2种树脂达到平衡脱钙率的时间为2 h。
2.2离子交换树脂量的确定
MPC截留液的脱钙率与离子交换树脂添加量的关系如图2所示。对于C433树脂,当加入0~8 g树脂时,脱钙率随树脂量的增加呈线性上升;当加入8~16 g树脂时,脱钙率趋于不变;对于SR1L Na树脂,当加入0~12 g树脂时,脱钙率随树脂添加量的增加呈线性上升;当加入12~16 g树脂时,脱钙率增长变缓,趋于平衡。当脱钙曲线达到平衡时,2种树脂所对应的脱钙率均保持在80%~90%。
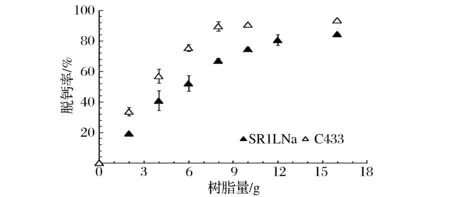
图2 MPC截留液脱钙率与树脂添加量的关系曲线Fig.2 The decalcification ratios of MPCretentates with different dosages of ion exchange resin
2.3离子交换树脂的交换容量
离子交换树脂的交换容量随树脂量变化曲线如图3所示。随着树脂量的增加,2种树脂的交换容量都呈下降趋势。当加入2 g树脂时,C433树脂交换容量是SR1L Na树脂的2倍;随着树脂量的增加,C433树脂交换容量的下降速率大于SR1L Na树脂交换容量的下降速率,且两者交换容量的差值逐渐减小;当加入量为16 g时,2种树脂的交换容量达到相同值。
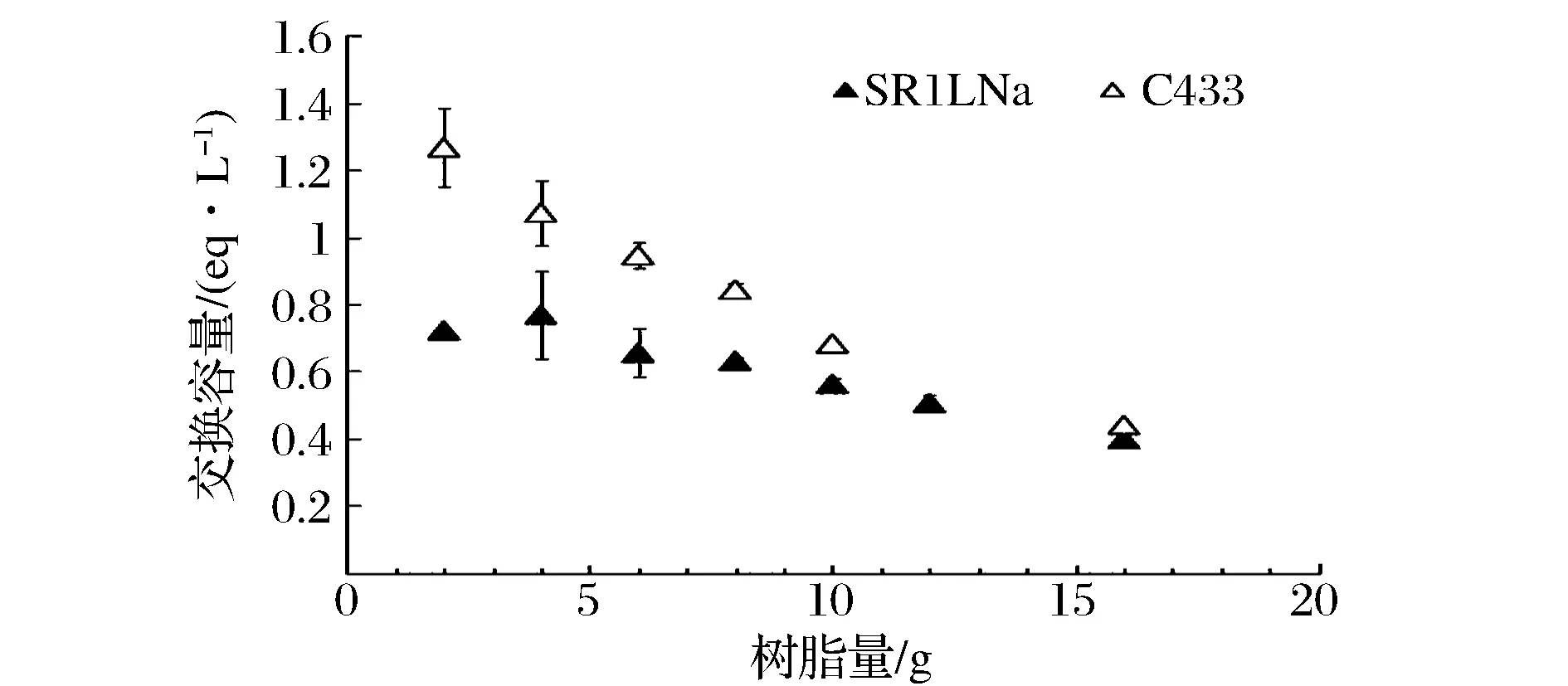
图3 离子交换树脂的交换容量与其添加量的关系Fig.3 The adsorption capability of ion exchange resin with its dosage
因此,综合考虑2种树脂的脱钙效率、交换容量和价格等因素,选择最适用于工业化生产、性价比较高的树脂为SR1L Na。
2.4脱钙MPC的钙含量
SR1L Na树脂加入量与MPC截留液钙含量、相应的脱钙率以及pH值的关系如表2所示。未加入树脂的截留液中钙含量为0.233%;当加入0.5~16 g树脂后,截留液中所剩的钙含量为0.220%~0.038%,所对应的脱钙率为5.5%~83.6%。离子交换的环境为pH值6.85的MPC截留液,离子交换结束时不同脱钙率的MPC截留液pH值已在表2中标出。
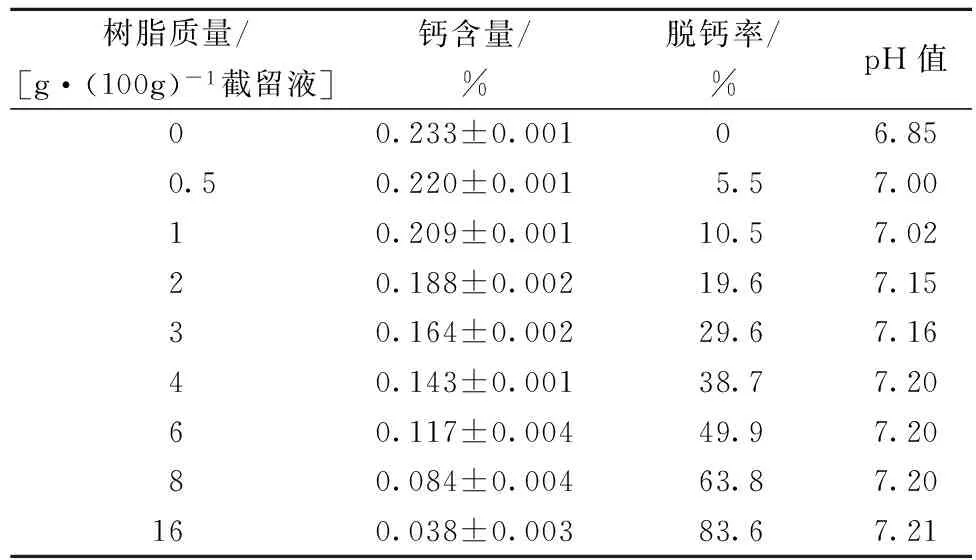
表2 脱钙MPC截留液钙含量以及相应的脱钙率
2.5脱钙MPC中胶束态酪蛋白的含量
MPC截留液中酪蛋白占总蛋白含量的80%,未脱钙的酪蛋白是以胶束结构存在的。但随着钙的脱除,酪蛋白胶束会发生逐步解离,并且脱钙率越高,MPC截留液中胶束态酪蛋白的成分含量越低(如图4所示)。

图4 MPC截留液中胶束态酪蛋白含量随脱钙率的变化曲线Fig.4 The contents ofmicellar casein in the MPC retentates with different decalcification ratios
未脱钙的MPC截留液中,含有6.5%的胶束态酪蛋白;5.5%脱钙的MPC截留液中,含有4.9%胶束态酪蛋白;10.5%脱钙的MPC截留液中,含有3.1%胶束态酪蛋白;19.6%脱钙的MPC截留液中,含有1.7%胶束态酪蛋白;脱钙率为29.6%的MPC截留液中,含有0.8%胶束态酪蛋白;直到脱钙率达到38.7%~63.8%,MPC截留液中胶束态酪蛋白含量仅存0.4%~0.1%;脱钙率为83.6%时,MPC截留液中的胶束态酪蛋白接近于0。可以得出,随着脱钙率的增加,钙逐渐从酪蛋白胶束中脱除,导致酪蛋白胶束逐渐解离,胶束态酪蛋白的含量逐渐下降。脱钙为49.9%时,大部分的酪蛋白胶束已解离,脱钙达83.6%时,酪蛋白胶束完全解离为游离酪蛋白[16-17]。
2.6脱钙MPC中游离酪蛋白的含量测定
如2.5中所述,MPC截留液的脱钙率越高,其中胶束态酪蛋白含量(沉淀)越低,游离酪蛋白的含量也就越高。如图5所示即为脱钙MPC截留液超离心上清液的电泳图。
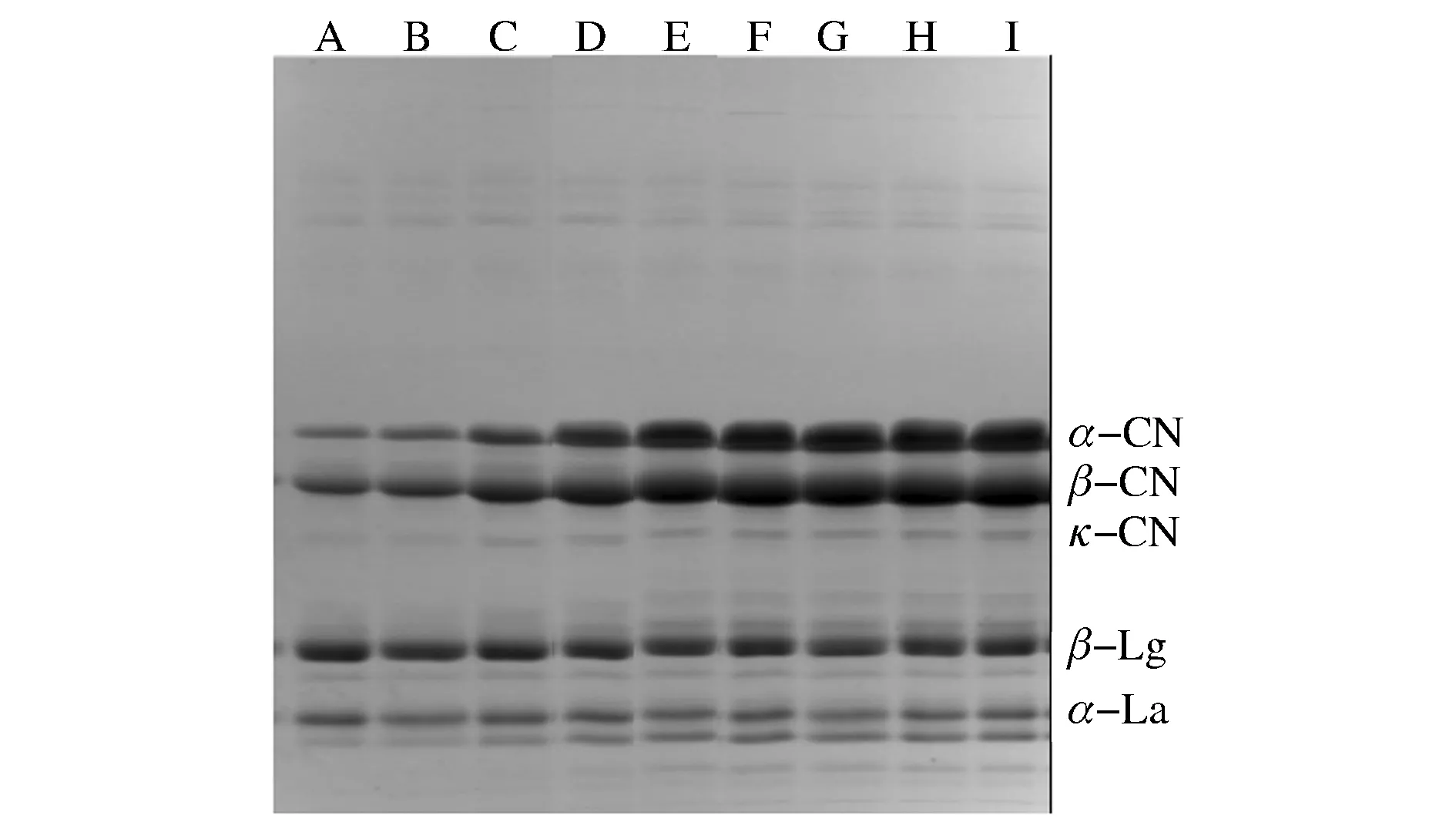
A-0%脱钙;B-5.5%脱钙;C-10.5%脱钙;D-19.6%脱钙;E-29.6%脱钙;F-38.7%脱钙;G-49.9%脱钙;H-63.8%脱钙;I-83.6%脱钙图5 不同脱钙率MPC截留液超离心上清液中可溶性蛋白的含量随脱钙率的变化Fig.5 The contents of soluble proteins in the MPC retentates with different decalcification ratios
未脱钙的MPC截留液的电泳条带(A)颜色最浅,表明其中游离酪蛋白含量最少;5.5%脱钙MPC截留液的条带(B)颜色相比于未脱钙的稍深,其中的游离酪蛋白含量稍有增加;10.5%脱钙MPC截留液的条带(C)颜色更深,表明其游离酪蛋白含量更高;19.6%~38.7%脱钙MPC截留液的电泳条带(D~F)颜色逐渐变深,说明其中游离酪蛋白的含量越来越高;49.9%~83.6%脱钙MPC截留液的条带(G-I)颜色几乎不变,其中游离酪蛋白含量几乎保持不变并达到最高值。由此证明,MPC截留液脱钙率达到49.9%时,其中大部分酪蛋白胶束已经解离成游离酪蛋白,这与2.5中得出的结论相符。
2.7脱钙MPC中胶束态酪蛋白水合率的测定
MPC截留液随脱钙率的增加,其中胶束态酪蛋白的水合率先上升后下降(如图6所示)。脱钙率为0%时,MPC截留液中胶束态酪蛋白的水合率为2.6 g/g干基。当脱钙率为0~29.6%时,MPC截留液中胶束态酪蛋白的水合率逐渐上升到4.1 g/g干基。当脱钙率为29.6%~83.6%时,MPC截留液中胶束态酪蛋白的水合率逐渐降低直至3.3 g/g干基。由此可以看出,部分脱钙(0%~29.6%)的MPC截留液,其酪蛋白胶束的水合率逐步增强,推测可能是由于钙的少量脱除使胶束结构变得疏松,其变大的空隙中可以容纳更多的水分子;但是,进一步脱钙(29.6%~83.6%)时,胶束结构已经大部分被破坏,解离的胶束结构结合水分子的能力大大减弱,因此导致其水合率逐步下降[15,18-19]。

图6 MPC截留液中酪蛋白胶束的水合率随脱钙率不同的变化曲线Fig.6 The hydration values of casein micelles in MPC retentates with different decalcification ratios
3 结论
本研究以脱脂乳经超滤后得到的MPC截留液作为研究对象,首先通过比较强、弱酸型阳离子交换树脂在对MPC截留液脱钙的过程中需要的离子交换平衡时间、离子交换树脂添加量以及性价比选择最适用于工业化生产的树脂;构建不同脱钙程度的MPC体系,并且分析不同脱钙程度截留液中的总钙、胶束态酪蛋白以及游离酪蛋白的成分变化,以及脱钙后胶束态酪蛋白的水合率变化。当脱钙率从0%增加到83.6%时,胶束态酪蛋白含量从6.5%截留液降为0;上清液中游离酪蛋白浓度逐渐增加至平衡;而胶束态酪蛋白的水合率先从2.6 g/g干基增加到4.1 g/g干基(29.6%脱钙),然后从4.1 g/g干基降至3.3 g/g干基。通过离子交换脱钙得到的MPC具有新的功能性质,可广泛运用于食品工业。
[1]YE A. Functional properties of milk protein concentrates: emulsifying properties, adsorption and stability of emulsions[J]. International Dairy Journal, 2011, 21(1): 14-20.
[2]HAVEA P. Protein interactions in milk protein concentrate powders[J]. International Dairy Journal, 2006, 16(5): 415-422.
[3]FRANCOLINO S, LOCCI F, GHIGLIETTI R, et al. Use of milk protein concentrate to standardize milk composition in Italian citric Mozzarella cheese making[J]. LWT-Food Science and Technology, 2010, 43(2): 310-314.
[4]FARKYE N Y, YIM B. Use of dry milk protein concentrate in pizza cheese manufactured by culture or direct acidification[J]. Journal of Dairy Science, 2003, 86(12): 3 841-3 848.
[5]MIMOUNI A, DEETH H C, WHITTAKER A K, et al. Rehydration process of milk protein concentrate powder monitored by static light scattering[J]. Food Hydrocolloids, 2009, 23(7): 1 958-1 965.
[6]UDABAGE P, PUVANENTHIRAN A, YOO J A, et al. Modified water solubility of milk protein concentrate powders through the application of static high pressure treatment[J]. Journal of Dairy Research, 2012, 79(1): 76-83.
[7]MIMOUNI A, DEETH H C, WHITTAKER A K, et al. Investigation of the microstructure of milk protein concentrate powders during rehydration: alterations during storage[J]. Journal of Dairy Science, 2010, 93(2): 463-472.
[8]HUNTER R J, HEMAR Y, PINDER D N, et al. Effect of storage time and temperature of milk protein concentrate (MPC85) on the renneting properties of skim milk fortified with MPC85[J]. Food Chemistry, 2011, 125(3): 944-952.
[9]MAO X Y, TONG P S, GUALCO S, et al. Effect of NaCl addition during diafiltration on the solubility, hydrophobicity, and disulfide bonds of 80% milk protein concentrate powder[J]. Journal of Dairy Science, 2012, 95(7): 3 481-3 488.
[10]SIKAND V, TONG P S, ROY S, et al. Solubility of commercial milk protein concentrates and milk protein isolates[J]. Journal of Dairy Science, 2011, 94(12): 6 194-6 202.
[11]POST A E, ARNOLD B, WEISS J, et al. Effect of temperature and pH on the solubility of caseins: environmental influences on the dissociation of αS-and β-casein[J]. Journal of Dairy Science, 2012, 95(4): 1 603-1 616.
[12]BEHERA P, KUMAR R, SANDEEP I V R, et al. Casein hydrolysates enhance osteoblast proliferation and differentiation in mouse bone marrow culture[J]. Food Bioscience, 2013, 2: 24-30.
[13]PREMLAL RANJITH H M, LEWIS M J, MAW D. Production of calcium-reduced milks using an ion-exchange resin[J]. Journal of Dairy Research, 1999, 66(1): 139-144.
[14]VAN KREVELD A, VAN MINNENG. Calcium and magnesium ion activity in raw milk and processed milk[J]. Nederlandsch Melk-en Zuiveltijdschrift, 1955, 9: 1-29.
[15]SILVA N N, PIOT M, DE CARVALHOA F, et al. pH-induced demineralization of casein micelles modifies their physico-chemical and foaming properties[J]. Food Hydrocolloids, 2013, 32(2): 322-330.
[16]MCMAHON D J, DU H, MCMANUSW R, et al. Microstructural changes in casein supramolecules during acidification of skim milk[J]. Journal of Dairy Science, 2009, 92(12): 5 854-5 867.
[17]MARCHIN S, PUTAUX J L, PIGNON F, et al. Effects of the environmental factors on the casein micelle structure studied by cryo transmission electron microscopy and small-angle x-ray scattering/ultrasmall-angle x-ray scattering[J]. The Journal of Chemical Physics, 2007, 126(4): 045101.
[18]NG-KWAI-HANG K F, OTTER D E, LOWEE, et al. Influence of genetic variants of β-lactoglobulin on milk composition and size of casein micelles[J]. Milchwissenschaft, 2002, 57(6): 303-306.
[19]WALSTRA P. On the stability of casein micelles[J]. Journal of Dairy Science, 1990, 73(8): 1 965-1 979.
Effects of ion exchange decalcification on casein micelles
HU Jin-hua,XU Yu-ting, LIU Da-song, LI Jun-ke, ZHANG Jie, ZHOU Peng*
(State Key Laboratory of Food Science and Technology, School of Food Science and Technology,Jiangnan University, Wuxi 214122,China)
This study investigated the technology of ion exchange decalcification of milk protein concentrate (MPC), and also the effects of partial decalcification on casein micelle and its hydration property. A series of decalcified MPC retentates (decalcification ratios of 0, 5.5%, 10.5%, 19.6%, 29.6%, 38.7%, 49.9%, 63.8%, 83.6%) were produced after 2 hours of ion exchange with adding corresponding amounts of resins. Casein components dissociated from casein micelles regarding the increase of decalcified MPC retentates; the contents of micellar casein decreased, while the concentrations of dissociated casein in the supernantants increased. The hydration properties of casein micelles increased from 2.6 g/g dry basis to 4.1 g/g dry basis (0-29.6% decalcification), and then decreased to 3.3 g/g dry basis (29.6%-83.6% decalcification). The content of calcium ions and the state of casein micelles in MPCs may affect the functionalities of MPCs in application. This study offered the potential of new MPCs with different functionalities and also will broaden the applications of new MPCs into food industry.
milk protein concentrate(MPC);ion exchange;decalcification;micellar casein;dissociated casein;hydration
10.13995/j.cnki.11-1802/ts.201609010
博士,副教授(周鹏教授为通讯作者,E-mail: zhoupeng@jiangnan.edu.cn)。
国家自然科学基金(31471697); 教育部科学技术研究项目(113032A)
2016-01-11,改回日期:2016-04-13
