经导管二尖瓣介入治疗的影像学新进展
2016-09-29燕综述刘惠亮审校
李 燕综述 刘惠亮审校
· 综述 | REVIEWS ·
经导管二尖瓣介入治疗的影像学新进展
李 燕1综述 刘惠亮2审校
二尖瓣关闭不全(mitral regurgitation,MR)是老年人中患病率较高的疾病,可显著缩短患者的生存时间。由于外科手术并发症发生率高、风险大,使得经导管治疗二尖瓣关闭不全这一新兴技术逐渐被患者所接受。因为缺乏直接的可视化,围手术期的影像学检查成为这项技术开展的关键。笔者就经导管二尖瓣介入治疗的影像学进展进行综述。
二尖瓣关闭不全;影像学;超声心动图
二尖瓣关闭不全(mitral regurgitation,MR)是老年人中最常见的心脏瓣膜病,根据病因大致分为以下两种。原发性(退行性)MR为二尖瓣的病理变化造成结构性的关闭不全,而继发性(功能性)MR的二尖瓣结构完整,是由心室重构引起的相对功能障碍。随着风湿性心脏病患病率的下降及人口老龄化的进展,退行性MR成为目前最常见的病因[1]。由于外科手术风险高、并发症多,经导管二尖瓣介入治疗可能成为有效且安全的新兴治疗方法[2],其治疗策略包括:经皮二尖瓣夹合术、瓣叶修复术、瓣环成形术及左心室重构术等[3-5]。由于经导管二尖瓣介入治疗无法直视病变部位,围手术期的影像学检查成为了手术成功的关键。
MR介入治疗的影像学检查分为术前、术中及术后3个部分。术前成像用于诊断疾病并明确病理改变的具体情况及严重性,重要的是它能沿着特定的平面进行三维图像重建,并指导选择合适尺寸的器械。术中成像引导着手术的进行,对精确放置器械尤为重要,还决定了手术成功与否及并发症的发生率。术后成像则用于持续监测。以下将重点介绍术前、术中的影像学检查方法。
1 术前的影像学检查
1.1 超声心动图 二维超声心动图仍然是诊断MR和进行严重性分级的金标准,经胸和经食管超声能够准确评估二尖瓣的结构和功能,包括二尖瓣环的几何形状和尺寸、瓣环钙化、瓣叶结构及运动、瓣膜下的腱索及乳头肌的解剖结构等。胸骨旁长轴及心尖长轴切面通常用来测量瓣环的前后径,而心尖二腔切面用来测量联合间径的直径(图1A、图1B)。通过连续波多普勒测量压力半衰期、瓣口面积,利用血液流速测量通过瓣膜的平均压力阶差,最终评价二尖瓣狭窄的严重程度。评价二尖瓣反流的严重程度主要通过测量反流口面积、近端反流速宽度、射流紧缩的直径及肺静脉流型等指标实现[6]。在描述左心室重构和功能障碍对二尖瓣功能的影响中,左心室的大小和功能是重要参数,比如在许多临床试验中,将射血分数<25%作为经导管二尖瓣修补术的排除标准[5]。2009年的一项研究发现,与二维超声心动图相比,经食管超声心动图(transesophageal echocardiography,TEE)在二尖瓣形态学的测量上有更精确的评价(图1C)[7]。在退行性MR中,自动定量分析的TEE对于二尖瓣特殊病理改变如连枷间隙及宽度可测量出准确的数据。二维超声心动图采集图像的平面是固定的,而三维超声心动图获取的二尖瓣三维容积数据,可以在任何平面进行三维重建,所以三维超声心动图专门用于图像采集后的进一步分析,这种效果与计算机X线断层扫描(computed tomography,CT)类似。通过比较三维超声心动图及多排螺旋CT(multi-detector computed tomography,MDCT)的二尖瓣形态数据发现,两种检查具有很高的可比性,差异非常小。另外,直观的二尖瓣三维重建图像有着跟实体非常相近的结构,被称为“手术参照”[8]。超声心动图通过评价瓣叶的结构和运动确定二尖瓣关闭不全的病因及病理分型。Carpentier等[9]将MR分为三类:Ⅰ型是瓣叶运动正常但存在瓣叶穿孔;Ⅱ型包括瓣叶脱垂和连枷导致的瓣叶运动亢进;Ⅲa型是瓣叶纤维化引起的瓣叶运动受限;Ⅲb型指心室重构、瓣环扩张及乳头肌缺血导致的继发性瓣叶功能不全。从经皮瓣膜修补术的经验来看,术前影像学检查既决定了能否手术又明确了手术方法。比如非常靠近外侧或内侧的瓣叶圈合无法通过瓣叶修补术或瓣环成形术得到治疗,且已被证实。连枷段较长时手术需要多种器械配合,对于连枷状瓣叶靠近连合处的情况,手术也会相对复杂一些[5]。接合区的长度和深度对于瓣环平面的评估,也是一个非常重要的参数,接合长度<2 mm的病变尚无合适的器械用于介入治疗[10]。
1.2 MDCT MDCT因具有很高的空间分辨率,能够采集特定强度的三维数据,在术前影像学中成为常规检查项目[11]。如上述的三维超声心动图一样,在相关的容积数据采集后可以在任意确定的平面进行三维重建,提供了更详细、更可视化的心脏形态。由于数据采集的方向被扫描床患者的位置固定化,因此重建可以从体轴任意方向进行旁切,特别是从血管造影的方向(左前斜位/右前斜位,头侧/足侧)[12]。心血管CT需要在同步的心动周期中采集,方法之一是利用前瞻性心电图门控,实现在不同的心动周期,如收缩期、舒张期,进行前瞻性的触发数据采集,其可减少辐射剂量,但缺点是限制了对单期心动周期模式的数据分析。然而,回顾性分析心电图门控模式可在整个心动周期连续采集心脏的容积数据,并记录心电信号,最后根据所需的时相进行重建,该方法的辐射暴露水平更高,但具有更强的灵活性。可在任何平面、整个心动周期的任何一个时相进行精确的三维或四维重建,是心脏介入治疗中非常重要的手段[13,14]。并且,相对于瓣环与闭合点的距离、乳头肌的结构,多排螺旋CT对于二尖瓣环的形状、尺寸,瓣环钙化存在与否、严重程度,冠状窦的解剖、空间关系,瓣叶解剖、有无增厚、钙化等的描述更为准确(图2、图3)。二尖瓣环及瓣叶的解剖结构影响着介入手术的成功与否,Blanke等[15]指出在二尖瓣置换术中植入器械时,应去除二尖瓣前叶来减小发生左室流出道梗阻的可能性。与其他器械不同的是,MDCT可进一步量化二尖瓣环的钙化程度,利用左室周径在乳头肌的底部和顶部测量乳头肌的位移。MDCT还可评价二尖瓣环、冠状窦及冠状动脉左旋支的位置关系,这对于经导管二尖瓣成形术中的方法选择非常重要,如冠状窦和二尖瓣环之间的角度较宽,表明两者之间的压力传递较弱,可能导致手术失败[5]。与磁共振成像(magnetic resonance imaging,MRI)和超声心动图相比,四维MDCT的时间分辨率较低,而且不能像超声心动图那样进行实时成像[16]。因此,MDCT对于瓣叶、键索的可视化是有限的,特别是与TEE比较。此外,由于不能对流动进行评估,也就无法直观呈现二尖瓣反流并进行分级。MDCT对于测量乳头肌、后叶角及穹隆高度之间的距离不是很准确,也就无法诊断继发性MR[17]。另一方面,对于肾功能不全患者,应根据肾小球滤过率来调整MDCT所需的碘造影剂用量,以预防出现造影剂肾病,虽然这样会降低成像效果[18]。
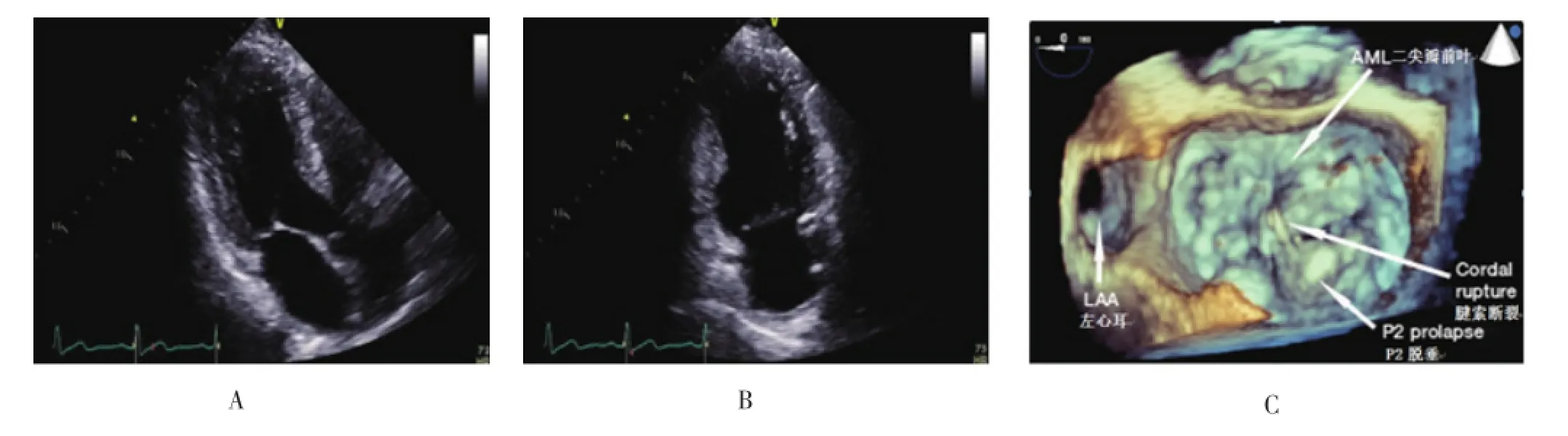
图1 术前的影像学检查中的超声心动图
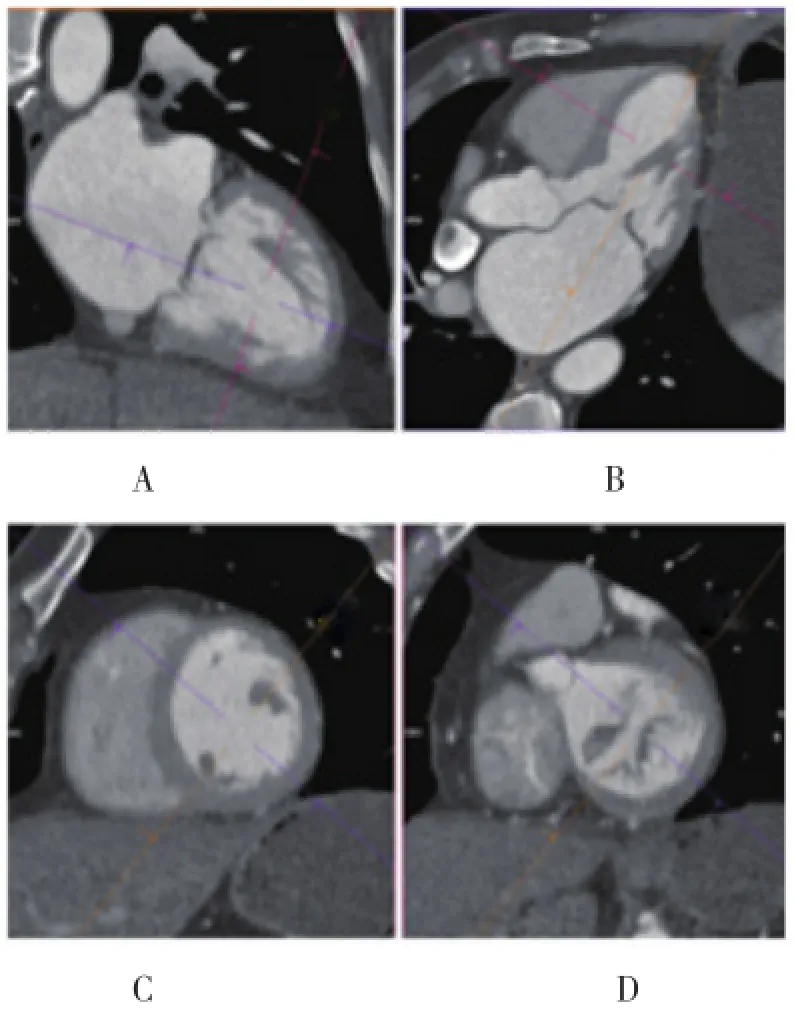
图2 1例68岁退行性二尖瓣病变的老年女性患者的心脏CT图像
图3 同一患者的CT图像平面(舒张期)
1.3 MRI 术前MRI的应用提供了更多关于二尖瓣环瓣叶结构和功能的信息,MRI常用于超声心动图结果出现问题时,并且被认为是评估左、右心室容积的金标准。与超声心动图相比,MRI对于二尖瓣功能及血流动力学参数的描述更为复杂,但MRI能够测出反流量及瓣口面积[7]。Uretsky等[19]开展了一项前瞻性的多中心临床研究,对103例MR患者应用超声心动图及MRI评估反流的准确性进行了比较,其中38例进行了外科手术,结果显示:在总体人群中,上述两种影像学方法无统计学差异;对于进行手术的部分人群,MRI组患者病理的左室重构程度与应用MRI得出的反流严重程度呈正相关,而超声心动图组无此相关性,表明,MRI能够更准确的评估二尖瓣反流的严重性。电影MRI的血流动力学测量可用于计算瓣膜压力梯度,虽然与超声心动图相比这一值往往被低估。需要注意的是钙化在MRI中为无信号区,所以对于瓣环、瓣膜的钙化不能进行可靠的评估。总体而言,相较于超声心动图,MRI能提供更多的二尖瓣解剖数据,且在评估反流严重程度上准确性更高。
1.4 血管造影术 血管造影是经皮瓣膜手术术前的常规项目,主要作用是确定有无冠状动脉疾病及严重程度,同时评估瓣膜的病理变化,对二尖瓣环和瓣膜的空间关系进行描述,并通过观察冠状窦和冠状动脉左旋支的关系来确定介入治疗的方案。
2 术中影像学检查
经皮二尖瓣介入手术中的影像学检查至关重要,其作用是保证器械能够准确到达二尖瓣环处。然而,如果器械安放不严密,可能导致器械栓塞、瓣周漏等并发症的发生[20]。
2.1 透视 透视是经皮瓣膜手术的重要组成部分,起到建立血管通路及引导导管在心腔内操作的作用,如果有需要,它还能识别冠状窦和冠状动脉左旋支。透视能够识别二尖瓣环钙化,界定二尖瓣的周围结构,但对于区分软组织的能力有限,所以利用透视方法将器械精确送至非钙化二尖瓣环是不可行的[21]。
2.2 经食管超声心动图 透视的局限性扩大了TEE在术中影像学中的作用,TEE是用于术中器械定位的主要手段。TEE包括三个标准切面:(1)食管中段短轴和双腔切面(60°~90°),可以用于观察房间隔和引导导管,并评估所需器械的内外径。(2)食管中段长轴切面,也称为四腔心切面(120°~150°),用于估计器械垂直于二尖瓣环所需的前后径。(3)经胃短轴切面(0°~30°),用来评估瓣叶的对合情况(图4)。三维TEE的价值在于能够清楚地显示房间隔,以及明确房间隔穿刺部位与二尖瓣之间的距离,并指导器械在正确的解剖位置展开[22]。多个观察切面使其能够同时显示两个垂直平面,以便穿刺房间隔时更为准确。送入器械展开后,TEE用于确认器械的位置及功能[23]。除了能够准确识别MR的存在及严重性,其对于严重并发症如心包填塞、间隔穿孔、冠状窦损伤及室壁运动异常等,也能立即识别。TEE在术中影像学检查中的作用至关重要,但缺点是需要插管和全身麻醉。
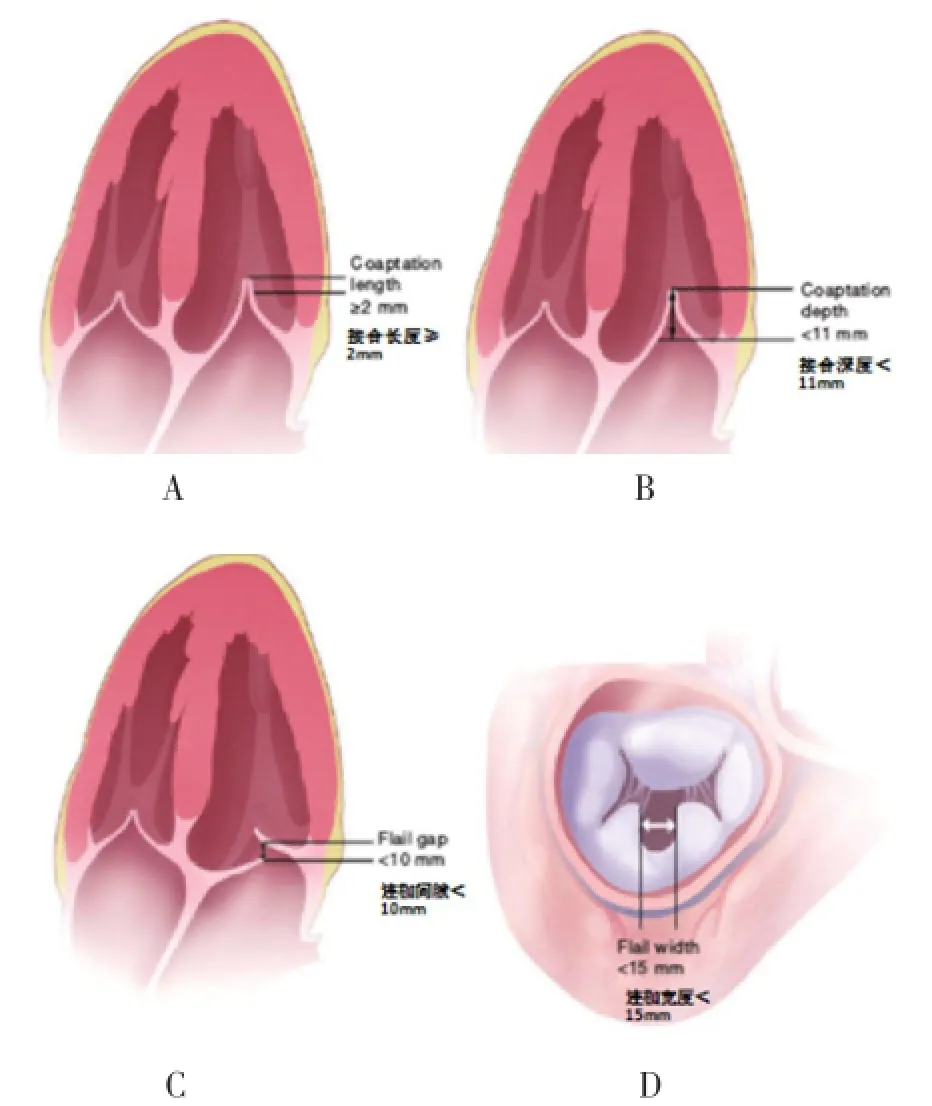
图4 二尖瓣介入术前对于瓣叶对合情况的参数评估
2.3 心内超声心动图(Intracardiac echocardiogram,ICE) ICE在器质性心脏病的介入治疗中有很大的发展潜能,可能解决上述检查中的缺陷问题。ICE的导管尖端配有一个小型的超声心动图探针,被放置在右心房并在整个手术过程中是固定的,通过体外的工作站操作而获得不同切面的图像[24]。ICE通过经心室的长短轴切面从右心室评估左心室的功能,发现并发症(心包填塞、残余MR等)。然而Henning等[25]发现,在经皮二尖瓣夹合术中二维ICE不能充分地观察左心房、二尖瓣瓣叶,限制了二尖瓣夹合术的操作。在未来,三维ICE可进一步发展以提供更详细的解剖特点,以指导心脏瓣膜及器质性心脏病的介入治疗,并且在某些特定情况下可能取代TEE和减少血管造影的应用[26,27]。
随着人口老龄化,MR在老年人群中的发病率呈上升趋势,经导管的二尖瓣介入治疗因风险小、并发症少等优点可能替代外科手术成为新的治疗手段。由于直接可视化缺乏和二尖瓣结构复杂性,介入治疗围手术期的影像学检查愈发重要。其中,超声心动图仍然是术前MR诊断及分级的金标准。MDCT因其先进的多维数据分析能力,在术前提供了更详细的MR解剖结构信息。在手术过程中,透视起到指引导管操作的作用,而经食管超声心动图更多用于器械的定位及放置,另外它对于显示软组织有独特的优越性。ICE作为新的影像学手段,在引导瓣膜介入手术中有较大发展潜能,同时能够最大限度减少气管插管和全身麻醉。未来,还需通过多中心临床试验比较各种影像学的优劣,并利用影像学检查进一步研制出更好的二尖瓣装置,促使二尖瓣介入手术能更有效、更安全开展,从而使更多的老年患者受益。
[1]Iung B, Baron G, Butchart E G, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease [J]. Eur Heart,2003, 24(13): 1231-1243.
[2]De Backer O, Piazza N, Banai S, et al. Percutaneous transcatheter mitral valve replacement: an overview of devices in preclinical and early clinical evaluation [J]. Circ Cardiovasc Interv, 2014, 7(3): 400-409.
[3]Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology( ESC);European Association for Cardio-Thoracic Surgery(EACTS), Vahanian A, et al. Guidelines on the management of valvular heart disease( version 2012) [J]. Eur Heart, 2012, 33(19): 2451-2496.
[4]Siminiak T, Dankowski R, Baszko A, et al. Percutaneous direct mitral annuloplasty using the Mitralign Bident system: description of the method and a case report [J]. Kardiol Pol,2013, 71(12): 1287-1292.
[5]Delgado V, Kapadia S, Marsan N A, et al. Multimodality imaging before, during, and after percutaneous mitral valve repair [J]. Heart, 2011, 97(20): 1704-1714.
[6]Thavendiranathan P, Liu S, Datta S, et al. Quantification of chronic functional mitral regurgitation by automated 3-dimensional peak and integrated proximal isovelocity surface area and stroke volume techniques using real-time 3-dimensional volume color Doppler echocardiography: in vitro and clinical validation [J]. Circ Cardiovasc Imaging ,2013, 6(1): 125-133.
[7]Delgado V, Tops L F, Schuijf J D, et al. Assessment of mitral valve anatomy and geometry with multislice computed tomography [J]. JACC Cardiovasc Imaging, 2009,2(5): 556-565.
[8]Shanks M, Delgado V, Ng A C, et al. Mitral valve morphology assessment: three-dimensional transesophageal echocardiography versus computed tomography [J]. Ann Thorac Surg, 2010, 90(6): 1922-1929.
[9]Carpentier A. Cardiac valve surgery:the "French correction"[J]. Thorac Cardiovasc Surg, 1983, 86(3): 323-337.
[10]Feldman T, Cilingiroglu M. Percutaneous leaflet repair and annuloplasty for mitral regurgitation [J]. Am Coll Cardiol,2011, 57(5):529-537.
[11]Flachskampf F A, Ropers D. Computed tomography to analyze mitral valve: an answer in search of a question [J]. JACC Cardiovasc Imaging, 2009, 2(5):566-568.
[12]Jilaihawi H, Kashif M, Fontana G, et al. Cross-sectional computed tomographic assessment improves accuracy of aortic annular sizing for transcatheter aortic valve replacement and reduces the incidence of paravalvular aortic regurgitation [J]. Am Coll Cardiol, 2012, 59(14): 1275-1286.
[13]Jakobs T F, Becker C R, Ohnesorge B, et al. Multislice helical CT of the heart with retrospective ECG gating: reduction of radiation exposure by ECG-controlled tube current modulation [J]. Eur Radiol, 2002, 12(5): 1081-1086.
[14]Schoenhagen P, Numburi U, Halliburton S S, et al. Threedimensional imaging in the context of minimally invasive and transcatheter cardiovascular interventions using multi-detector computed tomography: from pre-operative planning to intra-operative guidance [J]. Eur Heart, 2010,31(22): 2727-2740.
[15]Blanke P, Dvir D, Cheung A, et al. Mitral Annular Evaluation With CT in the Context of Transcatheter Mitral Valve Replacement [J]. JACC Cardiovasc Imaging, 2015, 8(5): 612-615.
[16]Schoenhagen P, Tuzcu E M, Kapadia S R, et al. Threedimensional imaging of the aortic valve and aortic root with computed tomography: new standards in an era of transcatheter valve repair/implantation [J]. Eur Heart,2009, 30(17): 2079-2086.
[17]Flachskampf F A, Ropers D. Computed tomography to analyze mitral valve: an answer in search of a question [J]. JACC Cardiovasc Imaging, 2009, 2(5): 566-568.
[18]Schoenhagen P, Baker M E. Our preoccupation with ultralow dose radiation exposure. Low contrast resolution and cardiovascular CT imaging [J]. Cardiovasc Comput Tomogr,2014, 8(6): 426-428.
[19]Uretsky S, Gillam L, Lang R, et al. Discordance between echocardiography and MRI in the assessment of mitral regurgitation severity: a prospective multicenter trial [J]. J Am Coll Cardiol, 2015, 65(11): 1078-1088.
[20]Descoutures F, Himbert D, Maisano F, et al. Transcatheter valve-in-ring implantation after failure of surgical mitral repair [J]. Eur J Cardiothorac Surg, 2013, 44(1): e8-e15.
[21]Bapat V, Buellesfeld L, Peterson M D, et al. Transcatheter mitral valve implantation( TMVI) using the Edwards FORTIS device [J]. Euro Intervention, 2014, 10(suppl U): U120-U128.
[22]Kim J H, Kocaturk O, Ozturk C, et al. Mitral cerclage annuloplasty, a novel transcatheter treatment for secondary mitral valve regurgitation: initial results in swine [J]. Am Coll Cardiol, 2009, 54(7): 638-651.
[23]Al Amri I, Debonnaire P, van der Kley F, et al. Acute effect of MitraClip implantation on mitral valve geometry in patients with functional mitral regurgitation: insights from three-dimensional transoesophageal echocardiography [J]. Eurolntervention, 2016, 11(13): 1554-1561.
[24]Maini B. Real-time three-dimensional intracardiac echocardiography: an early single-center experience [J]. Invasive Cardiol, 2015, 27(1): E5-E12.
[25]Henning A, Mueller I I, Mueller K, et al. Percutaneous edge-to-edge mitral valve repair escorted by left atrial intracardiac echocardiography( ICE) [J]. Circulation,2014, 130(20): e173-e174.
[26]Silvestry F E, Kadakia M B, Willhide J, et al. Initial experience with a novel real-time three-dimensional intracardiac ultrasound system to guide percutaneous cardiac structural interventions: a phase 1 feasibility study of volume intracardiac echocardiography in the assessment of patients with structural heart disease undergoing percutaneous transcatheter therapy [J]. Am Soc Echocardiogr, 2014, 27(9): 978-983.
[27]Bartel T, Bonaros N, Edlinger M, et al. Intracardiac echo and reduced radiocontrast requirements during TAVR [J]. JACC Cardiovasc Imaging, 2014, 7(3): 319-320.
(2016-05-04收稿 2016-07-28修回)
(责任编辑 罗发菊)
Progress on imaging in the context of transcatheter mitral valve interventional therapy
LI Yan1and LIU Huiliang2. 1. Clinical College of General Hospital of Chinese People's Armed Police Force, Anhui Medical University, Beijing 100039, China; 2. Department of Cardiology, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
LIU Huiliang, E-mail: lhl518@vip.sina.com
Mitral regurgitation (MR) has a high prevalence in older patient populations, obviously decreases survival rates. Due to the high incidence of complications and risks, transcatheter repair/replacement is emerging as treatment options for these patients with mitral regurgitation. Because of the lack of direct visualization, peri-procedural imaging is critical for these procedures. In this review, the author summarizes imaging in the context of transcatheter mitral valve interventional therapy.
mitral regurgitation; imaging; echocardiography
R654.2
10.13919/j.issn.2095-6274.2016.09.014
李 燕,硕士研究生在读,E-mail:755142584@qq.com
1. 100039 北京,安徽医科大学武警总医院临床学院;2. 100039 北京,武警总医院心内科
刘惠亮,E-mail:lhl518@vip.sina.com
