7种杀菌剂对牡丹黄斑病菌生长和发育的影响
2016-09-26徐建强杨改凤胡建功李慧凯林晓民
徐建强,杨改凤,田 娟,胡建功,李慧凯,林晓民
(河南科技大学林学院,河南 洛阳 471003)
7种杀菌剂对牡丹黄斑病菌生长和发育的影响
徐建强,杨改凤,田 娟,胡建功,李慧凯,林晓民
(河南科技大学林学院,河南 洛阳 471003)
为筛选防治牡丹黄斑病的化学药剂,采用菌丝生长速率法测定了7种杀菌剂对病菌菌丝生长的抑制活性,并采用涂布平板法测定了多菌灵、苯醚甲环唑及嘧菌酯对病菌分生孢子萌发的影响,在含药平板上测定了对产孢量影响。结果表明,嘧菌酯和醚菌酯可强烈抑制菌丝生长,EC50分别为0.247、0.865 mg·L-1,嘧菌酯对孢子萌发和芽管伸长均具有很强的抑制活性,但对产孢量影响较弱。戊唑醇、氟环唑、丙环唑和苯醚甲环唑对菌丝生长也有不同程度的抑制活性,EC50分别为2.808、1.268、4.078、0.446 mg·L-1;苯醚甲环唑对孢子萌发的影响较弱,但对病菌产孢有强烈的抑制作用。多菌灵对病菌菌丝生长的毒力为1.034 mg·L-1,对孢子萌发及产孢量均有一定的抑制活性。3类杀菌剂均可用于牡丹黄斑病的化学防治,根据其不同的形态毒理学效应应采用不同的施用方法:嘧菌酯可作为保护剂在病害发生前期喷施;苯醚甲环唑可作为治疗剂在病害发生期使用;多菌灵可在病害发生前同嘧菌酯混用或病害发生期同苯醚甲环唑混用,以防止抗药性的出现。
牡丹黄斑病;杀菌剂;菌丝生长;孢子萌发;孢子形成
牡丹(PaeoniasuffruticosaAndrews)隶属于芍药科芍药属牡丹组,为中国特有的植物资源,世界各地广为种植的牡丹均起源于中国。牡丹不仅具有很高的观赏价值,而且还有一定的药用价值。中国已形成河南洛阳和山东菏泽2个主要的牡丹生产基地。牡丹侵染性病害有20多种,以真菌引起的叶斑病种类最多,危害最重[1]。感染叶斑病后,牡丹叶片光合作用及营养物质合成等生理功能受到破坏,导致根养分贮藏减少,对当年的花芽长势及来年的开花品质产生严重影响[2-3],故对牡丹叶斑病的防治不能松懈。牡丹黄斑病是由斑点叶点霉(Phyllostictacommonsii)侵染引起,在洛阳各牡丹种植园区发生普遍,发病迅速,病斑扩展快,严重时病斑相连,造成叶片失绿焦枯[4,5]。黄斑病已发展成为牡丹生产上的巨大障碍,对该病害的防治迫在眉睫,急需筛选一批对黄斑病有较好防效的化学杀菌剂。目前对牡丹病害的研究仅限于病原菌的鉴定及病害的大田防治方面,对病害防治药剂筛选的研究较少[6]。在牡丹黄斑病化学防治方面,张格杰等[7]测定了7种杀菌剂对斑点叶点霉的离体抑制效果,结果表明嘧霉胺对病菌菌丝生长的抑制作用较好,但烯酰吗啉和苯醚甲环唑对病菌的毒力最强;贺春玲等[8]测定了12种杀菌剂对斑点叶点霉的离体抑制活性,发现百菌清和代森锰锌对病菌菌丝生长的抑制率最大,病菌对百菌清更为敏感,而多菌灵对菌丝生长的抑制率和毒力均处于中等水平;但张国辉等[9]对从太子参斑点病上分离的斑点叶点霉的抑菌试验结果表明,多菌灵的抑制效果要优于百菌清和代森锰锌。上述研究仅测定了药剂对菌丝生长的毒力,未测定药剂对病菌孢子萌发及产孢量的影响,无法评估药剂对病菌生长的全面效应。为了筛选防治牡丹黄斑病的化学药剂,并进一步评估苯并咪唑类和三唑类药剂对病菌孢子萌发和产孢量的影响,本研究测定了苯并咪唑类、三唑类及甲氧基丙烯酸酯类3类7种药剂对病菌的毒力,评估药剂对病菌生长发育的形态毒理学效应,分析其应用方法,为生产中牡丹黄斑病的化学防治提供理论依据。
1 材料与方法
1.1供试材料
1.1.1 供试菌株 2013年8月在洛阳市隋唐城遗址植物园千姿牡丹园采集发病典型、仅有单个病斑的牡丹叶片,采用组织分离法分离纯化后获得纯培养;用无菌水制备孢子悬浮液,调节浓度为1×105孢子·mL-1,取0.1 mL 孢悬液涂抹于WA平板上,显微镜下挑单孢,获得单孢菌株;经形态学鉴定、并回接到牡丹叶片上进行柯赫氏法则验证,鉴定为斑点叶点霉(P.commonsii)菌株放入4 ℃冰箱保存。
1.1.2 供试药剂 97%苯醚甲环唑(Difenoconazole)原药和97.5%嘧菌酯(Azoxystrobin)原药由先正达(中国)投资有限公司生产;98%多菌灵(Carbendazim)原药为山东省双星农药厂生产;98%戊唑醇(Tebuconazole)原药、95%醚菌酯(Kresoxim-methyl)原药为广西田园生化股份有限公司生产;98%丙环唑(Propiconazole)原药和96.5%氟环唑(Epoxiconazole)原药由江苏利民化工有限公司生产。多菌灵原药预溶于0.1 mol·L-1稀盐酸中;嘧菌酯、戊唑醇和苯醚甲环唑原药预溶于甲醇中;氟环唑、丙环唑、醚菌酯预溶于丙酮中,均配置成1.0×104mg·L-1的母液,放置于4 ℃冰箱备用。
1.1.3 培养基 马铃薯蔗糖琼脂培养基(Potato sugar agar,PSA)用于菌株的分离、纯化、一般培养与保存和产孢量的测定;水琼脂培养基(Water agar,WA)用于分生孢子萌发和芽管长度等测定;磷酸二氢钾葡萄糖琼脂培养基(KH2PO4dextrose agar,KDA)用于产孢时间的测定,其成分为:KH2PO41.0 g、KNO31.0 g、KCl 0.5 g、MgSO40.5 g、淀粉0.2 g、葡萄糖0.2 g、蔗糖0.2 g、琼脂18 g、H2O 1 000 mL。
1.1.4 主要仪器 双人单面垂直净化工作台SW-CJ-2D型(经济型),苏州净化设备有限公司;生化培养箱SPX-250BSH-Ⅱ型,上海新苗医疗器械制造有限公司;立式压力蒸汽灭菌器LS-50LD型,江阴滨江医疗设备有限公司;电热恒温干燥箱SZ202-2型,浙江诸暨电热仪器厂;光学显微镜XSP-8C型,上海光学六厂;Olympus CX41光学显微镜,奥林巴斯(中国)有限公司;台式高速冷冻离心机H-1850R型,长沙湘仪离心机仪器有限公司。
1.2方法
1.2.1 不同药剂对病菌菌丝生长的影响 参考侯颖等[10]的方法。将分离纯化所得菌株在PSA培养基上25 ℃黑暗培养5 d后,用直径为5 mm的打孔器在菌落边缘打菌饼,接在含系列质量浓度药剂的PSA平板上,其中多菌灵质量浓度分别为0.25、0.5、1、2、5、10 mg·L-1,戊唑醇、氟环唑、丙环唑、苯醚甲环唑质量浓度分别为0.3125、0.625、1.25、2.5、5、10 mg·L-1,嘧菌酯、醚菌酯质量浓度分别为0.031 25、0.062 5、0.125、0.25、0.5、1 mg·L-1,对照培养基不加药,25 ℃培养10 d后,十字交叉法测量菌落直径,每个处理3次重复。计算各质量浓度处理下药剂对菌丝生长的抑制率,求出毒力回归方程及有效抑制中浓度EC50。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%
1.2.2 不同药剂对病菌分生孢子萌发的影响 参考陈雨等[11]的方法。将菌株在PSA平板上25 ℃黑暗培养10 d后,用无菌水洗下分生孢子,4层纱布过滤除去菌丝,将滤液在5 000 r·min-1下离心10 min,去除上清液,将分生孢子重悬于无菌水中,调节孢子浓度至106个·mL-1,制备孢子悬液。取0.1 mL孢子悬液分别涂布在含0、0.1、1、5、10、50、100 mg·L-1药剂的WA平板上(直径9 cm),25 ℃恒温培养,待对照平板孢子开始萌发后,每隔2 h每皿随机观察100个孢子,统计不同浓度下的孢子萌发率,以芽管长度超过孢子最大直径长度的一半作为萌发标准,直到对照的萌发率达到95%以上,每个处理重复3次。
1.2.3 不同药剂对病菌芽管伸长和形态的影响 参考梁彩萍等[12]的方法。按照1.2.2的方法制备孢子悬液。取0.1 mL孢子悬液分别涂布在含0、0.1、1、5、10、50、100 mg·L-1药剂的WA平板上,25 ℃黑暗培养18 h后在Olympus CX41光学显微镜下利用MD-50软件中的标尺功能测量孢子萌发后从孢子到芽管顶端的直线长度,每处理随机测50根芽管,求出芽管长度的平均值,并进行方差分析。采用同样的步骤,25 ℃黑暗培养18 h后,切取含有孢子的WA培养基块,在XSP-8C型光学显微镜下观察药剂处理后分生孢子及芽管形态,同不含药剂培养基上的做比较,并进行观察拍照。
1.2.4 不同药剂对病菌产孢结构及数量的影响 参考侯颖等[10]的方法。按照1.2.2的方法制备孢子悬液。参照多菌灵、苯醚甲环唑、嘧菌酯抑制病菌菌丝生长的有效抑制中浓度EC50,制备相应浓度的含药KDA平板,对照平板不加药。取0.1 mL孢子悬液均匀涂布在KDA平板上,置25 ℃恒温培养箱培养,24 h后每天定时用手术刀切取正方形的培养基块置载玻片上,在显微镜下观察病菌分生孢子器的分化形成情况,直至分生孢子出现。以第一次观察到分生孢子为分生孢子器的形成时间,每处理3个重复。
用血球计数板测产孢量。制备3种药剂EC50浓度的含药PSA平板,对照不加药。将病菌在PSA平板上培养5 d后,用直径5 mm的打孔器在菌落边缘打菌饼,分别接种在含药平板上,每皿接一个菌饼,25 ℃黑暗培养10 d后,用无菌水充分洗下孢子,收集孢子悬浮液,用血球计数板测量孢子液浓度并计算产孢数,按照公式求出产孢量。
产孢量=孢子液浓度×稀释倍数×收集的孢子液总体积
产孢抑制率=(对照孢子液浓度-处理孢子液浓度)/对照孢子液浓度×100%
1.2.5 数据分析 利用Excel 2003进行数据处理,利用DPS V6.5软件中的“数量型数据机值分析”计算药剂抑制菌丝生长的有效中浓度EC50,并采用LSD法进行方差分析。
2 结果与分析
2.1不同药剂对病菌菌丝生长的抑制作用
由表1可以看出,2种甲氧基丙烯酸酯类杀菌剂对病菌菌丝生长均表现出很强的抑制作用,而以嘧菌酯的抑制作用最强,醚菌酯稍弱。4种三唑类杀菌剂对病菌菌丝生长的毒力有所差异。其中,苯醚甲环唑对菌丝生长的抑制作用最强,最弱的为丙环唑。多菌灵对病菌的毒力居于中等水平。说明甲氧基丙烯酸酯类杀菌剂可以作为牡丹黄斑病化学防治的备选药剂,而三唑类及苯并咪唑类,应根据其对病菌的毒力差异,选择合适的杀菌剂品种。依据7种杀菌剂对病菌菌丝生长的毒力,后续试验选取每类药剂中毒力最大的药剂(EC50最小)即多菌灵、苯醚甲环唑和嘧菌酯,进行对孢子萌发、芽管伸长及形态和产孢量影响的研究,进一步评估3类药剂对病菌生长发育的全面效应。
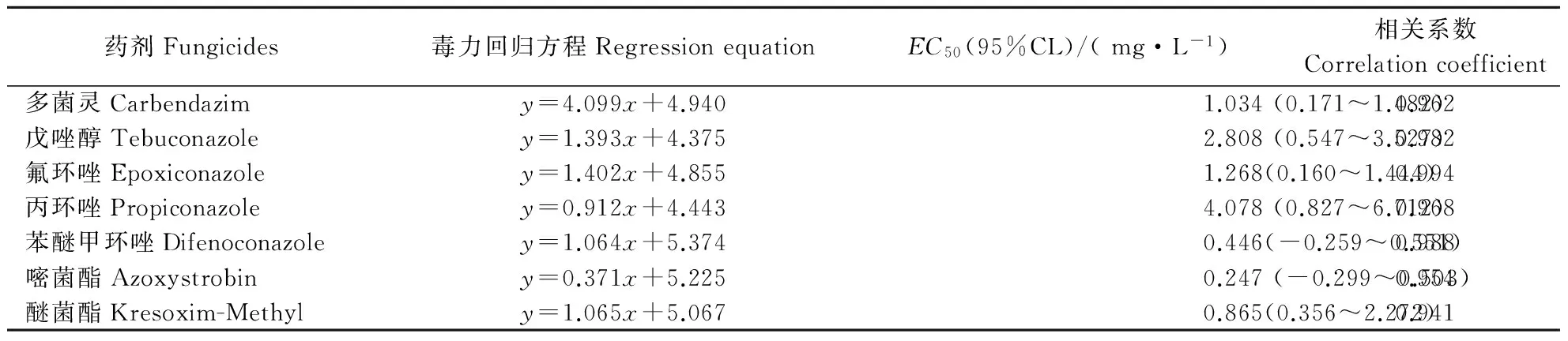
表1 7种药剂对牡丹黄斑病菌菌丝生长的毒力Table 1 Toxicity of seven fungicides to mycelial growth of P.commonsii
2.2不同药剂对病菌分生孢子萌发速率的影响
在不含药剂的WA平板上,病菌分生孢子在25 ℃培养14 h后,萌发率达到95%左右。在含有多菌灵0.1~5 mg·L-1的平板上,培养6 h后,药剂处理平板上孢子萌发率比对照高,表现出轻微的促进作用,当浓度高于10 mg·L-1时,孢子萌发受到显著抑制,且推迟了孢子萌发的时间,6 h后孢子才开始萌发;苯醚甲环唑在供试浓度下对分生孢子萌发的抑制作用较弱,14 h后,在100 mg·L-1的含药平板上萌发率依然达到60%左右;嘧菌酯对孢子萌发的抑制作用随药剂浓度的升高而增强,当浓度高于5 mg·L-1时,分生孢子的萌发率显著下降,此外,嘧菌酯还导致孢子萌发时间推迟,在5 mg·L-1以上浓度时,6 h后才开始有少量孢子萌发(图1)。由表2可知,嘧菌酯对病菌分生孢子萌发的毒力最强,其次为多菌灵,苯醚甲环唑较差。
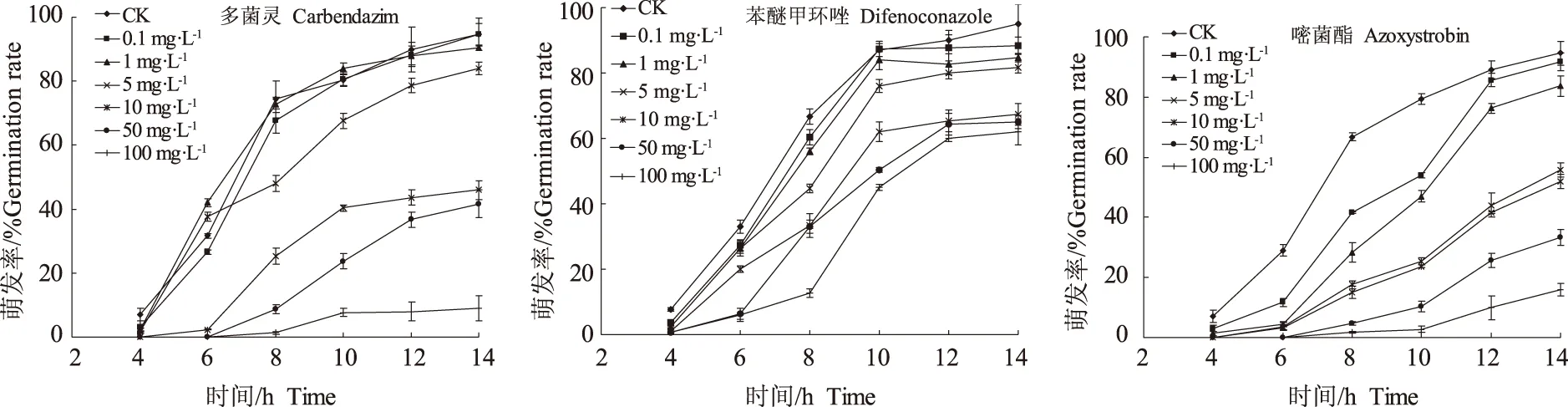
图1 药剂对牡丹黄斑病病菌分生孢子萌发速率的影响Fig.1 Effects of fungicides on the conidia germination rate of P.commonsii
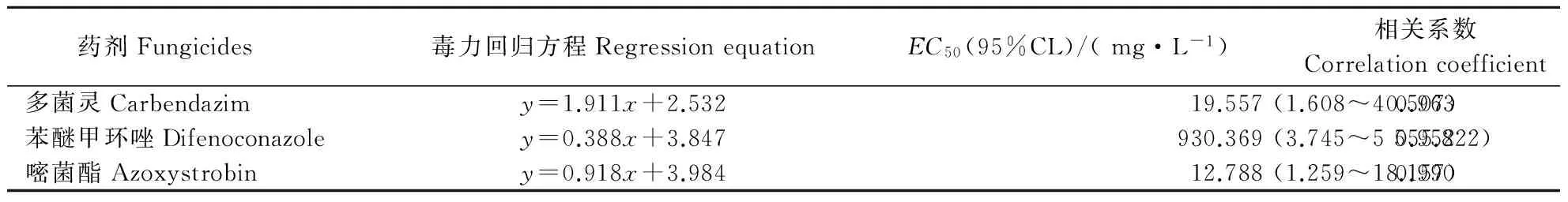
表2 孢子萌发14 h后药剂对牡丹黄斑病菌分生孢子萌发的毒力Table 2 Toxicity to conidia germination of P.commonsii treated with fungicides for 14 h
2.3不同药剂对病菌芽管伸长和形态的影响
由表3可以看出,在不含药剂的WA上,孢子萌发18 h后芽管长度达到10 μm左右。3种药剂均对芽管伸长有强烈的抑制作用,0.1 mg·L-1时的芽管长度同对照相比已差异显著;随着药剂浓度升高,尽管分生孢子能够萌发,但芽管伸长生长受到的抑制作用越加明显。嘧菌酯对芽管伸长的抑制作用最为强烈,在0.1 mg·L-1时芽管长度已不到对照芽管长度的二分之一;苯醚甲环唑次之,1 mg·L-1时的芽管长度为3.129 μm,同对照相比差异显著;而多菌灵抑制作用最弱,1 mg·L-1时的芽管长度仍较对照芽管长度的二分之一长。3种药剂在5 mg·L-1以上时,分生孢子尽管能够萌发,但芽管长度仅在0.829~1.576 μm,已不再伸长,说明芽管已失去了正常的生物学功能。3种药剂不但对孢子萌发有影响,对已萌发的芽管伸长也有抑制作用。
分生孢子萌发18 h后观察发现,在不含药剂的WA平板上,分生孢子可从一端或两端萌发长出芽管,芽管基部细胞膨大,能正常生长,很快产生隔膜并发生分枝形成菌丝(图2-a)。3种药剂在质量浓度分别为0.1、1 mg·L-1时,孢子萌发的芽管形态正常,同对照相比,芽管长度较短,尽管有隔膜,但基本不发生分枝(图2-b、c、h、i、n、o);随着质量浓度升高,药剂对分生孢子的致畸作用不太明显,但对芽管却表现出明显的致畸效应。多菌灵的致畸作用最为明显,5 mg·L-1时产生的芽管膨大呈念珠状(图2-d);质量浓度越高,孢子及芽管膨大越明显,且芽管不再形成隔膜(图2-e、f);100 mg·L-1时,尽管分生孢子仍能够萌发,但其芽管已不再生长(图2-g)。苯醚甲环唑和嘧菌酯在5、10 mg·L-1时,萌发的芽管细胞发生不规则膨大,不产生隔膜也不发生分枝,类似于蝌蚪状(图2-j、k、p、q);而在50和100 mg·L-1时,孢子萌发产生的单细胞芽管已不再伸长,类似于出芽繁殖的酵母(图2-l、m、r、s)。
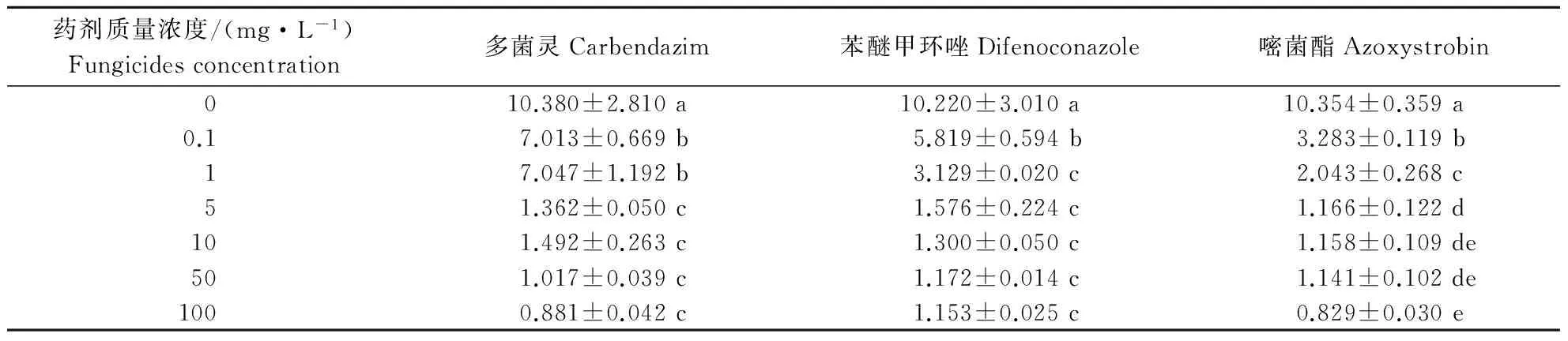
表3 不同质量浓度药剂处理牡丹黄斑病病菌分生孢子18 h后的芽管长度Table 3 Germ tube length of P.commonsii treated with fungicides at different concentrations for 18 h μm
注:表中数据为平均数±标准差。同列数据后不同字母表示经LSD方法检验在P<0.05水平差异显著。
Notes: Data are mean±SD. Different letters in the same column indicate significant difference atP<0.05 level by LSD method test.
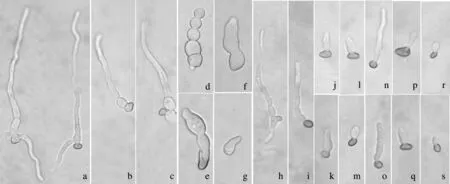
a (×200): CK; b~g (×400): 0.1、1、5、10、50、100 mg·L-1多菌灵; h~m (×400): 0.1、1、5、10、50、100 mg·L-1苯醚甲环唑; n~s(×400): 0.1、1、5、10、50、100 mg·L-1嘧菌酯。
a(×200):CK. b~g (×400): 0.1,1,5,10,50,100 mg·L-1carbendazim respectively. h~m (×400): 0.1,1,5,10,50,100 mg·L-1difenoconazole respectively. n~s (×400): 0.1,1,5,10,50,100 mg·L-1azoxystrobin respectively.
图2不同浓度药剂处理18h后牡丹黄斑病病菌分生孢子及芽管形态
Fig.2AbnormalityofconidiaandtheirgermtubesofP.commonsiitreatedwithdifferentconcentrationsofcarbendazim,difenoconazoleandazoxystrobinfor18h
2.4不同药剂对病菌产孢结构和数量的影响
在不含药剂的KDA平板上,25 ℃恒温培养48 h后已出现分生孢子器,体积较小,颜色较浅,黄褐色,圆形、椭圆形或不规则形,质地较稀疏;而含药平板均未形成产孢结构。继续培养至60 h,对照平板上的分生孢子器较大,深褐色,较密;含嘧菌酯的KDA平板上,出现分生孢子器,但体积小,颜色尚浅,稀疏。含多菌灵和苯醚甲环唑的KDA平板上,24~60 h的芽管长度及形态几乎不发生变化,芽管较短,不能形成产孢结构。说明多菌灵和苯醚甲环唑对产孢结构形成有强烈的抑制作用,而嘧菌酯的抑制作用则相对较弱。
由图3可知,在不含药剂的PSA平板上,25 ℃恒温培养10 d后,牡丹黄斑病菌能大量产孢。在含药平板上,苯醚甲环唑能强烈抑制牡丹黄斑病菌产孢,在EC50浓度时,病菌已不能产孢,抑制率达到100%;在含多菌灵和嘧菌酯的含药平板上,产孢抑制率分别为81.29%和52.32%,说明嘧菌酯对产孢的抑制作用较苯醚甲环唑和多菌灵弱。

C:多菌灵;D:苯醚甲环唑;A:嘧菌酯。 C:Carbendazim;D:Difenoconazole;A: Azoxystrobin.
3 结论与讨论
本研究结果显示,多菌灵、苯醚甲环唑和嘧菌酯3种杀菌剂在供试质量浓度下对牡丹黄斑病菌主要表现为抑菌作用,抑制菌丝生长,降低分生孢子萌发速率,并使分生孢子及芽管畸形,进而降低病菌侵染寄主及在寄主上产孢的能力,有望应用到牡丹黄斑病的化学防治上。但根据其不同的形态毒理学效应,需采用不同的施用方法。嘧菌酯可作为保护剂在病害发生前期喷施,抑制孢子萌发和芽管伸长以降低病菌的侵染率,预防病害发生;由于其对产孢抑制作用较弱,在病害发生期使用时应尽可能提前。苯醚甲环唑可作为治疗剂在病害发生期使用,通过抑制病菌菌丝生长和产孢来抑制病菌的再侵染;但由于其对孢子萌发影响较弱,不建议病害发生前期使用。多菌灵对菌丝生长、孢子萌发及产孢的抑制作用均居于前两者之间,可在病害发生前同嘧菌酯或病害发生期同苯醚甲环唑混用或复配,以防止抗药性的产生。
为了排除制剂中助剂成分对病原菌生长的影响,在进行杀菌剂的室内毒力测定时应尽量使用原药。本研究中多菌灵和苯醚甲环唑对病菌的毒力分别为1.034、0.446 mg·L-1,毒力明显比张格杰等[7]和贺春玲等[8]的研究结果小。张格杰等[7]的研究表明,10%的苯醚甲环唑水分散粒剂对病菌的室内毒力为2.018 5 mg·L-1;贺春玲等[8]的研究表明,50%多菌灵可湿性粉剂对病菌的室内毒力为3.597 3 mg·L-1。上述2个研究所用药剂均为制剂,分别含有相当量(50%以上)的助剂成分,由于助剂对病菌生长的影响未知,故无法排除助剂对试验结果的影响;本研究使用的是98%多菌灵和97%苯醚甲环唑原药,更能精确反映药剂对病菌的室内毒力。另外,来源于不同地域的菌株对药剂的敏感性也可能存在差异。
在生长季节后期(秋季)的牡丹园中,除了多发性的黑斑病、红斑病和黄斑病外,其它叶部病害如腔孢叶斑病菌、柱枝孢叶斑病等也时有发生[13-14]。故对牡丹叶斑病的防治应通过药剂复配来达到兼治多种病害的目的。同时,由于牡丹是园林植物,栽培管理较为精细,在进行病害治理时应注意多种方法的综合运用,如通过遮光来提高牡丹生长势;秋末彻底清除病残体,集中烧毁,减少来年侵染源[15]。但在病害暴发流行时,仍然需要依靠化学农药进行快速及时的控制。
[1] 蓝保卿,李嘉钰,段全绪. 中国牡丹全书(上) [M]. 北京:中国科学技术出版社,2002: 269-277.
[2] 杨德翠, 刘超, 盖树鹏, 等. 牡丹柱枝孢叶斑病(Cylindrocladiumcanadense)对叶片光合系统功能的影响 [J]. 园艺学报, 2013, 40(3): 515-522.
[3] 杨德翠,郑国生. 柱枝孢叶斑病侵染对牡丹生理特性的影响 [J]. 北方园艺, 2014, 38(1): 57-61.
[4] 段亚冰. 牡丹叶斑病病原真菌鉴定及生物学特性研究 [D]. 洛阳: 河南科技大学,2009.
[5] 杨瑞先,王祖华,叶文雨. 洛阳牡丹、芍药4种真菌性病害鉴定 [J]. 亚热带农业研究,2010,6(2): 102-105.
[6] 张运兴, 李卫国. 我国牡丹研究核心期刊载文分析 [J]. 北方园艺, 2014, 38(19): 213-215.
[7] 张格杰,何建清. 大花黄牡丹叶斑病病原鉴定及防治药剂筛选 [J]. 北方园艺, 2014, 38(18): 132-135.
[8] 贺春玲,侯小改,何童童,等. 12种杀菌剂对牡丹黄斑病的室内毒力测定 [J]. 中国农学通报, 2015, 31(19):122-125.
[9] 张国辉,张西平,贺定翔. 贵州省黔东南州太子参斑点病的调查及防治 [J]. 安徽农业科学, 2011, 39(7): 3993-3994.
[10] 侯颖, 徐建强, 宋宇州, 等. 三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响 [J]. 植物保护学报, 2014, 41(3): 367-372.
[11] 陈雨, 张文芝, 周明国. 氰烯菌酯对禾谷镰孢菌分生孢子萌发及菌丝生长的影响 [J]. 农药学学报, 2007, 9(3): 235-239.
[12] 梁彩萍,张国珍,李重九. 紫草色素对番茄叶霉病菌的室内抑菌活性研究 [J]. 农药学学报, 2004, 6(3): 48-52.
[13] 赵新兰,李 宁,刘爱新,等. 牡丹腔孢叶斑病及其病原物的共无性型 [J]. 菌物学报, 2010, 29(4): 475-480.
[14] 徐建强,杨改凤,田娟,等. 牡丹柱枝孢叶斑病化学防治药剂筛选的研究 [J]. 北方园艺,2015, 39(15): 114-117.
[15] 吴玉柱,季延平,刘慇,等. 牡丹红斑病的研究 [J]. 林业科学研究,2005, 18(6): 711-716.
(责任编辑:蒋国良)
EffectsofsevenfungicidesongrowthanddevelopmentofPhyllostictacommonsiicausingyellowleafspotofPaeoniasuffruticosa
XU Jianqiang, YANG Gaifeng, TIAN Juan, HU Jiangong, LI Huikai, LIN Xiaomin
(College of Forestry, Henan University of Science and Technology, Luoyang 471003, China)
In order to screen fungicides to control the peony yellow leaf spot infected byPhyllostictacommonsii, the inhibitory activity of seven fungicdies against mycelial growth was determined through a discriminatory dose test; the efficacy of carbendazim, difenoconazole and azoxystrobin on conidial germination and sporulation was measured on the petri dish containing culture medium amended with a test fungicide at various concentrations. The rusults showed that strobilurin fungicides, including azoxystrobin and kresoxim-Methyl, could strongly inhibit the mycelial growth with the EC50value of 0.247 and 0.865 mg·L-1respectively. Azoxystrobin had the strongest inhibitory activity on germination rate, but it had less effect on conidia yields. Triazoles fungicides, including tebuconazole, epoxiconazole, propiconazole, difenoconazole, had different inhibitory activity on mycelia growth, with the EC50value of 2.808, 1.268, 4.078 and 0.446 mg·L-1respectively. Though difenoconazole could not strongly decrease conidial germination rate, it had powerful inhibitory activity on sporulation. Benzimidazoles fungicide, carbendazim, had the EC50value of 1.034 mg·L-1on the mycelia growth; it could also inhibit the conidia germination and sporulation to some extent. All the three kinds of fungicides could be used to control peony yellow leaf spot, however, the use method was different based on their morphological and toxicological effects. Azoxystrobin could be used as a protective fungicide before the appearance of the disease; difenoconazole could be used as a curative fungicide when the disease had become apparent and alternate and mixed use of carbendazim with the two fungicides might delay the onset of resistance.
peony yellow leaf spot; fungicides; mycelial growth; conidial germination; sporulation
S436
:A
2015-11-15
国家自然科学基金项目(31401774);公益性行业(农业)科研专项(201303023);河南科技大学大学生研究训练计划项目(2015148)
徐建强(1979-),男,河南商丘人,副教授,博士,从事杀菌剂毒理与应用方面的研究。
1000-2340(2016)02-0229-06
