壬基酚分子印迹聚合物的制备及其识别特性的研究
2016-09-26袁志华赵仲麟马斌强
孟 磊,苏 惠,韦 朋,袁志华, 赵仲麟,马斌强, 袁 超
(1.河南农业大学理学院, 河南 郑州 450002; 2. 河南农业大学机电工程学院;河南 郑州 450002)
壬基酚分子印迹聚合物的制备及其识别特性的研究
孟 磊1,苏 惠1,韦 朋1,袁志华2, 赵仲麟1,马斌强1, 袁 超1
(1.河南农业大学理学院, 河南 郑州 450002; 2. 河南农业大学机电工程学院;河南 郑州 450002)
为了分离测定环境雌激素壬基酚,本研究以壬基酚为模板分子,α-甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂制备了壬基酚印迹聚合物。采用动态和静态两种方法研究了该印迹材料对壬基酚的结合性能与分子识别特性。结果表明,印迹材料对模板分子壬基酚具有良好的特异性识别作用,经过Scatchard模型分析,壬基酚印迹聚合物上有两类不同性质的结合位点,2种结合位点的解离常数分别为1.99、32.05 mL·g-1,对壬基酚的最大表观吸附量分别为29.72、240.38 μmol·g-1。将该聚合物应用于固相萃取中,以鲤鱼~为样品的加标回收实验表明,此印迹聚合物可以对痕量壬基酚进行富集分离测定,且可重复使用。
分子印迹聚合物;壬基酚;固相萃取
壬基酚(Nonylphenol ,NP)作为非离子表面活性剂,广泛应用于造纸、纺织,橡胶塑料,洗衣粉和洗涤剂等行业,与人们的日常生活关系密切;同时壬基酚又是一种重要的环境雌激素,可以通过雌激素效应对鱼类、两栖动物及哺乳动物的生殖系统产生危害,NP毒性持久,危害潜伏时间长,其危害日益受到人们的广泛关注,因此加强对壬基酚的监测具有现实意义[1-3]。然而,待检测的含有NP的实际样品通常基质复杂,为了减少复杂基质的干扰,对实际样品的分析往往需要一个样品前处理步骤来分离富集目标分析物。但在对复杂样品基底检测时很难进行单一组分的检测,因此亟待开发出一种具有高选择性和高灵敏性的分离检测手段。分子印迹聚合物(Molecularly imprinted polymers, MIPs)是近年来发展的一类具有专一识别、吸附目标分子的新型高分子材料,适用于复杂样品的前处理。样品前处理对于样品检测有着非常重要的意义,而传统的液液萃取,加速溶剂萃取[4-7]等方法不仅操作复杂,有机溶剂消耗大,而且有时很难将检测物质从复杂的样品环境中分离出来,而分子印迹固相萃取技术克服了传统方法的缺陷,简化了前处理的过程,减少了有机溶剂的消耗[8-10]。本研究以壬基酚为模板分子,α-甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂制备了壬基酚印迹聚合物。并深入考察了该印迹聚合物对壬基酚的特异性结合性能,并将该印迹聚合物装填成固相萃取柱,对实际样品进行了富集、分离和测定,取得了良好的效果。为环境监测部门分离测定壬基酚提供了一种可靠的方法。
1 材料与方法
1.1仪器与试剂
壬基酚(NP)、双酚A(BPA)、苯酚(Ph)、α-甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EDMA)、偶氮二异丁氰(AIBN)(以上均为阿拉丁试剂)、甲苯(AR)、甲醇(AR)、冰醋酸、乙醇(AR)、超纯水。
SHZ-82型水浴恒温振荡器(金坛市医疗仪器厂)、SB-120DT型超声仪(宁波新芝生物科技股份有限公司)、H-1650型离心机(湖南湘仪实验室仪器开发有限公司)、NEXUS-670型傅里叶变换红外光谱(FTIR)仪(Thermo Nicolet公司)、 JSM-7500F型扫描电子显微镜(SEM)(日本JEOL公司)、TU-1901型双光束紫外可见分光光度仪(北京普析通用仪器有限责任公司)、Waters2695高效液相色谱仪(Waters公司)。
1.2壬基酚分子印迹聚合物的制备
将220.35 mg壬基酚、240 mg α-甲基丙烯酸和10 mL乙醇加入100 mL带塞锥形瓶,在25 ℃恒温水浴振荡器中振荡4 h。再加入1.5 mL乙二醇二甲基丙烯酸酯和55mg偶氮二异丁腈,超声处理20 min。放入60 ℃水浴中聚合24 h,得白色固体状聚合物。用200 mL体积比为1∶9的冰醋酸-甲醇混合溶液索氏提取48h后,用甲醇洗涤24 h,除去冰醋酸。放干燥箱内干燥24 h,得白色壬基酚分子印迹聚合物MIPs。
按此方法不加印迹分子壬基酚制得空白聚合物NIPs。
1.3壬基酚分子印迹聚合物结合性能实验
1.3.1 平衡吸附 分别准确称取壬基酚MIPs和NIPs各35 mg,置于100 mL碘量瓶中,分别加入25 mL10~375 mg·L-1不同质量浓度的壬基酚-乙醇溶液,混合超声5min后于25 ℃恒温水浴振荡器中震荡12 h,取上层清液过滤后用紫外分光光度法在278 nm处测定壬基酚的浓度,计算吸附量Q:
Q= (c0-cs)V/m
(1)
式中:c0为壬基酚初始浓度,mmol·L-1;cs为静态吸附后溶液中壬基酚浓度,(mmol·L-1);V为壬基酚溶液体积,mL;m为聚合物质量,g。
1.3.2 吸附动力学实验 分别准确称取壬基酚MIPs和NIPs各35 mg,置于100 mL碘量瓶中,分别加入25 mL 65 mg·L-1的壬基酚-乙醇溶液,混合超声5 min后于25 ℃恒温水浴振荡器中震荡4 h,期间每隔1 h取上层清过滤后用紫外分光光度法在278 nm处测定壬基酚的浓度,计算不同时间段内MIPs和NIPs对模板分子壬基酚的吸附量,以吸附量Q对时间t作图,得到吸附动力学曲线。
1.3.3 吸附的选择性 为考察印迹聚合物的选择性,以双酚A、苯酚与壬基酚为研究对象。它们都具有酚羟基结构,分子形状和大小相似,同属环境雌激素,故以双酚A,苯酚为底物竞争吸附物质进行吸附实验,考察印迹聚合物是否具有专一吸附性。
称取3份印迹聚合物各35 mg,加入配好的0.1 mmol·L-1,的壬基酚、苯酚和双酚A的甲醇溶液中,超声混合后置于25 ℃恒温水浴振荡器中震荡,12 h后用紫外分光度法测定吸收后溶液中壬基酚、双酚A和苯酚的浓度。计算印迹聚合物对3种物质的吸附量。
对于非印迹材料做法同上。
1.3.4 分子印迹-固相萃取柱的制备 准确称取100 mg制备的MIPs和NIPs分别填充于聚丙烯固相萃取空柱,一端事先放一聚乙烯筛板,压紧聚合物并使表面平齐后加入另一筛板压实。装好的柱子用2倍体积的洗脱液(冰醋酸-甲醇体积比为1∶9)洗去模板分子,再用甲醇洗脱除去洗脱液后烘干备用。
1.3.5 样品处理
1.3.5.1 标准曲线 准确称取250 mg壬基酚于25 mL容量瓶,用甲醇定容。配制成0.1~5 mg·L-1系列质量浓度的NP溶液,采用HPLC进行分析,以峰面积对含量计算回归曲线。
1.3.5.2 样品处理 将新鲜鲤鱼腮和鱼肉分别置于料理机中绞碎成鱼泥。取10 mL甲醇于10 g鱼泥中超声振荡20 min,再以3 000 r·min-1离心10 min,取上层清液,待净化。
移取样品提取液加入已活化的固相萃取小柱中,使其缓慢通过小柱;最后用10 mL甲醇分3次洗脱吸附在固相萃取小柱上的待测物,收集洗脱液。洗脱液于常温下于通风橱挥干,用1 mL无水乙醇溶解洗涤残留物,转移至10 mL棕色容量瓶并用无水乙醇定容,供HPLC分析。
2 结果与分析
2.1印迹材料的表征
图1为MIPs的扫描电镜图。从图1可以看出,聚合物的粒度均一,为单分散的分子印迹微球。图2为MIPs和NIPs的FTIR谱图。由图2可以看出,MIPs的主要红外吸收峰分别在3 435.93 、2 988.14、2 359.61、1 727.06、1 637.52、1 398.13 cm-1处。

图1 MIPs 的电镜图 Fig.1 Scanning electron micrograph of molecular imprinted polymermicrospheres
NIPs的主要红外吸收峰分别在3 442.74、2 990.65、2 361.27、1 727.85、1 639.28、1 399.13 cm-1处。

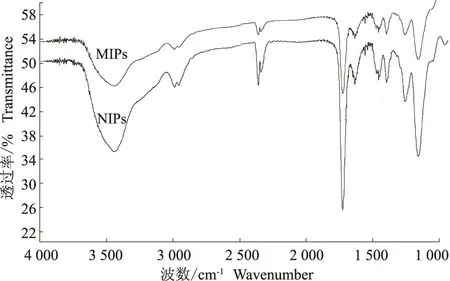
图2 MIPs和NIPs的红外谱图Fig.2 FT-IR spectra of MIPs and NIPs
2.2平衡吸附实验及Scatchard分析
采用静态平衡吸附法来考察分子印迹聚合物对壬基酚的吸附能力。由图3可知随着壬基酚浓度的不断增大,MIPs和NIPs对壬基酚的吸附量都增加,但MIPs的吸附量明显高于NIPs,而且NIPs的吸附量增加的趋势相对于MIPs也较缓慢,两者的吸附效果具有明显差异,说明MIPs对模板分子的亲和能力较强,具有更高的吸附容量。
Scatchard一直是分析分子印迹聚合物吸附性能的经典方法,其方程可表示为:
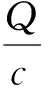
(2)
式中:Qmax为最大表观吸附量μmol·g-1,Kd为印迹聚合物的平衡解离常数mL·g-1,Q为平衡吸附量μmol·g-1,c为吸附后模板分子的平衡浓度(mmol·L-1)。
它是通过将竞争结合曲线转换成直线,从而得到印迹聚合物对模板分子结合位点的个数以及聚合物的最大表观结合量。图4是根据Scatchard模型对MIPs的结合特性分析得到的。从图4可以看出,Scatchard分析图有2个明显不同的曲线,对这2段线性部分进行拟合得方程分别为y=-0.501 1x+ 14.892 0和y=-0.031 2x+ 7.499 7,(其中,x为质量浓度,y为表观吸附量)这说明MIPs对壬基酚的吸附存在2类不同的结合位点,其中高亲和性结合位点的解离常数和最大表观吸附量为29.72 mL·g-1和240.377 5μmol·g-1,低亲和性结合位点的解离常数和最大表观吸附量为1.99 mL·g-1和32.05μmol·g-1。
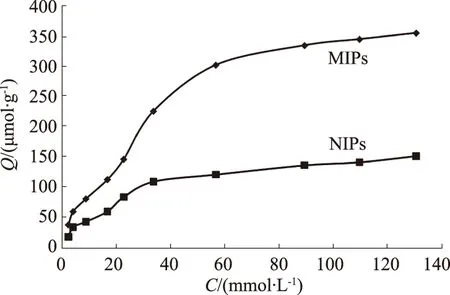
图3 MIPs和NIPs的吸附等温线Fig.3 Adsorption isotherms of MIPs and NIPs adsorbing NP
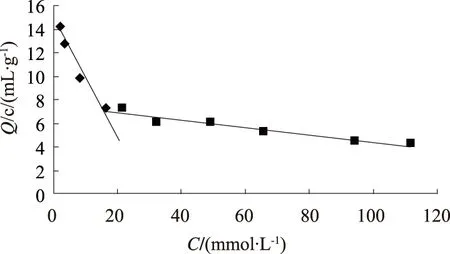
图4 MIPs的Scatchard曲线Fig.4 Scatchard’s polt for MIPs
2.3吸附动力学
如图5所示,随着吸附时间的延长,MIPs和NIPs对壬基酚的吸附量逐渐增加。对MIPs来说,吸附6 h后达87.48%,此后吸附量几乎达到饱和。由此可推测,聚合物中带有识别位点且能与模板分子相互匹配的三维空穴大都存在于聚合物的表面,且形成的空穴体积较大。因此可以快速地吸附目标化合物。而且可以观察到MIPs的吸附量远大于NIPs,说明在MIPs中形成了有效识别壬基酚的特异性结合位点,实现了对壬基酚的特异性吸附。
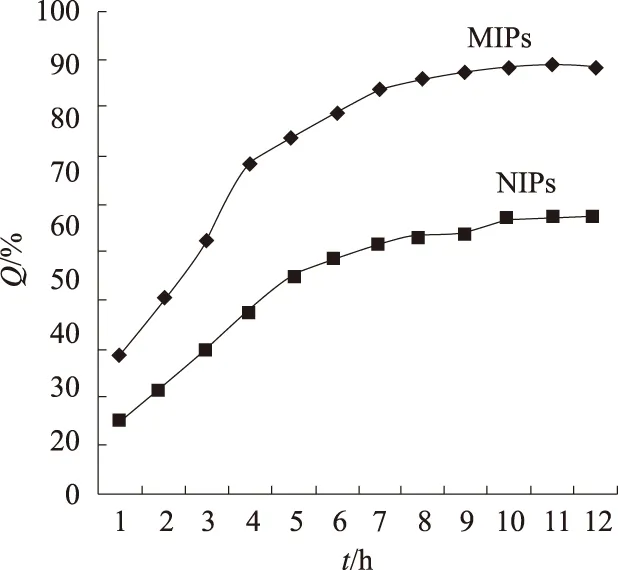
图5 MIPs和NIPs的吸附吸附动力学曲线Fig.5 Adsorption kinetics curve of MIPs and NIPs
2.4吸附选择性
图6是MIPs和NIPs在相同时间范围内对三种化合物的吸附量比较,可以看出NIPs对3种物质的吸附量都小于MIPs,但都对壬基酚的吸附量是最大的,对BPA,Ph的吸附要差一些。这是因为在制备印迹聚合物时是以壬基酚为模板的,当除去模板分子后形成的空穴和识别位点都是与壬基酚相匹配的,所以能快速吸附目标分子。而对于壬基酚结构类似的物质,虽然也存在相似的识别位点,但空穴的影响也是一个重要因素,因此印迹聚合物只能部分识别BPA和Ph,这也说明了所制备的印迹聚合物具有较好的专一吸附能力。
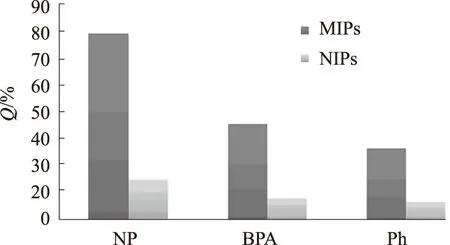
图6 BPA、NP、Ph在MIPs和NIPs上的相对吸附量Fig.6 Relative binding isotherms of BPA,NP and Ph on MIPs and NIPs
2.5实际样品分析
为检验已制备的印迹聚合物-固相萃取柱的实际应用性能,用高效液相色谱法在流动相V(甲醇)∶V(水)=75∶25,检测波长为278 nm,流速:1.0 mL·min-1条件下采用加标回收法测定了鲤鱼中的壬基酚含量,每个样品分别测定3次。均未测出NP,测定结果如表1所示,回收率在93.50%~108.00%之间,相对标准偏差为1.5%~3.1%,说明了MIPs聚合物富集分离鲤鱼中的壬基酚的可行性,而且该固相萃取柱经处理后重复使用10次,回收率并未明显降低,证明所制备的聚合物比较稳定,再生性能较好,可以重复使用。

表1 鲤鱼中壬基酚含量和回收率Table 1 Contents and recoveries of nonylphenol A in carp
注:-表示未检出。Note:-Not detected.
3 结论
为了分离测定环境雌激素壬基酚,本研究采用以NP为模板分子,MAA 为功能单体, EDMA为交联剂,AIBN 为引发剂,甲苯为溶剂,沉淀聚合法合成了MIPs。通过静态、动态和吸附选择性实验考察了该聚合物对壬基酚具有特异性强,吸附性好等特点。经过Scatchard模型分析,壬基酚印迹聚合物上有2类不同性质的结合位点,2种结合位点的解离常数分别为1.99、32.05 mL·g-1,对壬基酚的最大表观吸附量分别为29.72、240.38 μmol·g-1。并将该聚合物制成固相萃取柱对鲤鱼中的壬基酚进行了富集、分离和测定,回收率在93.50%~108.00%之间,而且该固相萃取柱重复使用10次后回收率并未明显降低,表明所制备的聚合物比较稳定,再生性能好,可以重复使用,可作为新型固相萃取填料对壬基酚进行分离、富集和测定,为环境监测部门提供了一种可行的方法。
[1] GYLLENHAMMAR I,GLYNN A,DARNERUD P O,et al. 4-Nonylphenol and bisphenol A in Swedish food and exposure in Swedish nursing women[J]. Environment International,2012, 43:21-28.
[2] QIAN H F,PAN X J,SHI S T,et al. Effect of nonylphenol on response of physiology and photosynthesis-related gene transcription of chlorella vulgaris[J]. Environmental Monitoring and Assessment,2011,182:61-69.
[3] 韦寿莲,刘玲,黎京华,等. 双分子印迹聚合物微球选择固相萃取环境和食品中壬基酚和双酚A[J].分析化学, 2015,43(1):105-109
[4] LI C L,JI R,SCHAFFER A,et al. Sorption of a branched nonylphenol and perfluorooctanoic acid on Yangtze River sediments and their model components[J]. J Environ Monit, 2012,14(10):2653-2658.
[5] ASIMAKOPOULOS A G,THOMAIDIS N S,KOUPPARIS M A. Recent trends in biomonitoring of bisphenol A,4-t-octylphenol and 4-nonylphenol[J]. Toxicology Letters,2012,210(2):141-154.
[6] YU P L,LIN H W,WANG S W,et al. Effects of nonylphenol on the production of progesterone on the rats granulosa cells [J]. Journal of Cellular Biochemistry,2012,112(9):2627-2636.[7] YING F,DING C,GE R,et al. Comparative evaluation of nonylphenol isomers on steroidogenesis of rat Leydig Cells [J]. Toxicology in Vitro,2012,26(7):1114-1121.
[8] ROBERTSON L S,MCCORMICK S D. The effect of nonylphenol on gene expression in Atlantic salmon smolts [J]. Aquatic Toxicology,2012,122:36-43.
[9] SALGUEIRO G N, CONCHA G E, TURNES C I,et al. Determination of alkylphenols and bisphenol in seawater samples by dispersive liquid-liquid microextraction and liquid chromatography tandem mass spectrometry for compliance with environmental quality standards [J].J Chromatogr A, 2012,122:1-8.
[10] SHAO B, HAN H,LI D M, et al. Analysis of alkylphenol and bisphenol A in meat by accelerated solvent extraction and liquid chromatography with tandem mass spectrometry [J]. Food Chem,2007,105(3):1236-1241.
(责任编辑:蒋国良)
Studyonpreparationofnonylphenolmolecularimprintedpolymersanditsrecognitioncharacter
MENG Lei1, SU Hui1, WEI Peng1, YUAN Zhihua2, ZHAO Zhonglin1, MA Binqiang1, YUAN Chao1
(1.College of Sciences, Henan Agricultural University, Zhengzhou 450002, China; 2. College of Mechanical and Electrical Engineering, Henan Agricultural University, Zhengzhou 450002,China)
The molecularly imprinted polymers (MIPs) were prepared by using nonylphenol (NP) as template,α-methylacrylic acid as functional monomer,ethylene glycol dimethyl acrylate as the crosslinking agent, azobisisobutyronitrile as initiator, and toluene as solvent. Then the static and dynamic experiment results showed that MIPs had specific recognition selectivity and excellent binding selectivity for the template molecule. Scatchard analysis indicated that the nonylphenol imprinted polyer had two kinds of recognitionsites, the dissociation constant being 1.99 and 32.05 mL·g-1, the apparent maximum absorption capacity being 29.72 and 240.38 μmol·g-1, respectively. Besides, in a recovery experiment by adding standard samples with carp, the result shows that imprinted material of NP can enrich and separate for trace amounts of NP, and it is also easy to be used repeatedly.
molecularly imprinted polymers;nonylphenol;solid-phase extraction
TS201
:A
2015-09-12
河南省教育厅科技研究重点项目(12A150012);郑州市科技攻关项目(083SGYG-24123-3)
孟 磊(1970-),女,河南郑州人,副教授,硕士,主要从事分析化学和食品安全方面的研究。
袁 超(1961-),男,河南开封人,副教授。
1000-2340(2016)02-0214-05
