毛头牛蒡子抗氧化和降血糖的有效部位筛选研究△
2016-09-25骆秀珍文娥田树革周晓英
骆秀珍,文娥,田树革,周晓英*
(1.新疆医科大学 药学院,新疆 乌鲁木齐 830011; 2.新疆医科大学 中医学院,新疆 乌鲁木齐 830011; 3.新疆医科大学 中心实验室,新疆 乌鲁木齐 830011)
·专题·
毛头牛蒡子抗氧化和降血糖的有效部位筛选研究△
骆秀珍1,文娥2,田树革3,周晓英1*
(1.新疆医科大学 药学院,新疆 乌鲁木齐 830011; 2.新疆医科大学 中医学院,新疆 乌鲁木齐 830011; 3.新疆医科大学 中心实验室,新疆 乌鲁木齐 830011)
目的:筛选出毛头牛蒡子中抗氧化和降血糖的有效部位。方法:将毛头牛蒡子粗多糖提取物经AB-8大孔树脂脱色纯化,依次采用水和20%、40%、60%乙醇水进行洗脱,以DPPH自由基清除活性、还原力的测定、羟基自由基清除活性和超氧阴离子清除活性4项指标研究不同洗脱部位的抗氧化活性,采用体外α-葡萄糖苷酶活性测定毛头牛蒡子提取物不同部位的降血糖活性。结果:毛头牛蒡子20%乙醇水洗脱部位的抗氧化活性和降血糖活性均强于其他部位。结论:毛头牛蒡子抗氧化和降血糖的活性部位应为20%乙醇水洗脱部位。
毛头牛蒡子;抗氧化;降血糖
毛头牛蒡子为菊科牛蒡属植物毛头牛蒡ArctiumtomentosumMill.的干燥成熟果实,维吾尔语名为“可热可孜乌拉盖”,在新疆分布广泛。毛头牛蒡的根和叶在维吾尔民间用于治疗风湿痛及皮肤痒痛,种子被认为是牛蒡子的伪品[1],主要用于风热感冒,咳嗽痰多,麻疹,咽喉肿痛,痄腮丹毒,痈肿疮毒[2]。有研究表明毛头牛蒡子醇提物的醋酸乙酯和正丁醇萃取部分具有一定的抗氧化活性[3],但关于毛头牛蒡子提取物不同洗脱部位的体外抗氧化和降血糖活性的研究尚未见报道,因此本文通过对毛头牛蒡子活性部位的筛选为毛头牛蒡子药理活性的研究提供理论依据。
1 仪器与试药
1.1 仪器
XS105型十万分之一电子天平(瑞士梅特勒-托利多);Spectra Max190酶标仪(美国分子仪器);紫外可见分光光度计(澳大利亚GBC科学仪器公司);TGL16B离心机(上海安亭科学仪器厂)。
1.2 试药
毛头牛蒡子采集于新疆阿勒泰地区(经新疆医科大学中医学院李永和主任药师鉴定为毛头牛蒡的干燥成熟果实);α-葡萄糖苷酶(Sigma,批号:129K1426),对-硝基苯基-α-D-吡喃葡萄糖苷(Sigma公司,批号:026K1516),阿卡波糖 (Acarbose,Sigma公司,批号:16869);DPPH(Sigma公司);其余试剂均为分析纯。
2 方法与结果
2.1 样品的制备
毛头牛蒡子粉碎后,加95%乙醇水回流提取2次,每次2 h,以除去脂溶性杂质,过滤,药渣挥干溶剂,加蒸馏水在90 ℃提取1 h,提取2次,合并提取液,浓缩,加入1/4体积的Sevag试剂[三氯甲烷-正丁醇(4∶1)的混合溶液剧烈振摇15 min,静置,除去下层蛋白质变性层,重复以上操作直到无白色絮状物产生为止。取上层多糖液加入适量乙醇使终浓度为80%进行沉淀,4 ℃下静置过夜。离心,收集沉淀,置干燥箱中干燥得粗多糖。
大孔吸附树脂用95%乙醇水浸泡24 h,湿法装柱,并用95%乙醇水流动冲洗,至流出的乙醇加水(1∶5)不产生浑浊为止,然后用大量蒸馏水洗至无醇味,待用。将毛头牛蒡子粗多糖溶于水中,上样,依次用水,20%、40%、60%乙醇水洗脱,收集洗脱液,每次用Molish反应检验有无多糖的流出,洗至无多糖流出,浓缩,冷冻干燥,备用。依次命名为a、b、c、d。
2.2 毛头牛蒡子不同洗脱部位抗氧化活性的研究
2.2.1 清除DPPH自由基能力的测定 分别吸取不同浓度(0.1~5.0 g·L-1)的样品溶液2.00 mL,加入1.5 mmol·L-1的DPPH乙醇溶液3.00 mL,摇匀,室温下置黑暗处30 min,517 nm处测定吸光度值(Vc作为阳性对照)[4-5]。按公式(1)计算清除能力,结果见表1。
清除能力S(%)=[1-(C-B)/A]×100%
(1)
式中:A—未加多糖液时溶剂的吸光度, B—多糖液的吸光度, C—加多糖液后溶液的吸光度。

表1 毛头牛蒡子粗多糖不同洗脱部位各浓度的DPPH自由基清除活性
由表1结果可以看出a~d对DPPH自由基均具有一定的清除作用,其中b的清除活性高于其他3个部位,清除率高达75.35%,且随着浓度的增高清除率也在增加,但a、b、c、d对DPPH自由基的清除活性(IC50依次为3.962,1.209,48.456,147.594 g·L-1)均低于阳性对照组Vc(IC50=0.048 g·L-1)。
2.2.2 还原力的测定 分别吸取不同浓度(0.1~5.0 g·L-1)的样品溶液1.00 mL,依次加入2.5 mL(pH=6.6,0.2 mol·L-1)磷酸盐缓冲液和5 mL 1%的铁氰化钾溶液,混匀后50 ℃保温20 min;加三氯乙酸5 mL,混匀后离心10 min(4 000 r·min-1)。取2.5 mL上清液,依次加入去离子水和氯化铁溶液,摇匀后在室温下反应10 min,700 nm处测定吸光度(Vc作为阳性对照)[6]。
由表2结果可以看出,a、b、c均具有较强的还原力,吸光度值大于0.5,在0.1~5.0 g·L-1浓度范围内具有良好的线性关系,其中b的还原能力最强,a和c还原能力接近,但明显低于阳性对照组,d洗脱部位的还原能力较弱。
2.2.3 清除羟基自由基能力的测定 分别吸取不同浓度(0.1~5.0 g·L-1)的样品溶液1.00 mL,依次加入4.5 mmol·L-1硫酸亚铁溶液、水杨酸-乙醇溶液,再加入1.00 mL H2O2启动反应,摇匀在37 ℃水浴放置0.5 h,510 nm处测定吸光度值,计算清除率,清除率公式同2.2.1(Vc作为阳性对照)[7-8]。
由表3结果可以看出,b具有显著的羟基自由基清除活性,当b的浓度为5 g·L-1时,清除率高达85.34%。a也具有一定的清除活性,但清除率低于b,其余两个洗脱部位清除活性较弱。Vc的清除活性(IC50=0.089 g·L-1)明显高于a、b、c、d(IC50依次为2.420,0.768,18.446,163.137 g·L-1)。
2.2.4 清除超氧阴离子能力 分别吸取不同质量浓度(0.1~5.0 g·L-1)的样品溶液0.50 mL,加入3.00 mL Tris-HCl缓冲液(pH = 8.2)混合,在30 ℃水浴中保温20 min,然后再加入邻苯三酚溶液,混匀后在水浴中反应5 min(25 ℃),最后加入1.00 mL浓盐酸终止反应,420 nm 处测吸光度值,清除率公式同2.2.1(Vc作为阳性对照)[9-11]。
由表4结果可以看出,a、b、c、d均具有一定的清除活性,b对超氧阴离子的清除作用最强(IC50=1.121 g·L-1),但同浓度下的清除率均远低于阳性对照组(IC50=0.089 g·L-1),a、c和d的清除作用较弱(IC50依次为5.002、15.500、11 174.731 g·L-1),当d的浓度为5 g·L-1时,清除活性仅为9.67%。
2.3 毛头牛蒡子不同洗脱部位降血糖活性的研究
根据已有方法进行改进[12-14],反应体系:测定组(Ati),112 μL磷酸钾缓冲液,加入0.2 U·mL-1α-葡萄糖苷酶溶液20 μL,8 μL的待测液,37 ℃恒温反应15 min后,加入PNPG溶液20 μL,恒温37 ℃反应15 min,反应完成之后,加入Na2CO3溶液80 μL,在波长405 nm下测定A值;空白对照组(Ab),与测定组的区别是本组不加抑制剂和α-葡萄糖苷酶;未加抑制剂测试组(At0),与测定组的区别是本组不加抑制剂;未加酶空白组(Abi),与测定组的区别是本组未加α-葡萄糖苷酶;以阿卡波糖为阳性对照。按公式(2)计算抑制率。
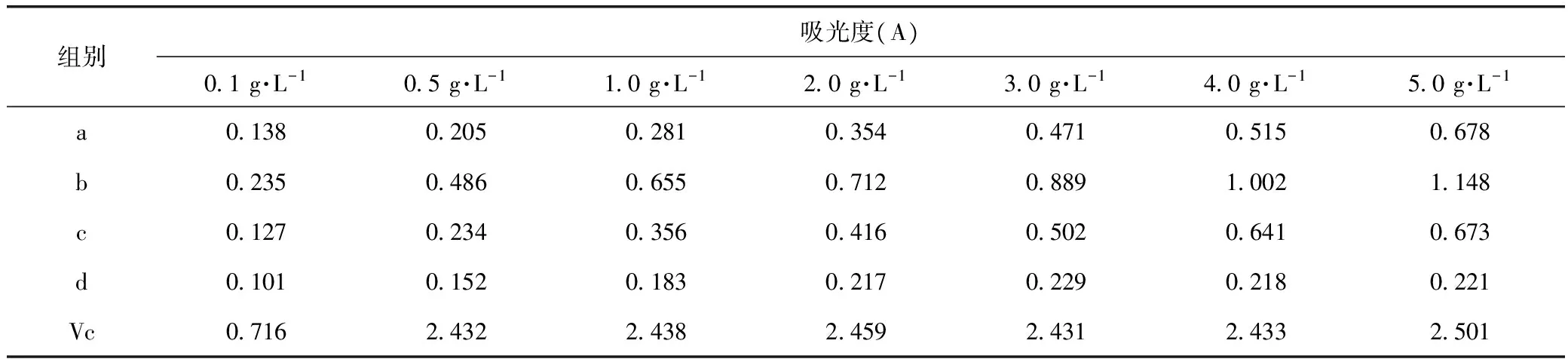
表2 毛头牛蒡子粗多糖不同洗脱部位各浓度的还原能力
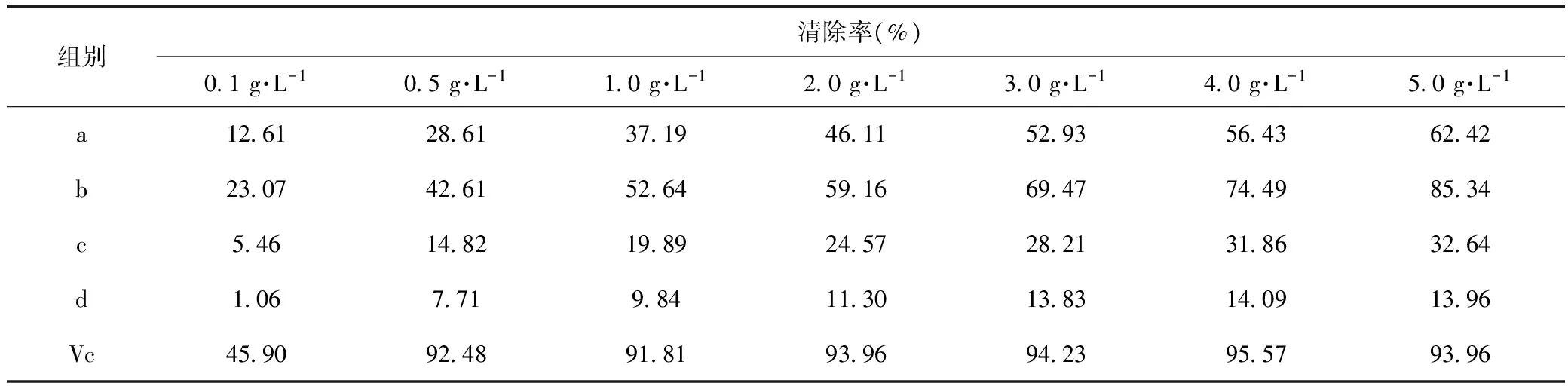
表3 毛头牛蒡子粗多糖不同洗脱部位各浓度的羟基自由基清除活性

表4 毛头牛蒡子粗多糖不同洗脱部位各浓度的超氧阴离子清除活性
抑制率(%)={(At0-Ab)-[(Ati-Ab)-(Abi-Ab)]} /(At0-Ab)×100%
(2)
由表5可以看出毛头牛蒡子不同洗脱部位除了d对α-葡萄糖苷酶无抑制作用外,a、b、c均具有较好的抑制作用,且抑制作用大于阳性对照。抑制率大小顺序为b>a>c>阿卡波糖>d。

表5 毛头牛蒡子不同洗脱部位的α-葡萄糖苷酶抑制活性
3 讨论
本实验通过研究毛头牛蒡子不同洗脱部位清除DPPH自由基活性、羟基自由基活性、超氧阴离子活性及还原力能力的测定对其中的抗氧化活性部位进行筛选,同时采用体外α-葡萄糖苷酶抑制活性对其降血糖活性进行研究,结果发现毛头牛蒡子20%乙醇水洗脱部位抗氧化及降血糖活性最强。并且通过对毛头牛蒡子不同洗脱部位化学成分的初步研究,发现20%乙醇水洗脱部位的多糖含量最高,结合相关文献[15-16]推测其抗氧化和降血糖活性可能与多糖类成分有关,具体有效成分组成及作用机制有待于进一步研究。
[1] 刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,2000:132.
[2] 贾晓光.新疆特色药用植物图谱Ⅰ[M].北京:科学出版社,2013:20.
[3] 张浩科,葛亮,田树革,等.毛头牛蒡子醇提物抗氧化活性研究[J].西北药学杂志,2010,25(5):346-348.
[4] Cheng H R,Feng S L,Jia X J,et al.Structural characterization and antioxidant activities of polysaccharides extracted fromEpimediumacuminatum[J].Carbohydr Polym,2013,92(1):63-68.
[5] Li S Q,Shah N P.Antioxidant and antibacterial activities of sulphated polysacchar-ides fromPleurotuseryngiiandStreptococcusthermophilusASCC 1275[J].Food Chem,2014,165:262-270.
[6] Kong F L,Zhang M W,Kuang R B,et al.Antioxidant activities of different fractions of polysaccharide purified from pulp tissue of litchi (LitchichinensisSonn.)[J].Carbohydr Polym,2010,81(3):612-616.
[7] Mao G H,Zou Y,Feng W W,et al.Extraction,preliminary characterization and antioxidant activity of Se-enriched Maitake polysaccharide[J].Carbohydr Polym,2014,101:213-219.
[8] Jiang Y Y,Wang L,Zhang L,et al.Optimization of extraction and antioxidant activity of polysaccharides fromSalviamiltiorrhizaBunge residue[J].Carbohydr Polym,2015,79:533-541.
[9] Ye C L,Huang Q.Extraction of polysaccharides from herbalScutellariabarbataD.Don(Ban-Zhi-Lian) and their antioxidant activity[J].Carbohydr Polym,2012,89(4):1131-1137.
[10] Liu F,Liu W H,Tian S G.Artificial neural network optimization ofAlthaearoseaseeds polysaccharides and its antioxidant activity[J].Int J of Biol Macromol,2014,70:100-107.
[11] Zhang J J,Ma Z,Zheng L,et al.Purification and antioxidant activities of intracellular zincpolysaccharides fromPleurotuscornucopiaeSS-03[J].Carbohydr Polym,2014,111:947-954.
[12] Li T,Zhang X D,Song Y W,et al.A microplate-based screening method for alpha-glucosidase inhllibiltors[J].Chin J Clin Pharmacol Ther,2005,10(10):1128-1134.
[13] 张燕,李琳琳,毛新民,等.新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响[J].中国实验方剂学杂志,2011,17(7):166-169.
[14] 肖小华,王丽华,徐丽瑛,等.栀子抑制α-葡萄糖苷酶活性成分研究[J].中国实验方剂学杂志,2013,19(8):210-212.
[15] 郭瑞华,翟丽,刘正猛,等.豆豉及其多糖对α-葡萄糖苷酶抑制作用的研究及豆豉中降糖有效成分的初步分析[J].中药材,2005,28(1):38-40.
[16] 魏秀娟,向发椿,崔明筠,等.铁苋菜多糖体外抗氧化研究[J].中国实验方剂学杂志,2013,19(3):197-200.
StudyonScreeningofEffectivePartsfromArctiumtomentosumMill.SeedsbyAntioxidantandHypoglycemicActivity
LUO Xiuzhen1,WEN E2,TIAN Shuge3,ZHOU Xiaoying1*
(1.PharmacyCollege,XinjiangMedicalUniversity,Urumqi830011,China;2.CollegeofTCM,XinjiangMedicalUniversity,Urumqi830011,China;3.CenterofLAB,XinjiangMedicalUniversity,Urumqi830011,China)
Objective:To screen the effective parts fromArctiumtomentosumMill.seeds by antioxidant and hypoglycemic activity.Methods:The extracts were purified by AB-8 macroporous resin,eluted with water and 20%,40%,60% ethanol.The antioxidant activities were examined from the aspects of reducing power,scavenging rate of DPPH,hydroxyl and superoxide anion free radicals respectively.The hypoglycemic activity was examined by α-glucosidase inhibitory activities.Results:The antioxidant activity and hypoglycemic activity in 20% ethanol elution was higher than other parts.Conclusion:The active site ofA.tomentosumseeds should belong to the 20% ethanol elution parts.
ArctiumtomentosumMill.seeds;antioxidant activity;hypoglycemic activity
10.13313/j.issn.1673-4890.2016.10.006
2016-01-15)
新疆维吾尔自治区自然科学基金 (2015211C025)
*
周晓英,教授,硕士生导师,研究方向:天然药物的质量控制与活性筛选;E-mail:zhouxiaoying4@163.com