牛蒡子中牛蒡子苷和牛蒡子苷元的微波辅助提取工艺
2013-09-04孙兆云宋吉英吕海涛
孙兆云,宋吉英,单 虎,吕海涛,*
(1.青岛农业大学化学与药学院,山东青岛266109;2.青岛农业大学动物科技学院,山东青岛266109)
牛蒡子(Fructus Arctii)为菊科二年生草本植物牛蒡(Arctium lappa L.)的干燥成熟果实。又名大力子、鼠粘子、恶实等。分布于东北、西北、中南、西南及台湾的台南等地。味辛、苦、性寒,归肺、胃经。牛蒡子的主要有效生物活性成分为牛蒡子苷和牛蒡子苷元[1],不仅具有疏散风热、宣肺透疹、消肿解毒[2]、抗癌[3]、抗病毒[4]、降血糖[5-6]等作用,而且具有神经保护[7]、抑制血小板、抗衰老[8]以及抗炎[9-10]等生理活性作用。目前,提取牛蒡子苷和牛蒡子苷元的主要方法包括传统提取方法[11]、超临界萃取法[12]、超声辅助提取法[13]、微波辅助提取法[14]以及矩阵固相分散法提取[15]。但利用微波法同时提取优化牛蒡子中牛蒡子苷和牛蒡子苷元的工艺研究尚未见报道。与常规提取方法相比,微波提取具有选择性高、快速高效、溶剂消耗少、活性成分提取率较高、适合于热不稳定物质等优点。本文利用微波辅助提取法对牛蒡子中牛蒡子苷和牛蒡子苷元的同时提取工艺进行了优化研究,为深入开发和利用牛蒡子提供理论参考。
1 材料与方法
1.1 材料与仪器
牛蒡子样品 购于山东省青岛市城阳区当地药店,已干燥至恒重;牛蒡子苷和牛蒡子苷元标准品 上海经科化学科技有限公司(纯度≥98%);无水乙醇、甲醇等 色谱纯;水 超纯水。
Aglient 1100高效液相色谱仪 美国安捷伦科技有限公司;FW-100型高速万能粉碎机 天津泰斯特仪器有限公司;SHB-III循环水式真空泵 郑州长城科工贸有限公司;DZX-1型真空干燥箱 上海福玛实验设备有限公司;CASCADA超纯水系统 Pall公司;AR2140电子分析天平 上海奥斯豪国际工贸公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;TDL-50B微波合成萃取仪 北京祥鹄科技有限公司。
1.2 实验方法
1.2.1 色谱条件选择 用紫外分光光度计在200~400nm波长范围扫描得到牛蒡子苷和牛蒡子苷元的紫外吸收光谱图,得到牛蒡子苷和牛蒡子苷元的最大吸收波长均为286nm,确定检测波长286nm。
采用Agilent Eclipse XDB-C18色谱柱(4.6mm×150mm,5μm),确定流动相组成为甲醇∶水 =40∶60(v/v),流速为 1.0mL/min,柱温为 35℃,进样量20μL,牛蒡子苷和牛蒡子苷元的吸收峰可以有效地与杂质吸收峰分离(图1)。
1.2.2 标准曲线的建立 精密称取干燥至衡重的牛蒡子苷标准品28.0mg和牛蒡子苷元标准品3.0mg,用40%甲醇定容于25mL的容量瓶中,牛蒡子苷溶液的浓度为1.12mg/mL,牛蒡子苷元溶液的浓度为0.12mg/mL。
精密量取混合标准品母液0.25、0.50、1.00、1.50、2.00、2.50、3.00、3.50mL,分别置于 5mL 容量瓶中,用40%甲醇定容,摇匀,配成一系列梯度质量浓度的混合标准溶液。经0.45μm微孔滤膜过滤后,利用高效液相色谱仪进行分离测定。
1.2.3 样品溶液的制备和牛蒡子苷、牛蒡子苷元含量的测定 将干燥至衡重的牛蒡子用万能粉碎机粉碎,过 60目筛。精密称取 1.0g牛蒡子粉,置于100mL圆底烧瓶中,加入适量乙醇后进行微波提取,提取液冷却后抽滤,用乙醇分次洗涤烧瓶及滤器,合并提取液和洗涤液,用旋转蒸发仪浓缩,浓缩物用40%甲醇溶解,移入50mL容量瓶中定容,摇匀,即得牛蒡子提取液样品。用高效液相色谱进样分离测定,用外标法进行定量计算。
1.3 微波辅助提取牛蒡子苷和牛蒡子苷元工艺优化
1.3.1 单因素实验
1.3.1.1 乙醇浓度的影响 精确称取牛蒡子粉末1.0g于100mL三口瓶中,微波功率400W,提取温度为回流温度,时间为150s,提取剂用量为30mL。提取剂分别为:蒸馏水,20%、40%、60%、80%乙醇,无水乙醇。用高效液相色谱法测出样品中牛蒡子苷和牛蒡子苷元的得率。
1.3.1.2 温度的影响 精确称取牛蒡子粉末1.0g于100mL三口瓶中,微波功率400W,提取剂为80%的乙醇 30mL,时间为 150s,提取温度为:30、40、50、60、70℃、回流。用高效液相色谱法测出样品中牛蒡子苷和牛蒡子苷元的得率。
1.3.1.3 微波功率的影响 精确称取牛蒡子粉末1.0g于 100mL三口瓶中,提取剂为80%的乙醇30mL,时间为150s,提取温度为回流温度,微波功率为 300、400、500、600、700、800、900、1000W。用高效液相色谱法测出样品中牛蒡子苷和牛蒡子苷元的得率。
1.3.1.4 提取时间的影响 精确称取牛蒡子粉末1.0g于100mL三口瓶中,提取剂为 80%的乙醇30mL,提取温度为回流温度,微波功率为400W,提取时间分别为30、60、90、120、150、250、350、500s。用高效液相色谱法测出样品中牛蒡子苷和牛蒡子苷元的得率。
1.3.1.5 料液比的影响 精确称取牛蒡子粉末1.0g于100mL三口瓶中,提取剂为80%的乙醇,提取温度为回流温度,微波功率为400W,提取时间为90s,加入乙醇的量分别为 4、8、10、20、30、40、50mL。用高效液相色谱法测出样品中牛蒡子苷和牛蒡子苷元的得率。
1.3.2 正交实验 在单因素实验的基础上,选取乙醇浓度(A)、微波功率(B)、料液比(C)、提取时间(D)、提取次数(E)作为考察因素,以样品中牛蒡子苷和牛蒡子苷元的总得率为考察指标,设计五因素四水平的正交实验(表1)。

表1 因素水平表Table 1 Factors and levels of total flavonoids
2 结果与分析
2.1 标准曲线的绘制
以质量浓度(c,mg/mL)为横坐标,峰面积(A)为纵坐标,得到牛蒡子苷和牛蒡子苷元的回归方程分别为:A=9097.2c-136.64,R2=0.9990;A=38580c-89.571,R2=0.9986。牛蒡子苷和牛蒡子苷元的检出限分别为1.1μg/L和0.6μg/L。
利用HPLC对牛蒡子中牛蒡子苷和牛蒡子苷元的分离测定色谱图见图1。
2.2 单因素实验结果
2.2.1 乙醇浓度对牛蒡子苷和牛蒡子苷元得率的影响 从图2可以看出,在实验条件下,牛蒡子苷得率与牛蒡子苷和牛蒡子苷元的总得率具有相同的变化趋势,均随乙醇浓度的增大而增大,在80%处达到最大值。在40%到80%之间,二者总体趋于稳定,变化幅度较小;对于牛蒡子苷元得率,随着乙醇浓度的增加,其值逐渐降低。由于在牛蒡子中,牛蒡子苷的含量远远高于牛蒡子苷元,故在本实验选取适宜条件时,以牛蒡子苷和牛蒡子苷元的总得率为考察指标。
2.2.2 温度对牛蒡子苷和牛蒡子苷元得率的影响 从图3可以看出,在实验条件下,牛蒡子苷得率、牛蒡子苷元得率与牛蒡子苷和牛蒡子苷元的总得率基本具有相同的变化趋势,均随温度的增大而增大,当温度在40~70℃之间时,三者趋于平稳;温度达到反应溶液的沸点时,三者的值均达到最大。本实验不再考察温度的影响,在回流条件下进行提取。
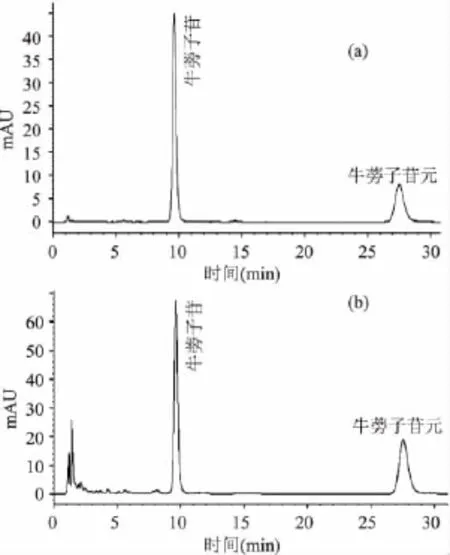
图1 牛蒡子苷和牛蒡子苷元的HPLC图Fig.1 HPLC chromatogram of arctiin and arctigenin

图2 乙醇浓度对样品中牛蒡子苷和牛蒡子苷元得率的影响Fig.2 Effect of ethanol concentration on the yields of arctiin and arctigenin

图3 温度对样品中牛蒡子苷和牛蒡子苷元得率的影响Fig.3 Effect of temperature on the yields of arctiin and arctigenin
2.2.3 微波功率对牛蒡子苷和牛蒡子苷元得率的影响 从图4可以看出,在实验条件下,牛蒡子苷得率与牛蒡子苷和牛蒡子苷元的总得率具有相同的变化趋势,其值均在功率为400W时达到最大值。牛蒡子苷元得率则在功率为800W时达到最大值。

图4 微波功率对样品中牛蒡子苷和牛蒡子苷元得率的影响Fig.4 Effect of microwave power on the yields of arctiin and arctigenin
2.2.4 提取时间对牛蒡子苷和牛蒡子苷元得率的影响 从图5可以看出,在实验条件下,牛蒡子苷得率与牛蒡子苷和牛蒡子苷元的总得率具有相同的变化趋势,其值均随实验时间延长而增大,在提取时间为90s时达到最大值。之后牛蒡子苷得率和总得率总体均有所降低,牛蒡子苷元得率则在90s后趋于稳定。

图5 提取时间对牛蒡子苷和牛蒡子苷元得率的影响Fig.5 Effect of extraction time on the yields of arctiin and arctigenin
2.2.5 料液比对牛蒡子苷和牛蒡子苷元得率的影响 从图6可以看出,在实验条件下,牛蒡子苷得率与牛蒡子苷和牛蒡子苷元的总得率具有相同的变化趋势,其值均随着料液比的增加而增大,在料液比为1∶20时达到最大值,之后牛蒡子苷得率和总得率总体均逐渐降低;牛蒡子苷元得率随料液比的增加总体呈上升趋势,也在料液比为1∶20处达到最大值。

图6 料液比对样品中牛蒡子苷和牛蒡子苷元得率的影响Fig.6 Effect of ratio of material to liquid on the yields of arctiin and arctigenin
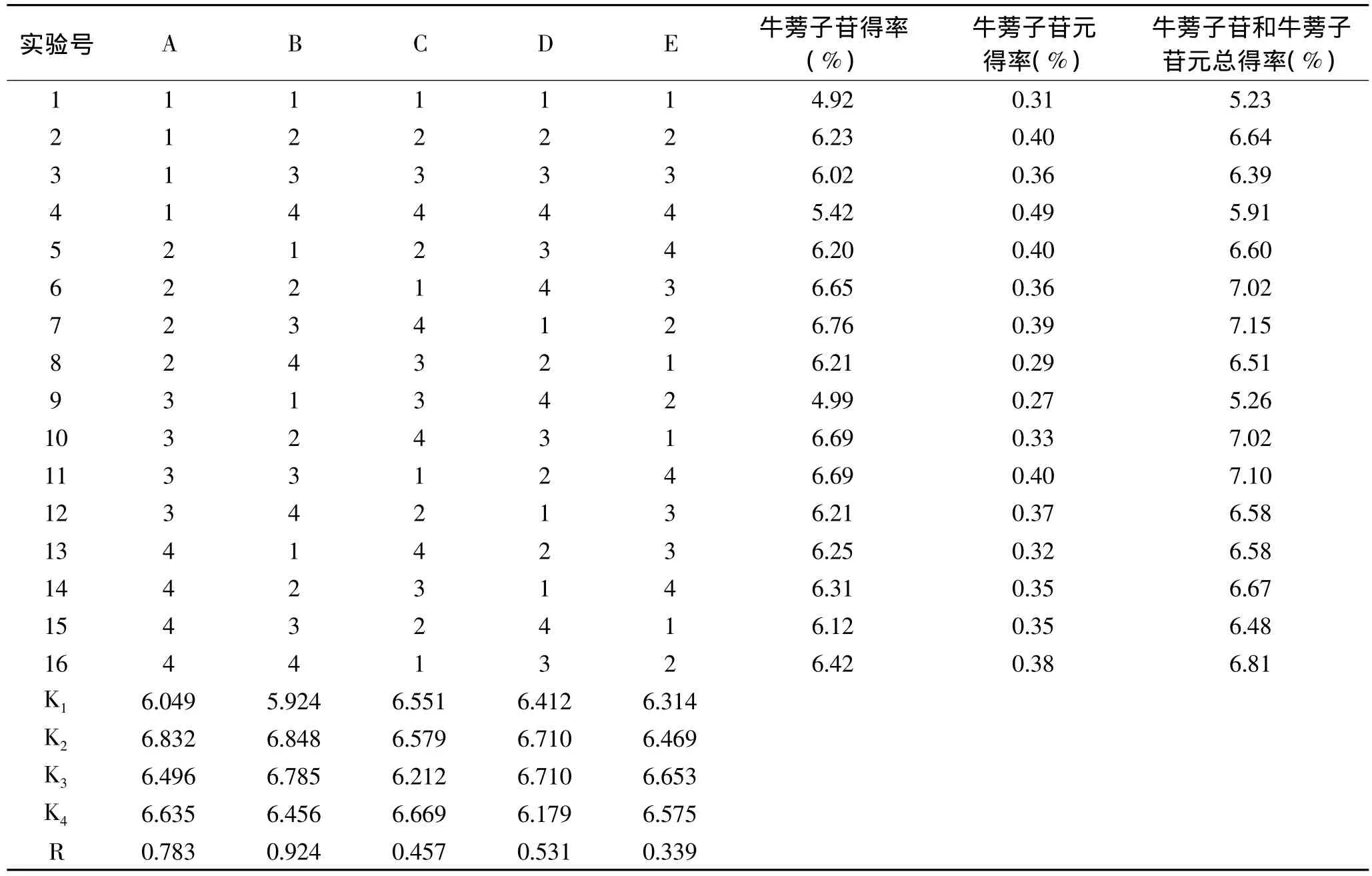
表2 正交实验结果Table 2 Orthogonal test results
2.3 正交实验结果
由表2正交实验直观分析可知,各因素对牛蒡子苷和牛蒡子苷元总得率的影响顺序为:B>A>D>C>E。由表3方差分析可得,从统计学角度看,五个因素中A因素和B因素为显著因素,其余三个因素均为不显著性因素。由于在因素C1、C2和C4条件下牛蒡子苷和牛蒡子苷元的平均总得率相差甚微,本着节约时间的选取原则,最后确定以B2A2C1D2E3为最佳提取条件,即乙醇浓度40%,提取3次,料液比1∶15(g/mL),提取功率500W,提取时间200s。
2.3.1 最佳工艺条件验证 取1g牛蒡子粉末,在最佳提取工艺条件下提取,重复5次,被测样品中牛蒡子苷的平均得率为7.14%,RSD=0.49%;牛蒡子苷元的平均得率为0.53%,RSD=1.06%;平均总得率为7.67%,RSD=0.52%。高于正交设计表中的最大值,表明所选取提取工艺稳定、可靠。
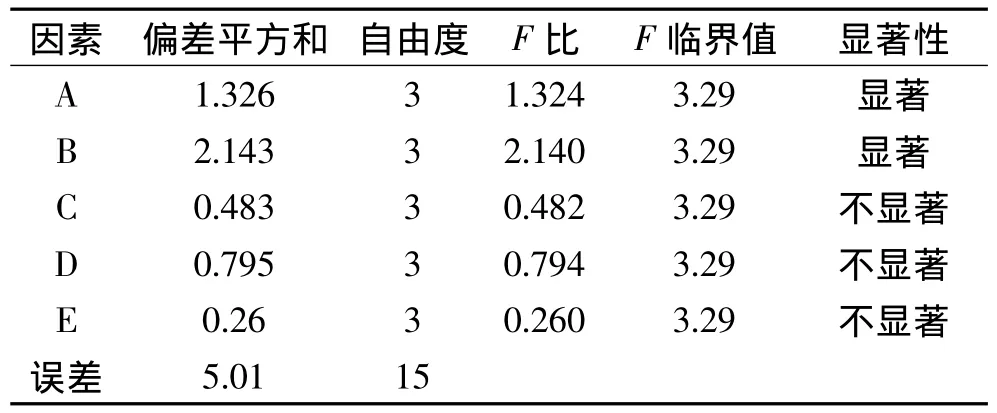
表3 方差分析表Table 3 Variance analysis
2.3.2 最佳工艺放大实验 取10g牛蒡子粉末,在最佳提取工艺条件下提取,牛蒡子苷和牛蒡子苷元的得率分别为6.84%和0.54%,总得率为7.38%,略低于放大前实验,表明上述提取工艺条件为牛蒡子苷和牛蒡子苷元的最佳提取工艺条件。
2.3.3 精密度实验 将在最佳提取工艺条件下制备的样品提取液按含量测定方法,连续进样5次,牛蒡子苷的平均得率为7.13%,RSD为0.54%;牛蒡子苷元的平均得率为0.53%,RSD为1.59%;牛蒡子苷和牛蒡子苷元的平均总得率为7.66%,RSD为0.59%。结果表明,测定方法具有良好的精密度。
2.3.4 加样回收率实验 在最佳提取工艺条件下的提取样品中,加入标准品,用同样的检测方法测出加样后样品中牛蒡子苷和牛蒡子苷元的含量,计算加样回收率,结果见表4,表明检测方法准确、可靠。
3 结论
本实验以乙醇为提取溶剂,探究了牛蒡子中牛蒡子苷和牛蒡子苷元的微波辅助提取工艺,并对提取工艺进行了优化。由于在牛蒡子中,牛蒡子苷的含量远远高于牛蒡子苷元,在选取适宜实验条件时,以牛蒡子苷和牛蒡子苷元的总得率为考察指标。实验研究所得最佳微波提取工艺条件为:乙醇浓度40%,料液比 1∶15(g/mL),提取功率 500W,提取时间200s,提取3次,牛蒡子苷和牛蒡子苷元得率分别为7.14%和0.53%,精密度分别为0.49%和1.06%。将所选取的最佳工艺放大10倍实验,得到牛蒡子苷和牛蒡子苷元的得率分别为6.84%和0.54%。放大前后牛蒡子苷和牛蒡子苷元得率非常接近,表明此工艺条件合理、可靠、稳定性好。

表4 加标回收率测定结果Table 4 Result of standard addition recovery
[1]江苏新医学院.中药大辞典[M].上海:上海科技出版社,1977.
[2]国家药典委员会.中国药典[S].北京:化学工业出版社,2005:48-49.
[3]Takasaki M,Konoshima T,Komatsu K,et al.Antitumor promoting activity of lignans from the aerial part of Saussurea medusa[J].Cancer Lett,2000,158(1):53-59.
[4]高阳,董雪,康廷国,等.牛蒡苷元体外抗流感病毒活性[J].中草药,2002,33(8):724-726.
[5]贺学林,章素云,陈以平,等.牛蒡子防治STZ糖尿病大鼠早期肾脏病变的实验研究[J].浙江中医杂志,2003(2):88-901.
[6]徐朝晖,赵爱华,高先富,等.具降糖活性的牛蒡子提取物的化学成分[J].中国天然药物,2006,4(6):444-447.
[7]Jang YP,Kim SR,Kim YC,etal.Neuroprtective dibenzylbutyro lactone lignans of Torreya nucifera[J].Planta Med,2001,67(5):4702-4721.
[8]王潞,赵烽,刘珂.牛蒡子苷及牛蒡子苷元的药理作用研究进展[J].中草药,2008,39(3):467-470.
[9]Zhao F,Wang L,Liu K.In vitro anti-inflammatory effects of arctigenin,a lignan from Arctium lappa L.,through inhibition on iNOS pathway[J].J Ethnopharmacol,2009,122:457-462.
[10]Wu JG,Wu JZ,Sun LN,et al.Ameliorative effects of arctiin from Arctium lappa on experimental glomerulonephritis in rats[J].Phytomedicine,2009(16):1033-1041.
[11]王小琳,张玉杰,石任兵.正交实验设计优选牛蒡子的提取工艺[J].北京中医药大学学报,2003,26(4):64-65.
[12]董文洪,刘本.超临界流体萃取牛蒡子中牛蒡子苷的实验研究[J].中国中药杂志,2006,31(15):1240-1241.
[13]武娟霞,王志祥,余祥英,等.牛蒡子中牛蒡苷和牛蒡苷元的超声提取工艺研究[J].中成药,2010,32(6):927-931.
[14]王卫东,李超,唐仕荣,等.牛蒡子中牛蒡子苷的提取分离[J].食品科学,2009,30(18):187-191.
[15]Liu H,Zhang YP,Sun YT,et al.Determination of the major constituents in fruit of Arctium lappa L.by matrix solid-phase dispersion extraction coupled with HPLC separation and fluorescence detection[J].J Chromatogr B,2010,878:2707-2711.
