藏药匙叶翼首草的快繁技术研究△
2016-09-25徐元江甄梓娟许永强曹芳廖志华兰小中
徐元江,甄梓娟,许永强,曹芳,廖志华,兰小中*
(1.西藏大学 农牧学院 药用植物研究中心,西藏 林芝 860000; 2.西南大学-西藏大学农牧学院 药用植物联合研发中心/西南大学 生命科学学院,重庆 400715)
·中药农业·
藏药匙叶翼首草的快繁技术研究△
徐元江1,甄梓娟1,许永强1,曹芳2,廖志华2,兰小中1*
(1.西藏大学 农牧学院 药用植物研究中心,西藏 林芝 860000; 2.西南大学-西藏大学农牧学院 药用植物联合研发中心/西南大学 生命科学学院,重庆 400715)
目的:建立藏药匙叶翼首草组培快速繁殖体系。方法:采用不同浓度的植物生长调节剂诱导产生丛生芽与根,并筛选三种不同栽培基质。结果:最好的消毒条件为75%酒精处理30 s+2.5% NaClO处理2.5 min+MS液(含2.5% PPM抗菌剂)处理3小时。诱导丛生芽的最佳培养基为MS+6BA 3 mg·L-1+NAA 0.5 mg·L-1,其次为MS+6BA 3 mg·L-1+NAA 0.2 mg·L-1。丛生芽生根的适宜培养基为MS+NAA 0.2 mg·L-1,小苗最适宜栽培基质为蛭石:珍珠岩=1∶1。结论:通过本研究的方法可得到翼首草无菌苗与再生苗。
匙叶翼首草;萌发;快繁;组培
翼首草为常用藏药材,属川续断科(Dipsacaceae)翼首草属Pterocephalus多年生草本,以全草入药,藏语音译名称“榜子毒乌”、“榜孜毒乌”、“榜孜夺吾”等。在“南派藏医药”中,翼首草被喻为地上“七种仙草”之一[1],系西藏自治区二级濒危藏药材品种之一。在《四部医典》、《晶珠本草》等藏医典籍均有记载。《中华人民共和国药典》规定其基原为匙叶翼首草Pterocephalushookeri(C.B.Clarke)Höeck,味苦,性寒;有小毒,解毒除瘟,清热止痢,祛风通痹[2]。翼首草生于海拔1800~4800 m的山野草地、高山草甸及耕地附近,分布于云南、四川、西藏东部和青海南部等藏区[3]。药理研究表明,翼首草含有三萜皂苷类、环烯醚萜苷类、生物碱及多糖等,具有显著的抗炎、镇痛及免疫调节等作用[4]。最近郭晨旭研究表明其提取物还有一定抗肿瘤的功效[5]。
目前有关翼首草的研究主要有种子萌发[6-7]及人工栽培技术[8-9],化学成分[10-12],药理活性与临床应用[13-14],质量体系[15]等方面。关于翼首草组培与快繁技术的研究尚未见报道。植物组培技术在药用植物中大量应用,可以使难以有性繁殖的药用植物大量增殖,减少对环境的依赖与破坏,保存与繁殖濒临灭绝的药材资源[16]。本实验对翼首草快繁技术体系进行了初步探索,可以在较短时间内获取大量的幼苗用于生产种植,为今后开展相基因工程等后续工作提供支持。
1 材料与方法
1.1 材料
匙叶翼首草种子采自西藏林芝市西藏大学农牧学院牧场,仅西藏大学农牧学院兰小中教授鉴定为匙叶翼首草P.hookeri。
1.2 试剂
蔗糖、无水乙醇等购自重庆川东化工厂;NaClO溶液(5.5%活性氯)购于成都市科龙化工试剂厂;PPM抗菌剂购于Plant Cell Technology公司;6BA,NAA分析纯购于Sigma;其他试剂均为分析纯。
1.3 方法
1.3.1 无菌苗萌发将种子剥去外种皮,选取饱满正常的种子,放在培养瓶中,用纱布封好瓶口,自来水冲洗30 min。按表1的5种消毒方式进行种子消毒,每种消毒剂处理后用无菌水冲洗3~5次。每种消毒处理选取种子30粒,在25 ℃,光照培养2周,统计种子污染率等数据。
1.3.2 翼首草增殖将萌发的无菌苗接到MS培养基的罐子中培养2个月。每苗取2~4片成熟叶片,去掉叶尖与叶柄,剪成0.5~0.8 cm长的叶段。将叶面朝上放置,叶的边缘切口插入加不同植物生长调节剂的MS培养基(见表2)。每个处理12段叶片,设置3个重复。
1.3.3 翼首草芽生根处理将翼首草丛生芽放于无菌培养皿中,用镊子与解剖刀分开丛生芽。选取大小相近,生长状态良好的芽,插入MS加不同浓度的NAA的培养基中,深度约为0.5 cm,诱导生根,每个处理10株苗(表3)。
1.3.4 翼首草炼苗与移栽选取培养瓶中生长健壮,大小一致的翼首草幼苗,打开瓶口。炼苗3 d后洗净根部的培养基,分别种植在三种栽培基质(表4),三种培养基质提前混匀并用含0.1%花无缺的水浇透。翼首草幼苗在温室培养3d后放到室外培养。
1.3.5 统计分析数据录入与整理用EXECL 2013,统计分析使用SPSS 16.0。
1.3.6 MS培养基pH值在5.80~5.85,琼脂粉8.0 g·L-1,蔗糖30 g·L-1,121 ℃的条件下灭菌20 min。组培室温度25℃左右,相对湿度40%左右,光照16 h·d-1,光照强度约为1400 Lx。
2 结果与分析
2.1 不同消毒方式的效果
消毒处理5的消毒效果最好,特别是对于霉菌污染的种子具有较强的消毒能力,同时对种子的损害较小。消毒处理3虽然没有污染,但是种子已经失活,结果详情见表1。

表1 翼首草种子不同消毒方式的效果
2.2 翼首草增殖
翼首草是多年生无茎草本,用于进行快繁的组织有根、叶与茎尖。前期实验发现其根的再生能力弱,不易出芽;茎尖较小剥取难度大,来源少且剥取过程易损伤故不适于进行快繁。在MS固体培养基中加细胞分裂素6BA(分别为:1 mg·L-1、2 mg·L-1、3 mg·L-1、4 mg·L-1)与生长素NAA(分别为:0.2 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1)。当6BA/NAA值大于3才有芽产生,在一定的范围內随着6BA/NAA的值增加,芽的数量与质量呈现增加的趋势。当6BA与NAA均为较高浓度时,仅仅能诱导出愈伤组织。翼首草芽诱导激素浓度范围较广,其中6BA为2 mg·L-1至4 mg·L-1,NAA为0.2 mg·L-1至1 mg·L-1均能诱导出芽。本实验中最佳芽诱导培养基为7号,5号(表2)。
2.3 芽生根处理
生根培养基中的芽大约10 d开始生根,20 d根生长趋于稳定。翼首草生根较容易,在未添加NAA时生根较慢;在MS+NAA 0.2 mg·L-1的培养基最好,根生长较快,根数适中;在较高浓度的MS+NAA 0.5 mg·L-1时根最多但较短,可能是较高浓度NAA对根的诱导有促进作用却对根生长有一定抑制作用。

表2 不同激素配方对翼首草芽诱导的影响
注:丛生芽的数量:++++>+++>++>+>0,不同小写字母间表示不同处理的差异达到显著水平(P<0.05)
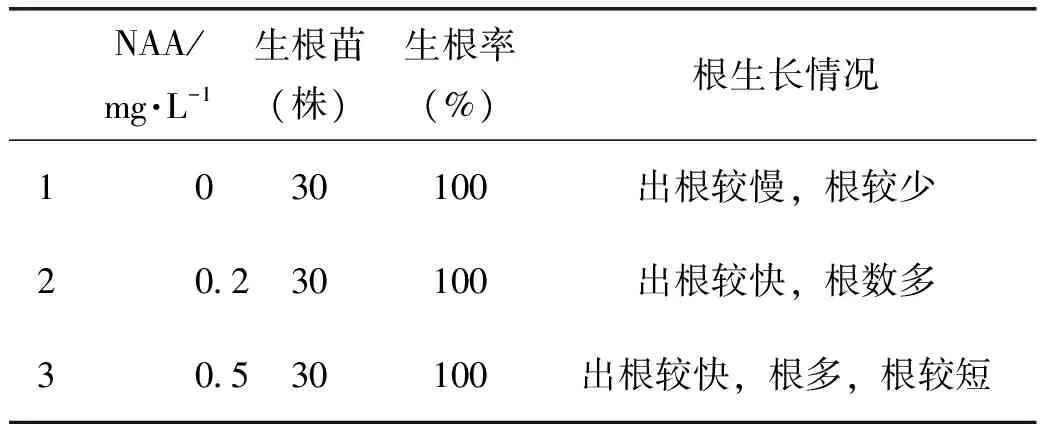
表3 不同栽培基质对翼首草再生芽生根的影响
2.4 炼苗与移栽
选取大小适中的再生苗在25 ℃温室中打开培养瓶瓶口,培养2 d后取出并洗净根部培养基分别放入不同的栽培基质。一周后统计成活率,发现根部特别容易感染霉菌,根部腐烂而枯萎。翼首草适应西藏相对干燥的生长环境,在透气较好,较干燥的1号栽培基质中成活率相对较高为25%,而在菜园土等较多的3号基质中存活率为0。
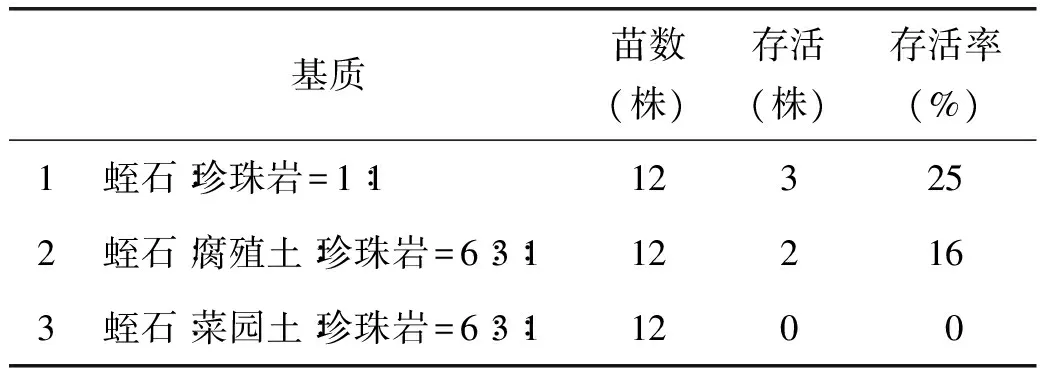
表4 翼首草栽培基质筛选

注:A.萌发一周翼首草幼苗;B.翼首草叶再生出的丛生芽; C.翼首草生根的再生苗;D.翼首草再生苗移栽图1 翼首草快繁的各阶段
3 结论与讨论
植物生长调节剂的种类与比例对于愈伤组织和丛生芽诱导具有重要影响,一般细胞分裂素与生长素的比值大于1促进生芽,小于1促进生根。翼首草叶片在一定激素浓度范围内,6BA/NAA值大于4时有芽形成,比例为6时芽最多如激素处理7;处于高激素浓度时如激素处理8,则仅产生愈伤组织。翼首草叶片通过激素诱导产生丛生芽见图1 b。
翼首草种子成熟季节是雨季易感染霉菌,且缺乏坚硬的外种皮保护,消毒过度易失活。种子采集后应及时晒干并在4 ℃阴凉环境中保存,可较好保证种子活力。翼首草的芽再生时使用培养皿没有培养瓶的效果好,培养皿中可见芽点,但培养基表面积较大,水分蒸发较快对培养基激素浓度改变较大,叶片易褐化死亡;培养瓶因为生长空间多、培养基较多更适于翼首草的快繁。翼首草再生苗炼苗与移栽过程可以通过控制水分,可以添加抗菌剂如多菌灵等方法增加存活几率。
随着藏药产业的发展,翼首草的需求量也将增大。目前匙叶翼首草的来源主要是野外采集,仅见有少量的人工栽培。通常翼首草以干燥全草药用,采收后需播种育苗而种子来源较少又不易储藏,种子质量与数量难以保证,采用翼首草叶片作为快繁材料,采用快繁技术将有望解决种子资源不足的问题。
[1] 庞伟.藏药翼首草的研究与应用[J].中国民族医药杂志,2007,13(5):63-65.
[2] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:358.
[3] 中国科学院中国植物志编辑委员会.中国植物志:第73(1)卷[M].北京:科学出版社,1986:69.
[4] 张雪梅,杨丰庆,夏之宁.藏药翼首草的药理作用及其质量评价研究进展[J].中国药房,2012,23(35):3356-3358.
[5] Guo C X,Wu Y C,Zhu Y Z,et al.In Vitro and In Vivo Antitumor Effects of n-Butanol Extracts ofPterocephalushookerion Hep3B Cancer Cell[J].Hindawi,2015:1-10.
[6] 杨敬军,马令法,何淑玲,等.匙叶翼首草种子特性及萌发最适条件的研究[J].西南农业学报,2013,26(6):2489-2492.
[7] 杨敬军,马令法,何淑玲,等.豌豆苗浸出液对匙叶翼首草种子萌发特性的影响[J].广东农业科学,2013,40(22):42-44.
[8] 常毓巍,何淑玲,杨敬军,等.不同叶面肥对匙叶翼首草生长、产量和品质的影响[J].贵州农业科学,2011,39(12):67-70.
[9] 兰小中,周战.一种高海拔地区翼首草的高产人工栽培技术[P].CN:103141291A,2013-06-12.
[10] 田军,吴凤锷,丘明华,等.匙叶翼首花的化学成分[J].天然产物研究与开发,2000,12(1):35-38.
[11] 张艺,李文军,孟宪丽.藏药翼首草化学成分的研究[J].成都中医药大学学报,2002,25(3):41-42,46.
[12] Graikou K,Aligiannis N,Chinou I B.Chemical constituents from Pterocephalus perennis subsp.perennis(Dipsacaceae)[J].BiochemSystEcol,2006,34(5):438-441.
[13] 余鸽,龙凤来,黄时伟.环烯醚萜药理作用研究进展[J].陕西林业科技,2009(2):69-73.
[14] 沈芃.藏药翼首草抗类风湿性关节炎作用与机理研究[D].成都:成都中医药大学,2002.
[15] 张雪梅.藏药翼首草化学成分及质量评价方法研究[D].重庆:重庆大学,2013.
[16] 王姝,赵玉桥,罗国坤,等.组织培养技术在药用植物中的应用研究进展[J].贵州农业科学,2010,38(12):26-29.
RapidPropagationTechniqueforTissueCultureofPterocephalushookeri
XU Yuanjiang1,ZHEN Zijuan1,XU Yongqiang1,CaoFang2,LIAO Zhihua2,LAN Xiaozhong1*
(1.MedicinalPlantsResearchCentre,Agricultural&AnimalHusbandryCollegeofTibetUniversity,Nyingchi860000,China; 2.SWU-TAAHCMedicinalPlantsJointResearchandDevelopmentCentreSchoolofLifeSciences,SouthwestUniversity,Chongqing400715,China)
Objective:In order to establish the tissue culture rapid propagation system of Tibetan medicine ofPterocephalushookeri.Methods:The study took leaves as materials and adopted different concentration of plant growth regulators to induce cluster buds and roots,and then screened three different growing media.Results:The best disinfection conditions was for 30 s of 75 % alcohol,2.5 min of 2.5% NaClO,3 hours of MS liquid medium (containing 2.5 % PPM).It suggested that the best medium for inducing cluster buds is MS + 6BA 3 mg·L-1+ NAA 0.5 mg · L-1,and the second is MS+6BA 3 mg · L-1+ NAA 0.2 mg · L-1.The most suitable medium of inducing roots is MS + NAA 0.2 mg · L-1.The optimal cultivation substrate is vermiculite:perlite=1∶1.Conclusion:The sterile seedling and regeneration plants can be obtained by the study.
Pterocephalushookeri;germinate;propagation;tissue culture
10.13313/j.issn.1673-4890.2016.10.014
2016-01-19)
西藏自治区重大科技计划(20131225);藏药材资源与开发利用创新团队建设;西藏特色农牧资源研发协同创新中心;西藏大学农牧学院研究生创新计划项目(YJS2015-03)
*
兰小中,教授,研究方向:药用植物资源与开发利用;Tel:(0894)5826471,E-mail:lanxiaozhong@163.com
