H102对转基因AD小鼠脑内NF-κB信号通路相关蛋白的影响*
2016-09-15袁小涌孙凤仙徐淑梅
王 超,袁小涌,孙凤仙,蒋 方,徐淑梅
H102对转基因AD小鼠脑内NF-κB信号通路相关蛋白的影响*
王 超,袁小涌,孙凤仙,蒋 方,徐淑梅△
(天津医科大学生理学教研室,天津300070)
目的:研究β片层阻断肽H102对转基因AD小鼠脑内NF-κB通路相关蛋白活性及表达的影响。方法: 将30只8周龄APP/PS1双转基因小鼠随机分为模型组和给药组,另选15只同周龄同背景的C57BL/6J小鼠设为对照组(n=15)。给药组每日经鼻腔给予H102溶液5μl(5.8mg/kg),对照组和模型组每日给予等量空白辅料溶液。给药16周后,采用Morris水迷宫检测小鼠的空间参考记忆变化,采用免疫组织化学方法和免疫印迹技术测定小鼠脑组织内β样淀粉样蛋白(Aβ1-42)、核因子-κB(NF-κB)、核因子-κB抑制蛋白(IκB)、IκB蛋白激酶(IKK)及其磷酸化蛋白(p-NF-κB、p-IκB、p-IKK)以及诱导型一氧化氮合酶(iNOS)和活化型半胱天冬酶-3(cleaved Caspase 3)蛋白的表达。结果:①Morris水迷宫测试:模型组小鼠的空间学习记忆能力较对照组显著降低,给药组较模型组显著提高(P<0.05)。②免疫组化及免疫印迹检测结果:模型组小鼠脑组织内Aβ1-42、p-IKK、p-NF-κB、p-IκB、核内NF-κB及iNOS和cleaved Caspase 3蛋白的表达较对照组显著增高,给药组蛋白表达较模型组显著降低(P<0.05)。结论:H102可抑制APP/PS1双转基因小鼠脑内NF-κB信号转导通路,抑制细胞凋亡和炎症反应,明显改善转基因AD小鼠的学习记忆能力。
阿尔茨海默病;小鼠,转基因 ;H102;NF-κB信号通路;
【DOI】10.13459/j.cnki.cjap.2016.03.001
阿尔茨海默病(Alzheimer's Disease,AD)是一种神经退行性疾病,其病因及发病机制尚未完全阐明。目前,β样淀粉样蛋白(amyloid beta-protein,Aβ)级联假说被广泛接受为AD发病机制的核心[1]。大量的研究表明Aβ的神经毒性在AD的发病中起到关键性作用。而Aβ的神经毒性与其β折叠所导致的聚集和沉积有关,因此抑制Aβ的聚集成为治疗AD的一个重要途径。β片层阻断肽是一类专门针对Aβ设计并合成的多肽,能够抑制Aβ错误折叠和聚集,阻断其神经毒性,是一类新型的治疗老年痴呆的候选药物[2,3]。本课题组前期研究已经证实经鼻腔给于H102一个月可明显减少模型小鼠脑内Aβ的表达和聚集,抑制神经细胞凋亡,改善其学习记忆能力[4]。
核因子-κB(nuclear factor-kappa B,NF-κB)作为广泛存在的核转录因子,参与调控多种基因的表达,在机体免疫、炎症和细胞增殖及凋亡中起着重要的调节作用。大量的研究发现,NF-κB的激活与Aβ的神经毒性作用相关,提示NF-κB在神经退行性疾病中也起着重要作用。此外,经尸检也发现AD患者脑内退行性变神经元中NF-κB活性增强[5]。NF-κB的激活涉及IκB的磷酸化,而后者有赖于IKK的调控,IKK/IκB/NF-κB是一个有机联系的系统。激活的NF-κB通过对相关基因和蛋白的调控,影响着细胞的凋亡和应激。本研究旨在观察AD病理情况下NF-κB活性的变化并探究β片层阻断肽H102对APP/PS1双转基因小鼠脑内NF-κB通路相关蛋白活性的影响。
1 材料与方法
1.1 材料
8周龄APP/PS1双转基因小鼠30只,同周龄同背景的C57BL/6J小鼠15只,雄性,体重(15.0± 1.6)g,SPF级,购自北京华阜康生物公司,饲养于天津医科大学动物中心。β片层阻断肽H102由上海吉尔生化有限公司合成,高效液相色谱法纯化,经质谱仪(MS)分析鉴定纯度>95%,DAB显色试剂盒、即用型SABC免疫组化试剂盒购于武汉博士德生物公司。核蛋白提取试剂盒购于Thermo Fisher Scientific公司,p-IKKβ(Ser180)、IKK、p-NF-κB(Ser536)、NF-κB、p-IκB(Ser32)、IκB及iNOS和cleaved caspase-3抗体均购自CST公司,Aβ1-42抗体购自BioLegend公司,β-actin抗体购自北京中杉金桥生物公司,H3抗体购于北京博奥森生物公司。
1.2 动物分组及给药方法
采用随机数字表法将APP/PS1双转基因小鼠分为模型组和给药组(n=15)。并设同周龄同背景C57BL/6J小鼠15只为对照组。给药组每日经鼻腔给予H102溶液(5.8mg/kg)5μl,对照组和模型组每日经鼻腔给予空白辅料溶液(0.5%壳聚糖、0.1% BSA)5μl,每日同样时间段给药1次。
1.3 Morris水迷宫测试
连续给药16周后,进行Morris水迷宫测试。(1)定位航行实验:在水迷宫第三象限中央放置平台,将小鼠从第一象限放入水中,记录小鼠寻找并爬上平台所需时间即逃避潜伏期,每天相同时段游泳训练2次,每次90 s,历时5 d。(2)空间探索实验:于水迷宫实验的第6天撤去平台,在相同时段将小鼠放入水中,让其寻找记忆中的平台,游泳1次,历时90 s。记录小鼠在原平台所在象限停留时间(residence time in the third quadrant,RTQ)、跨越隐匿平台的次数及游泳朝向角等指标,测试小鼠的记忆能力。
1.4 脑组织样本的制备
Morris水迷宫测试结束后,用10%水合氯醛(4 ml/kg)对小鼠进行腹腔麻醉,0.01 mol/L磷酸盐缓冲液(PBS)灌注至肝肺透明。于冰上解剖,一半脑组织放入4%多聚甲醛溶液内固定,一半脑组织分离海马与皮质放入液氮中备用。
1.5 免疫组织化学染色
甲醛固定后的脑组织制成海马、皮质相关区域冠状切片,切片脱蜡后用3%H2O2室温孵育15min,并用枸橼酸缓冲液微波沸腾抗原修复。5%BSA室温封闭15 min。之后滴加按一定比例稀释的一抗(p-IKK 1∶400、p-NF-κB 1∶200、p-IκB 1∶200、iNOS 1∶200和cleaved Caspase 3 1∶800)工作液,4℃过夜。滴加适量生物素标记二抗工作液室温避光孵育15 min,再用辣根酶标记物工作液室温避光孵育15 min,DAB显色剂显色,镜下控制染色时间,苏木素复染,中性树胶封片。阴性对照组用PBS代替一抗进行免疫组化染色,其余步骤同上。在倒置显微成像系统下观察并拍摄切片相同层次海马及皮质,用IPP 6.0软件对图片累积光密度进行分析。
1.6 Western blot分析
于液氮中取出分离的海马和皮质组织,提取总蛋白,BCA法测定蛋白浓度后调定各组蛋白为等浓度,加适量上样缓冲液,煮沸变性3min。8%~20%分离胶电泳分离蛋白后湿转到PVDF膜上,膜用5%脱脂奶粉室温封闭2 h,加入稀释的一抗(Aβ1-421∶250、p-IKK 1∶1 000、IKK 1∶1 000、p-NF-κB 1∶500、NF-κB 1∶500、p-IκB 1∶1 000、IκB 1∶1 000及iNOS 1∶1 000 和cleaved Caspase 3 1∶500),4℃摇床过夜,加入稀释的二抗(1∶5 000),室温下孵育2 h,然后化学发光法曝光,用Quantity One软件分析所得条带的灰度值。使用试剂盒提取核蛋白,其余步骤同上,测定各组核内NF-κB蛋白的含量。
1.7 统计学分析
采用SPSS 17.0软件处理数据,计量数据以均数±标准差(±s)表示,组间比较采用单因素方差分析法。
2 结果
2.1 Morris水迷宫测试结果
2.1.1 逃避潜伏期 第2天起给药组小鼠较模型组显著缩短(P<0.05);与对照组相比,模型组逃避潜伏期始终高于对照组(P<0.05)。除第1天和第4天外,给药组与对照组无显著性差异(图1)。
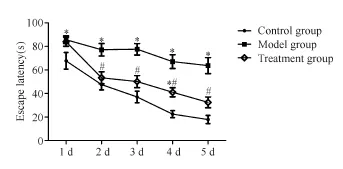
Tab.1 Comparison of average escape latency in navigation testamong three groups ofmice(±s,n=15)
2.1.2 空间探索结果 模型组RTQ少于对照组(P <0.05),给药组较模型组延长(P<0.05)。模型组跨越隐匿平台次数少于对照组,给药组较模型组跨越次数增加,但仍少于对照组(P<0.05)。模型组入水朝向角大于对照组(P<0.05),给药组较模型组减小(P<0.05,表1)。
Tab.1 Comparison of RTQ,numberof cross-hidden platform and the orientation angle in space exploration experiment among three groups ofmice(±s,n =15)

Tab.1 Comparison of RTQ,numberof cross-hidden platform and the orientation angle in space exploration experiment among three groups ofmice(±s,n =15)
RTQ:Residence time in the third quadrant*P<0.05 vs control;#P<0.05 vs model
(°)Control 25.33±6.91 3.20±1.61 32.52±23.71 Model 17.67±4.46*0.45±0.69* 65.97±36.53*Treatment 23.63±6.62#1.57±0.85*#38.91±25.36 Group RTQ(s) Number Orientation angle #
Tab.2 NF-κB relevant proteins level(IOD)inmice brain(×104,±s,n=15)
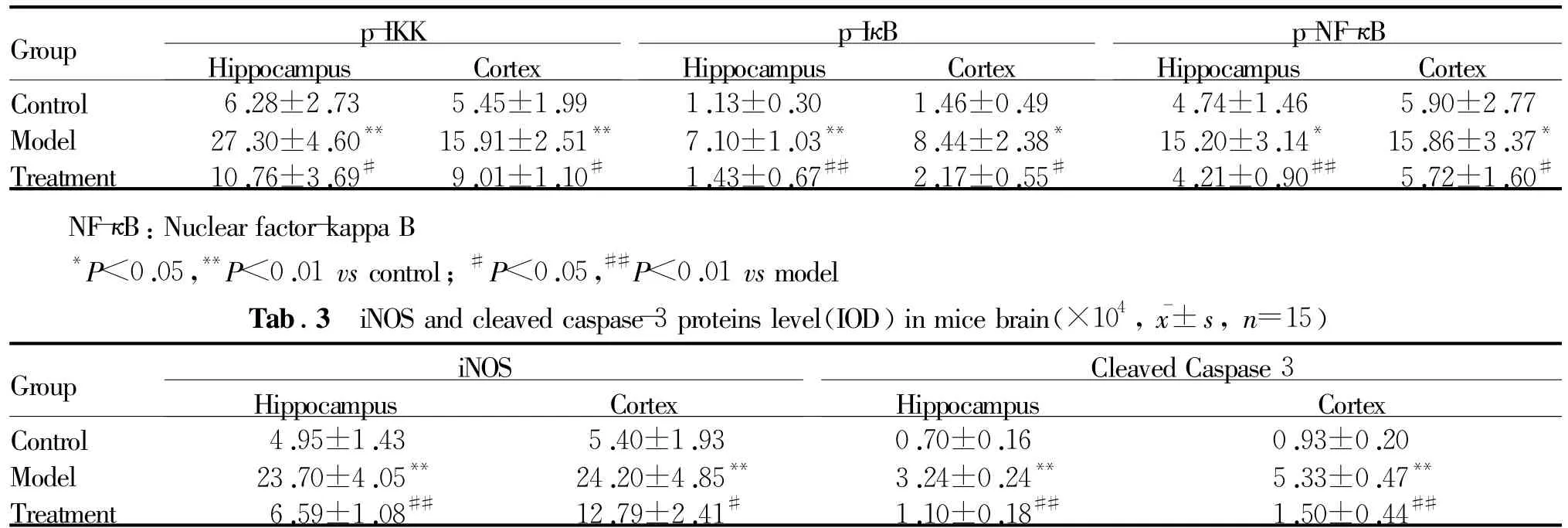
Tab.2 NF-κB relevant proteins level(IOD)inmice brain(×104,±s,n=15)
**P<0.01 vs control;#P<0.05,##P<0.01 vs model
Group p-p-IκB Cortex Control 6.28±2.73 5.45±1.99 1.13±0.30 1.46±0.49 4.74±1.46 5.90±2.77 Model 27.30±4.60** 15.91±2.51** 7.10±1.03** 8.44±2.38* 15.20±3.14* 15.86±3.37*Treatment 10.76±3.69# 9.01±1.10# 1.43±0.67## 2.17±0.55# 4.21±0.90## 5.72±1.60 p-NF-κB IKK Hippocampus Cortex Hippocampus Cortex Hippocampus # NF-κB:Nuclear factor-kappa B*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model Tab.3 iNOSand cleaved caspase-3 proteins level(IOD)inmice brain(×104,±s,n=15)Group Cleaved Caspase 3 Cortex Control 4.95±1.43 5.40±1.93 0.70±0.16 0.93±0.20 Model 23.70±4.05** 24.20±4.85** 3.24±0.24** 5.33±0.47**Treatment 6.59±1.08## 12.79±2.41# 1.10±0.18## 1.50±0.44 iNOS Hippocampus Cortex Hippocampus ##
2.2 免疫组织化学法测定Aβ1-42及NF-κB通路相关蛋白的表达
2.2.1 p-IKK、p-NF-κB及p-IκB的免疫组化检测p-IKK、p-IκB和p-NF-κB蛋白存在于细胞胞浆和胞核,对照组海马及大脑皮层阳性表达水平较低;模型组阳性表达水平显著高于对照组,给药组阳性表达水平较模型组降低(P<0.05,图2,表2,图2见彩图页Ⅰ)。
2.2.2 iNOS和cleaved Caspase 3的免疫组化检测iNOS和cleaved Caspase 3主要存在于胞浆,结果显示对照组脑内神经细胞胞浆着色较浅,iNOS和cleaved Caspase 3蛋白的阳性表达水平较低;模型组脑内阳性表达水平显著高于对照组 ,给药组阳性表达水平较模型组降低(P<0.05,图3,表3,图3,见彩图页Ⅱ)。
2.3 Western blot测定Aβ1-42及NF-κB通路相关蛋白的表达
2.3.1 Aβ1-42蛋白表达 结果显示,对照组小鼠的Aβ1-42的表达量较少;与对照组比较,模型组小鼠Aβ1-42的表达量显著增多(P<0.01);与模型组相比,给药组明显降低了AD小鼠脑内Aβ1-42表达(P<0.01);给药组与正常组相比较无显著性差异(图4,见彩图页Ⅱ)。
2.3.2 p-IKK、p-NF-κB、p-IκB及核内NF-κB的相对表达 与对照组相比,模型组小鼠脑内IKK、NF-κB 和IκB蛋白的磷酸化水平均高于对照组(P<0.01),给药组低于模型组(P<0.05)。核内NF-κB的含量,模型组显著高于对照组(P<0.01),给药组低于模型组(P<0.05,表4)。
2.3.3 iNOS和cleaved Caspase 3蛋白表达 与对照组相比,模型组小鼠脑内iNOS和cleaved Caspase 3蛋白表达均高于对照组,给药组低于模型组(P<0.05,表5)。
Tab.4 Relative expression of NF-κB relevant proteins in hippocampus and cortex(±s,n=15)
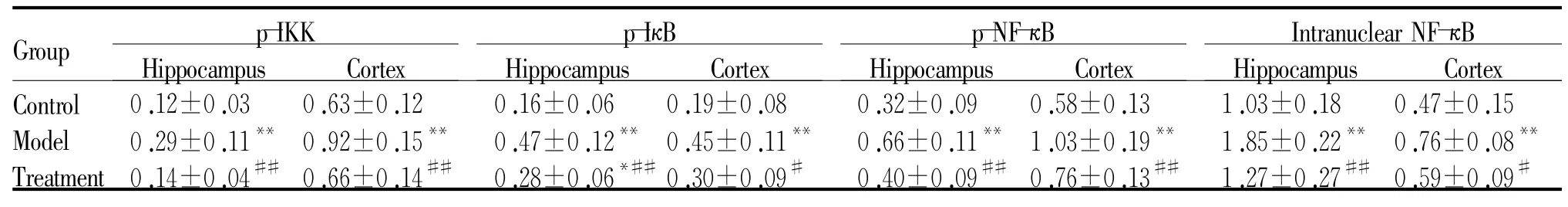
Tab.4 Relative expression of NF-κB relevant proteins in hippocampus and cortex(±s,n=15)
**P<0.01 vs control;##P<0.01 vs model
?
Tab.5 Relative expression of iNOS and cleaved Caspase 3 protein in hippocampus and cortex(±s,n=15)

Tab.5 Relative expression of iNOS and cleaved Caspase 3 protein in hippocampus and cortex(±s,n=15)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
?
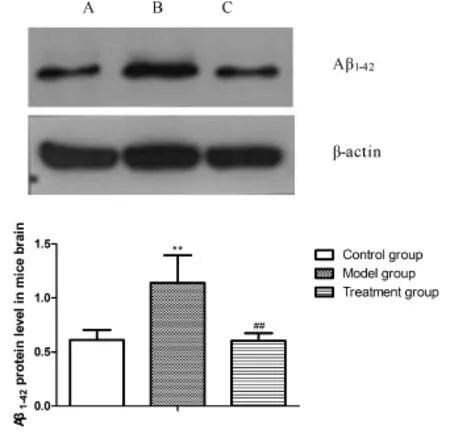
Fig.4 Expressions of Aβ1-42 inmice brain after 16weeks(±s,n=15)
3 讨论
AD是一个连续的疾病过程,其重要的病理学特征是Aβ沉积于脑内所形成的老年斑(senile plaque,SP)。众多证据表明Aβ聚集在AD的发病机制中起着关键性的作用,而Aβ二级结构中β折叠的形成是聚集所必需的[6]。β片层阻断肽H102可与Aβ1-42的疏水氨基酸结合形成复合物,抑制Aβ内部β折叠的形成和β折叠间的相互结合,减少Aβ的聚集和沉积,从而抑制其下游的病理过程[2]。本实验中,我们采用在模型小鼠尚未发生AD时,便开始给予H102进行早期干预。结果显示,给药组的学习记忆能力明显高于模型组 ,且Aβ1-42水平显著低于模型组,说明H102达到了预期的治疗效果。
体外研究显示,Aβ能激活培养神经元中的NF-κB,促进炎症因子的表达,从而发挥其神经毒性作用[7]。另有研究证明,BACE1基因上含有NF-κB的结合位点,激活的NF-κB可使BACE1的表达增多,从而使 Aβ的沉积增多[8-10]。以上研究结果提示 ,NF-κB的过度激活在AD的发生发展中可能起着重要作用。NF-κB是一种广泛存在于真核细胞内具有功能多向性的转录调控因子,其激活机制是一个复杂的过程。虽然其机制尚未完全阐明,但研究最多的是依赖于IKK磷酸化的信号通路。即细胞处于静息状态时,NF-κB位于胞浆中,与NF-κB抑制蛋白IκB结合呈非活性状态。当细胞受到外界信号刺激时,在IκB蛋白激酶IKK的作用下,IκB蛋白发生磷酸化,通过依赖于泛素/蛋白酶的途径被降解,从而解除了IκB对NF-κB的抑制作用,NF-κB与IκB分离并移位进入细胞核,与靶基因的κB序列结合启动多种基因的转录[11,12]。本实验结果显示,AD模型小鼠脑内IKK活性显著高于对照组,NF-κB被过度激活。给药组p-IKK含量降低,NF-κB活性显著低于模型组,提示H102可能具有减少NF-κB的过度激活的作用。
激活的NF-κB可促进iNOS、TNF-α和IL-1β等多种因子的表达,从而促进细胞的炎症和凋亡。iNOS 是NOS的一种,能以L-精氨酸为底物,催化合成一氧化氮(NO)和瓜氨酸。生理性NO作为一种第二信使,在生命活动中发挥着重要生物学效应。但激活的iNOS能够催化合成大量的NO。致病性高水平的NO一方面能与含Fe-S基团的线粒体呼吸链复合物Ⅰ/Ⅱ以及DNA合成酶和连接酶等结合,破坏其活性;另一方面,能够与氧负离子反应,形成毒性较强的强氧化剂过氧亚硝基阴离子(ONOO-),从而促进蛋白质和DNA氧化损伤、炎症反应和细胞凋亡。本实验结果显示AD转基因模型小鼠脑内iNOS的表达增多,反映在AD病理状态下小鼠脑内炎性反映较为明显。给药组iNOS的表达减少,提示H102可能具有降低iNOS合成的作用,从而减少NO的合成,降低脑内氧化应激反应对神经元的损害。
神经元凋亡是AD发病过程中的重要环节之一。尽管有很多触发凋亡的途径,但最终绝大多数会通过天冬氨酸特异的半胱氨酸蛋白激酶家族(Caspases)级联反应。Caspase 3是Caspases级联反应中下游最关键的凋亡执行蛋白酶,在各种程序启动的凋亡程序中起最后枢纽的作用。NF-κB促进转录表达的TNF-α、IL-1β等因子能够通过与膜上受体结合,诱导cleaved Caspase 3的表达上调。且本课题组的前期研究发现,在AD模型小鼠脑内TNF-α和IL-1β表达显著增多,给药组TNF-α和IL-1β表达显著降低[13]。本实验中也发现,模型组小鼠脑内活化的Caspase 3表达较高,给药组小鼠脑内活化Caspase 3蛋白表达下调,提示H102可能具有抑制Caspase 3过度活化的作用,进而发挥抗凋亡作用。研究表明,NF-κB一方面可通过诱导Bcl-2、IAPs等抗凋亡基因的表达,发挥其抗凋亡作用;另一方面,又可通过上调促凋亡基因如Caspases 11、Bax等基因的表达和与其他信号通路的相互作用 ,促进细胞凋亡[11]。结合本课题组前期研究发现,在AD病理情况下,伴随NF-κB活性的上调,小鼠脑内抗凋亡相关蛋白Bcl-2,Bcll表达显著减少,而促凋亡相关蛋白Bad,Bax表达显著增多,且TNF-α、IL-1β等细胞因子和iNOS表达也显著增多[2,13]。这表明NF-κB在AD病理情况下,很可能主要起促炎促凋亡的作用。
综上所述,H102能有效地减少AD模型小鼠脑内Aβ的表达,减少β折叠的形成,提高AD模型鼠的学习记忆能力,可能与其抑制NF-κB信号通路的激活,促使iNOS和活化的Caspase 3的表达下调有关。但由于NF-κB功能的多向性,其在AD的病理过程中所处的具体位置及作用,还有待进一步研究。
[1]McGeer PL,McGeer EG.The amyloid cascade-inflammatoryhypothesis of Alzheimer disease:implications for therapy[J].Acta Neuropathol,2013,126(4):479-497.
[2]孙凤仙,王 曼,徐艳玲,等.β片层阻断肽联合人脐带间充质干细胞对APP转基因鼠的治疗作用[J].中国应用生理学杂志 ,2013,29(3):239-244.
[3]徐艳玲,赵 娟 ,马瑞珏,等.H102对APP转基因小鼠脑内淀粉样蛋白和淀粉样蛋白前体蛋白表达的影响[J].中国应用生理学杂志,2010,26(3):302-306.
[4]王冰艳,孙凤仙,林来祥,等.β片层阻断肽H102对PAP小鼠脑内ERK信号转导通路的影响[J].天津医药,2014,42(7):650-653.
[5]O'Neill LA,Kaltschmidt C.NF-kappa B:a crucial transcription factor for glial and neuronal cell function[J]. Trends Neurosci,1997,20(6):252-258.
[6]Kuperstein I,Broersen K,Benilova I,etal.Neurotoxicity of Alzheimer's disease Aβpeptides is induced by small changes in the Aβ42 to Aβ40 ratio[J].EMBO J,2010,29(19): 3408-3420.
[7]Akama KT,Albanese C,Pestell RG,et al.Amyloid betapeptide stimulatesnitric oxide production in astrocytes through an NFkappaB-dependentmechanism[J].Proc NatlAcad Sci USA,1998,95(10):5795-5800.
[8]Buggia-Prevot V,Sevalle J,Rossner S,et al.NFkappaB-dependent control of BACE1promoter transactivation by Abeta42[J].JBiol Chem,2008,283(15):10037-10047.
[9]Wang R,Chen S,Liu Y,et al.All-trans-retinoic acid reduces BACE1 expression under inflammatory conditions via modulation of nuclear factorκB(NFκB)signaling[J].JBiol Chem,2015,290(37):22532-22542.
[10]甄 娜.阿托伐他汀通过抑制NF-κB/P65信号通路及BACE1生成对AD大鼠模型的影响[D].石家庄:河北医科大学,2013.
[11]黄文林,朱孝峰 .信号转导与疾病[M].北京:人民卫生出版社,2012:447-456.
[12]吕 诚 ,胡小令,万 斌,等.雷公藤内酯醇对阿尔茨海默病模型大鼠学习记忆和海马核因子-κB表达的影响[J].中国老年学杂志,2009,29(17):2186-2188.
[13]Lin LX,Bo XY,Tan YZ,et al.Feasibility ofβ-sheet breaker peptide-H102 treatment for Alzheimer's disease based onβ-amyloid hypothesis[J].PLoS One.2014,9 (11):e112052.
The effects of H102 on NF-κB signal pathway in brain of transgenic AD mice
WANG Chao,YUAN Xiao-yong,SUN Feng-xian,JIANG Fang,XU Shu-mei△
(Departmentof Physiology,Tianjin Medical University,Tianjin 300070,China)
【ABSTRACT】Objective:To investigate the effects ofβ-sheetbreaker peptide H102 on NF-κB signal pathway in brain of APP/PS1 double transgenicmice.Methods:Thirty 8-week-old APP/PS1 double transgenicmicewere randomly divided intomodelgroup and treatmentgroup. A group of C57BL/6Jmicewith the same age and backgroundwere served as controls(n=15).H102 5μl(5.8mg/kg)was infused by intranasal administration tomice in H102 treatmentgroup,and equal volume of blank solution of H102(chitosan,BSA)was given tomice in control group andmodelgroup.After 16 weeks,the ability of spatial referencememorywas tested by MorrisWaterMaze.Then immunohistochemistry tests and Western blot techniquewere used to detect the contentof amyloid beta peptide 1-42(Aβ1-42),nuclear factor-kappa B(NF-κB),inhibitor of NF-κB(IκB),IκB kinase(IKK),the corresponding phosphorylated proteins(p-NF-κB、p-IκB、p-IKK),inducible nitric oxide synthase(iNOS)and cleaved Caspase 3 proteins inmice brain.Results:①The ability of learning andmemorywas significantly lowered in model group than that in controlgroup.And theability of learning andmemorywassignificantly improved in treatmentgroup than that inmodel group(P<0.05).②The contentsof Aβ1-42,p-IKK,p-NF-κB,p-IκB,intranuclearNF-κB,iNOSand cleaved Caspase 3 inmousebrainwere significantly increased inmodel group than those of control group,and these protein expressionswere significantly lowered in treatmentgroup than those inmodelgroup(P<0.05).Conclusion:H102 can inhibitNF-κB signalpathway in brain of APP/PS1 double transgenicmice,reduce the levels of inflammation and apoptosis in nerve cells,and improve the ability of learning andmemory in transgenic ADmice.
Alzheimer disease; mice; transgenic; H102; NF-κB signal pathway
R338.8
A
1000-6834(2016)03-193-05
国家科技重大专项基金资助(2009ZX09103-029);天津市科技支撑重点项目基金资助(09ZCKFSH00100)
2016-01-08
2016-02-11
Tel:13012268139;E-mail:xushm@tijmu.edu.cn
