不同光周期对不同季节无蹼壁虎室旁核精氨酸催产素表达的影响*
2016-09-15王志超朱秀玲杨惠琴赵劲松鲁亚平
王志超,韩 菲,朱秀玲,杨惠琴,赵劲松,鲁亚平△
不同光周期对不同季节无蹼壁虎室旁核精氨酸催产素表达的影响*
王志超1,2,韩 菲1,朱秀玲3,杨惠琴1,赵劲松3,鲁亚平1△
(1.安徽师范大学生命科学学院 ,芜湖241000;2.塔里木大学动物科技学院 ,新疆 阿拉木843300;3.皖南医学院解剖学教研室 ,安徽芜湖241000)
目的:比较不同光周期、季节、温度对精氨酸催产素(AVT)在无蹼壁虎室旁核(PVN)昼夜表达的影响。方法 :将216条雄性成体无蹼壁虎分为活动期组和打破冬眠组,每组再分为3个光周期组 ,每组昼夜分6个时间点取样 ,分别对AVT免疫组化阳性细胞在PVN的分布进行观察和统计。结果:不同光周期下,AVT阳性细胞数在无蹼壁虎PVN均呈现明显的昼夜节律变化,但变化的时相和幅度均有区别。结论 :AVT可能作为PVN输出和整合信号参与调控无蹼壁虎的昼夜节律。
无蹼壁虎;昼夜节律;精氨酸催产素;室旁核
【DOI】10.13459/j.cnki.cjap.2016.03.004
生物体的许多生化、生理和行为指标都呈现昼夜节律性波动。研究显示,昼夜节律多是受一种内源性的“振荡器”或“生物钟”驱动。昼夜节律钟通过中枢系统和外周系统相互协调使机体昼夜节律保持与环境同步,这对于生物体对环境的适应、健康和疾病都非常重要[1]。在哺乳动物,通常认为视交叉上核(SCN)是中枢系统中的核心成分,下丘脑室旁核(paraventricular nucleus,PVN)是介导光周期现象不可或缺的成分;而在爬行动物,多认为松果体是中枢系统中的核心成分[2],PVN在介导光周期现象中的作用尚不清楚。
目前普遍认为精氨酸加压素(arginine vasopressin,AVP)为哺乳动物生物钟系统的重要而稳定的输出信号和整合信号[3],不同光周期下在SCN的表达均呈现昼夜节律性。精氨酸催产素(arginine vasotocin,AVT)作为AVP在爬行动物的同源物,在爬行动物下丘脑PVN是否呈现节律性表达尚未见报道。无蹼壁虎(Gekko swinhonis)在我国广泛分布 ,近年来被广泛用作实验动物用于行为学、生理学和神经科学的研究。本研究试图比较不同光周期、季节、温度对AVT在无蹼壁虎PVN昼夜表达的影响,进一步探讨爬行动物昼夜节律的调控机制。
1 材料与方法
1.1 实验材料
无蹼壁虎雄性成体(全长110~120 mm),购买于山东省济南九顶山特种动物养殖公司,实验室面包虫喂养,水、食物自由摄取。
1.2 实验分组
7月份购入的壁虎,选择108条作为活动期组(AC)。AC组再分为DL(Dark:18:00-6:00,暗室内黑厚窗帘布遮光;Light:6:00-18:00,350以上流明强光灯悬于2.2m左右处)、DD(Dark-Dark:18:00-6:00-18:00)、LL(Light-Light:18:00-6:00-18:00)三组,每组36只,设定温度平均为(25±3)℃,两周后,各组分别在7:00,11:00,15:00,19:00,23:00,3:00各取6只断头取脑。12月份购入的壁虎,选择108条作为打破冬眠期组(IH)。IH组同样分DL、DD、LL三个光周期组,每组36只,设定温度平均为(15±3)℃,两周后,各组分别在7:00,11:00,15:00,19:00,23:00,3:00各取6只断头取脑。所有脑组织迅速固定于新配制的4%多聚甲醛磷酸缓冲液(PBS PH 7.4)中 ,过夜后梯度酒精脱水,常规石蜡包埋,连续冠状切片(6 μm)。
1.3 免疫组织化学
切片脱蜡至水,置3%H2O2 PBS液中30min消除内源性过氧化物酶活性;微波抗原修复2×10min;5%正常羊血清(Vector公司)孵育20min封闭非特异性反应;一抗兔抗AVP (Truus公司 ,1∶400)37℃孵育1 h后于4℃冰箱过夜;二抗羊抗兔(Vector公司,1∶200),37℃温育1 h;ABC复合物(Vector公司ABC kit,1∶200)37℃孵育1 h;DAB显色;苏木素染液复染。阴性对照片以0.01mol/L PBS代替一抗进行孵育,其余步骤同上。
1.4 阳性细胞计数
壁虎下丘脑连续切片,AVT免疫组织化学染色,观察确定室旁核前后各一张切片:阳性细胞数为5±1个,然后在这两张切片之间等间隔取5张切片进行计数,以估算室旁核AVT阳性细胞数。
1.5 统计分析
Nikon E800u显微镜观察、拍照。Metamorph生物图像分析软件(Universal Imaging Corp.,美国)定量分析相关形态学参数,人工统计阳性细胞数。统计数值用均数±标准差(±s)表示,SPSS 17.0进行ANOVA分析并作图。
2 结果
AVT免疫阳性细胞主要分布在无蹼壁虎下丘脑的视上核(SON)和PVN(图1,见彩图页Ⅱ),在下丘脑外侧区、前脑外侧束、室周核等处可见零散的分布。统计表明,无蹼壁虎视上核AVT免疫阳性细胞数目在不同时间点无明显变化。
2.1 AC组和IH组室旁核AVT阳性细胞的昼夜节律性变化
在DL、DD、LL不同光周期下,AC组和IH组无蹼壁虎室旁核在不同时间点AVT阳性细胞数统计见表1,均呈现明显的昼夜节律性变化(AC组:分别为F=25.209,P<0.01;F= 177.282,P<0.01;F=62.671,P<0.01;IH组:分别为F= 20.188,P<0.01;F=136.494,P<0.01;F=45.914,P<0.01)。
Tab.1 AVT-ir cells in the PVN of Gekko swinhonis during different photoperiods in AC group and IH group(±s)

Tab.1 AVT-ir cells in the PVN of Gekko swinhonis during different photoperiods in AC group and IH group(±s)
AC:Active group;IH:Interfered hibernation group;DL:Dark-Light,11∶00 as a comparison reference;DD:Dark-Dark,19∶00 as a comparison reference;LL:Light-Light,15∶00 as a comparison reference*P<0.05
Group Time points 7:00 11:00 15:00 19:00 23:00 03:00 AC DL 137.0±7.5* 94.0±18.4 107.0±3.6 124.0±5.8* 143.0±6.3* 127.0±4.2*DD 76.0±9.4* 129.0±6.4* 170.0±10.3* 200.0±8.3 93.0±7.3* 132.0±8.4*LL 78.0±9.7* 130.0±9.9 138.0±7.6 143.0±8.7 88.0±9.7* 92.0±7.2*IH DL 107.0±5.8* 70.0±7.9 95.0±8.9* 100.0±6.4* 105.0±5.5* 92.0±9.1*DD 87.0±5.0* 120.0±5.8* 142.0±6.2* 171.0±8.9 86.0±7.6* 123.0±6.9*LL 58.0±9.6* 113.0±9.8* 148.0±9.8 106.0±12.1* 94.0±10.9* 98.0±11.1*
2.2 在DL光周期下AC组与IH组无蹼壁虎室旁核AVT阳性细胞昼夜节律性比较
DL光周期下,AC组和IH组阳性细胞数分别在23∶00和7∶00达最大值(bonferroni test,P<0.001),又分别在7∶00和23∶00出现另一个高峰,而最小值则均出现在11∶00。如图2所示,AC组和IH组在DL光周期下曲线趋势基本一致。所不同的是AC组曲线整体在IH组之上,AC组标准差XDL= 122.22,SDL=19.28;IH组XDL=94.83,SDL=14.17,独立样本方差检验显示 P<0.01,两组间差异显著。
2.3 在DD光周期下AC组与IH组无蹼壁虎室旁核AVT阳性细胞昼夜节律性比较
DD光周期下,AC组和IH组阳性细胞数在19∶00时均达最大值(bonferroni test,P<0.001),分别在7∶00和23∶00达最小值,23∶00和7∶00左右分别出现一个低谷。如图3所示,在DD光周期下AC组和IH组曲线趋势基本一致。统计显示,AC组标准差XDD=133.39,SDD=43.35;IH组XDD=121.40,SDD=30.90,独立样本方差检验显示 P=0.182>0.05,两组间差异并不显著。
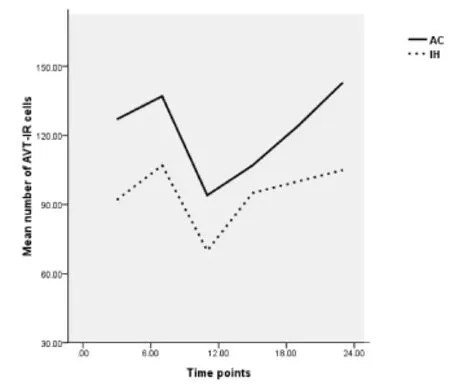
Fig.2 Comparison of circadian changes of AVP-ir cells in the PVN of Gekko swinhonis during DL photoperiod between AC group and IH group
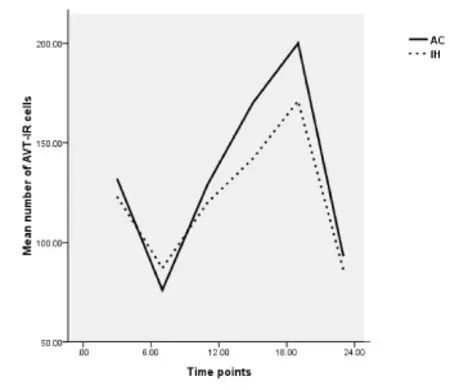
Fig.3 Comparison of circadian changes of AVP-ir cells in the PVN of Gekko swinhonis during DD photoperiod between AC group and IH group
2.4 在LL光周期下AC组与IH组无蹼壁虎室旁核AVP阳性细胞昼夜节律性比较
LL光周期下,AC组和IH组阳性细胞数分别在19∶00和15∶00达最大值(Bonferroni test,P<0.01),均在7∶00达最小值。如图4所示,在LL光周期下AC组和IH组曲线变化趋势也基本一致。统计分析表明AC组标准差XLL=111.45,SLL=27.78;IH组XLL=102.58,SLL=28.78,独立样本方差检验显示 P=0.188>0.05,两组间差异也不显著。
3 讨论
目前认为昼夜生物钟机制可从振荡器 (Oscillator)、信号输入和信号输出等角度加以研究。在确定振荡器主控成分时 ,“振荡器成分的数量和活动必定呈昼夜节律振荡,且这种振荡也可被授时因子导引”是其重要的准则。

Fig.4 Comparison of circadian changes of AVP-ir cells in the PVN of Gekko swinhonis during LL photoperiod between AC group and IH group
研究显示,实验性双侧毁损SCN可使哺乳动物一系列生理行为和活动的昼夜节律完全丧失[4]。大多数学者认为,SCN的AVP神经元是哺乳动物内源性起搏神经元,对中枢神经系统机能的稳定和机体昼夜生物节律的稳定具有重要作用。然而,如同其它非哺乳类脊椎动物一样,爬行动物SCN结构是否存在目前仍然倍受争议。一方面,脊椎动物脑区的解剖与命名没有统一的标准,使得目前脑区的解剖学名称混乱,另一方面目前尚没有SCN特异性标记物。在大壁虎(Gekko gecko),该核团曾被描述为室周视前区(PPA)或下丘脑室周核(PH)或PVN。在哺乳动物,AVP阳性细胞在胚胎期13 d最先出现在间脑的第三脑室两侧,出生后1 d出现在SON,出生后3天开始出现在PVN,出生后15~20 d才开始出现在SCN[5]。鸟类胚胎发育研究也显示,下丘脑AVT能神经元最先出现在第三脑室的室周区,随后向背侧迁移形成室周核(室旁核),再向腹侧迁移形成外侧视上核和中央视上核(相当于SCN)[6]。这提示下丘脑中SCN在系统发生上较晚。我们的尼氏染色显示,无蹼壁虎在视交叉的上方、第三脑室腹侧的视前区与下丘脑的过渡区并未发现明显的SCN结构,仅在视交叉上方第三脑室腹侧可见一个较大的核团(PVN),AVT免疫阳性细胞主要分布在该核团的背内侧(图1),结合其位置及纤维投射特点分析,提示无蹼壁虎脑区可能尚未分化形成真正的SCN,即无蹼壁虎的PVN可能具有哺乳动物PVN和SCN的双重功能。
一般认为 ,在哺乳动物中,光信号与非光信号都可对生物钟的调定产生影响[7]。当外界明-暗环境突然变化,昼夜节律的波将发生明显的时相迁移,这种特异反应称为生物钟的重设定[7,8]。研究发现光信号只有在自主昼夜节律的夜间相才可以提前或延迟生物钟的重设定[7]。我们的研究表明,与哺乳动物SCN的AVP免疫阳性细胞数变化类似,无蹼壁虎PVN的AVT免疫阳性细胞数,无论是AC组还是IH组,在DL或DD或LL光周期下,均呈现明显的昼夜节律性;且在AC组和IH组的组内 ,与DD和LL光周期比较 ,在DL光周期下的时相向后延迟了4 h,波幅也较小。这也进一步印证了无蹼壁虎PVN可能具有类似哺乳动物SCN的功能。
温度是爬行动物自由活动度重要的限制因子,也是爬行动物昼夜节律调控的一种重要的授时因子。Bons等[9]研究发现温度(冷)处理可使沙蜥等爬行动物室旁核的AVT含量明显下降。这与我们的结果基本一致。比较AC组和IH组无蹼壁虎PVN的AVT免疫阳性细胞数昼夜节律性变化可以看出,无论在DL、DD或LL光周期下,其节律变化曲线趋势基本一致。但是在DL光周期下,AC组较IH组变化曲线整体上升,独立样本方差检验显示两者之间差异显著(P<0.01);而在DD和LL光周期下,这种差异性不明显(P>0.05)。在我们的实验中,IH组动物均于(15±3)℃下适应了2周,较AC组温度低了10℃左右。但温度似乎在不同的光周期下对AVT的昼夜节律表达形成不同的影响,提示温度可能要在光因子的协同作用下才能发挥其授时因子的作用,进而对爬行动物的昼夜节律进行调节。
垂体后叶激素是一类广泛存在于脊椎动物各等级类群的保守性很强的激素[10],AVT在无蹼壁虎PVN不同光周期的昼夜节律性表达,很可能在昼夜节律中起着与AVP在哺乳动物生物钟中类似的功能,即是一种重要而稳定的输出信号和整合信号,参与调控爬行动物的昼夜节律。但AVT在爬行动物昼夜节律调控中的确切作用还有待进一步验证。
[1]Merbitz-Zahradnik T,Wolf E.How is the inner circadian clock controlled by interactive clock proteins?Structuralanalysisof clock proteins elucidates their physiological role[J]. FEBSLett,2015,589(14):1516-1529.
[2]Woolley SC,Sakata JT,Crews D.Evolutionary insights into the regulation of courtship behavior inmale amphibians and reptiles[J].Physiol Behav,2004,83(2):347-360.
[3]HastingsMH,Reddy AB,Maywood ES.A clockwork web: circadian timing in brain and periphery,in health and disease [J].NatRev Neurosci,2003,4(8):649-661.
[4]Refinetti R.The circadian rhythm of body temperature[J]. Front Biosci,2010,15:564-594.
[5]Iqbal J,Jacobson CD.Ontogeny of arginine vasopressin-like immunoreactivity in the Brazilian opossum brain[J].Brain ResDev Brain Res,1995,89(1):11-32.
[6]Arnold-Aldea SA,Sterritt C.Sites of origin and patterns of migration of vasotocin/mesotocin neurons in developing brain of the chick[J].JNeurobiol,1996,31(1):103-116.
[7]ShigeyoshiY,TaguchiK,Yamamoto S,et al.Light-induced resetting of amammalian circadian clock is associated with rapid induction of themPer1 transcript[J].Cell,1997,91 (7):1043-1053.
[8]Thresher RJ,Vitaterna MH,Miyamoto Y,et al.Role of mouse cryptochrome blue-light photoreceptor in circadian photoresponses[J].Science,1998,282(5393):1490-1494.
[9]Bons N.Immunocytochemical identification of themesotocin and vasotocin-producing systems in thebrain of temperateand desert lizard species and theirmodifications by cold exposure [J].Gen Comp Endocrinol,1983,52(1):56-66.
[10]Albers HE.Species,sex and individual differences in the vasotocin/vasopressin system:relationship to neurochemicalsignaling in the social behavior neuralnetwork[J].FrontNeuroendocrinol,2015,36(1):49-71.
Gekko swinhonis; circadian rhythm; arginine vasotocin; paraventricular nucleus
Q955,Q416
A
1000-6834(2016)03-206-04
国家自然科学基金资助项目(30470537);重要生物资源保护与利用研究安徽省省级重点实验室;生化与分子生物学省级重点学科;安徽高校省级自然科学研究重大项目
(ZD2008006-1)
2015-03-09
2015-11-02
Tel:0553-3869297;E-mail:yplu@mail.ahnu.edu.cn,50116113@qq.com
