响应面法优化鸡胸肉肌原纤维蛋白酶法水解工艺条件
2016-09-12白腾辉马亚萍康壮丽潘润淑马汉军
白腾辉,马亚萍,康壮丽,潘润淑,马汉军
(河南科技学院食品学院,河南新乡 453003)
响应面法优化鸡胸肉肌原纤维蛋白酶法水解工艺条件
白腾辉,马亚萍,康壮丽,潘润淑,马汉军*
(河南科技学院食品学院,河南新乡 453003)
以鸡胸肉为原料,提取肌原纤维蛋白,测定其蛋白质浓度及氨基酸组成;以水解度为测定指标,利用响应面法优化该肌原纤维蛋白酶解工艺条件,并考察其产物肽分子量分布。结果表明:提取的肌原纤维蛋白浓度为59.27%;该蛋白氨基酸种类齐全,组成比例均衡,必需氨基酸含量高达40.90%;碱性蛋白酶是肌原纤维蛋白酶解的最佳用酶;在单因素实验基础上,经Box-Behnken实验优化得到碱性蛋白酶水解肌原纤维蛋白最佳工艺条件为:加酶量3500 U/g、pH7.8、温度44 ℃,此条件下经6 h酶解,水解度达33.17%;肽分子量分布分析知,最佳水解条件下酶解液中<1000 Da的小肽含量高达61.5%,说明碱性蛋白酶能较高程度的水解肌原纤维蛋白。
肌原纤维蛋白,酶解,响应面法,蛋白质提取率,水解度
鸡肉是增长速度快、供应足、物美价廉的优质肉类,以肉质柔软、高蛋白、低脂肪、低胆固醇和低热量等著称,且肉性偏温,有补气、调髓补精等功效,是理想的动物性蛋白来源[1]。据美国农业部统计,2013年中国鸡肉产量约1400万t,已成为世界第二大鸡肉生产、消费和贸易国家[2]。然而,中国用于深加工的鸡肉量还不足总量的6%,且存在着产品种类较少、科技含量低、附加值低等不足,缺乏行业抗风险能力及在国际市场上的竞争力[3],因此发展鸡肉的精深加工迫在眉睫。最新研究表明,鸡肉蛋白经酶法水解,是改善鸡肉消化吸收率和综合利用效率的有效途径之一。如Rojas等研究发现蛋白质经酶解后的消化吸收率显著提高[4],Saiga等从鸡胸肉酶解产物中分离出降血压肽[5],Seth等报道了鸡肉酶解物促铁吸收功效和机理研究[6],国内刘改英等采用响应面法优化了复合蛋白酶水解鸡肉蛋白的工艺[7],赵谋明等系统研究了以鸡肉蛋白酶解物通过Maillard反应制备风味香精的方法[8-10]。
有研究表明,从肌肉中提取出蛋白质再水解,可更好的获取酶解产物中的功能性成分[11-12];而Mohr等也发现鱼肉中大部分水溶性蛋白热变性后不利于被酶作用转化成可溶性氮[13]。所以,从鸡肉中提取出肌原纤维蛋白,再经蛋白酶解水解是提高酶解效率的有效途径。然而,目前国内外在蛋白酶解方面研究多采用单一酶对鸡肉或鸡肉蛋白进行水解。有鉴于此,本实验以鸡胸肉为原料提取肌原纤维蛋白,分析了该蛋白的氨基酸组成,筛选了其水解最佳用酶,通过单因素和响应面实验对最优酶酶解肌原纤维蛋白酶解的工艺条件进行优化,并以酶解液肽分子量分布评估其酶解效果,以期为鸡肉蛋白酶解的机理研究及酶解产物生物活性肽的制备提供一定的参考。
1 材料与方法
1.1材料与仪器
鸡胸肉当地超市;胰蛋白酶酶活力250 U/mg,aladdin,上海晶纯生化科技股份有限公司;胃蛋白酶酶活力15000 U/mg,aladdin,上海晶纯生化科技股份有限公司;木瓜蛋白酶酶活力≥3 U/mg,aladdin,上海晶纯生化科技股份有限公司;碱性蛋白酶酶活力≥200 U/mg,Solarbio,北京索莱宝科技有限公司;中性蛋白酶酶活力≥60 U/mg Solarbio,北京索莱宝科技有限公司;甲醛、盐酸、氢氧化钠、磷酸盐等,实验中所用化学试剂均为分析纯。
FA224型电子天平上海舜宇恒平科学仪器有限公司;79-1磁力加热搅拌器江苏正基仪器有限公司;SHA-C数显水浴恒温振荡器江苏省金坛市华峰仪器有限公司;电子万用炉北京光明医疗仪器厂;PHS-3C型精密pH计上海雷磁仪器厂;Waters 600高效液相色谱仪 USA;KjeltecTM8400全自动凯氏定氮仪,FOSS Denmark;MULTIFUGE XIR型冷冻离心机,Thermo German等。
1.2实验方法
1.2.1肌原纤维蛋白的提取参照Wonnop Visessanguan等[14]的方法:取鸡胸肉20 g,加入10倍体积磷酸酸盐缓冲液A(15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4,pH7.5),组织捣碎机10000 r/min下均质1 min,匀浆在冷冻离心机中离心(5000 r/min,15 min),此提取过程重复操作二次。取上清液部分,加入50% TCA使上清液最终TCA浓度达到10%,离心机中5000 r/min离心15 min,上清液部分为非蛋白氮,沉淀部分为肌浆蛋白。在沉淀部分加入10倍体积磷酸酸盐缓冲液B(0.45 mol/L KCl,15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4,pH7.5)于组织捣碎机中10000 r/min下均质1 min,匀浆在离心机中离心(5000 r/min,15 min),此提取过程重复操作二次,合并上清液得盐溶部分,即肌原纤维蛋白。并用微量凯氏定氮法[15]测定提取出的肌原纤维蛋白浓度。
1.2.2肌原纤维蛋白氨基酸组成分析将样品置于水解管中,加入6 mol/L 的HCl溶液,真空封口,在110 ℃下水解24 h,冷却后定容、过滤、蒸干,再加入0.02 mol/L的HCl溶液在空气中放置30 min,采用HPLC测定除色氨酸以外的氨基酸含量,检测条件:美国Waters高效液相色谱,PICO.TAG氨基酸分析柱,柱温38 ℃,流速1 mL/min,检测波长254 nm。
1.2.3酶解工艺流程称取肌原纤维蛋白1 g→溶于50 mL磷酸盐缓冲液B(详见1.2.1)→调pH→加定量酶→恒温水浴震荡酶解→沸水浴灭酶10 min→冷却至室温→6000 r/min 4 ℃离心20 min→取上清液→测定各指标。
操作要点:
定量酶的加入:依据实验设计,以“酶量/底物蛋白”,即“U/g”的形式,并参考生产商推荐的各酶酶活力来加入定量的水解酶。
恒温水浴震荡酶解:酶解开始前将加入的酶均匀混入酶解反应体系。
1.2.4水解酶的选择分别采用胰蛋白酶、胃蛋白酶、木瓜蛋白酶、碱性蛋白酶及中性蛋白酶对提取的肌原纤维蛋白按照1.2.3的步骤进行水解,各酶作用条件根据厂家推荐参数(见表1)。通过水解度、蛋白质提取率、水解液风味及外观来确定肌原纤维蛋白酶解的较佳用酶。

表1 各酶较适宜的水解条件[16]
1.2.5单因素实验
1.2.5.1加酶量对酶解效率的影响取1.2.4中肌原纤维蛋白酶解的较佳用酶,在2%的肌原纤维蛋白液中加入1000、2000、3000、4000、5000 U/g的蛋白酶,对酶解液的水解度和蛋白质提取率进行分析,酶解体系的pH8.5、酶解温度50 ℃、酶解时间4 h。
1.2.5.2pH对酶解效率的影响以1.2.5.1中优化的最佳酶浓度,调节反应体系的pH分别为7.0、7.5、8.0、8.5、9.0,分析各组酶解液的水解度和蛋白质提取率,酶解温度50 ℃、酶解时间4 h。
1.2.5.3酶解温度对酶解效率的影响以1.2.5.1中优化的最佳酶浓度,并按1.2.5.2优化的最佳pH调节反应体的pH,分别在35、40、45、50、55 ℃的环境下对各反应组进行4 h的水解,分析不同酶解温度对各组酶解液的水解度和蛋白质提取率。
1.2.5.4酶解时间对酶解效率的影响在1.2.5.1、1.2.5.2与1.2.5.3优化的最佳酶解条件下,对酶解体系进行2、4、6、8、10 h水解,以酶解液的水解度和蛋白质提取率为测定指标,确定较佳酶解时间。
1.2.6响应面实验设计在单因素实验的基础上,根据Box-Behnken设计原理,以肌原纤维蛋白酶解过程中的水解度为响应值,选取加酶量、pH及温度为影响因子,进行3因素3水平响应面实验,确定肌原纤维蛋白酶解的最佳工艺参数。实验因素水平表见表2。
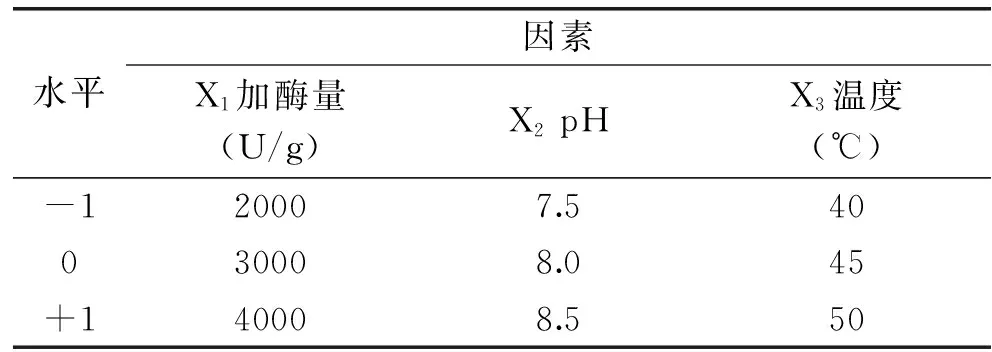
表2 响应面实验因素水平编码表
1.2.7肌原纤维蛋白的水解度测定采用甲醛滴定法[17],取离心后的肌原纤维蛋白酶解液5 mL于100 mL容量瓶中,定容、混匀后取20 mL于200 mL烧杯中,加入60 mL去CO2水,用0.05 mol/L标准NaOH溶液滴定至pH 8.2。加入10 mL甲醛溶液,混匀后再用0.05 mol/L标准NaOH溶液继续滴定至pH9.2,同时用蒸馏水代替酶解液做空白对照。记录所消耗的标准NaOH溶液的体积,计算肌原纤维蛋白的水解度(DH)。
式中,c为标准NaOH溶液浓度,mol/L;V1为样品消耗氢氧化钠标准滴定溶液的体积,mL;V2为试剂空白消耗氢氧化钠标准滴定溶液的体积,mL;V3为试剂稀释液取用量,为1mL(5mL酶解液定容100mL后取用20mL);S为底物蛋白浓度,2%;W为提取的肌原纤维蛋白的纯度,凯氏定氮法测得59.27%;htot为蛋白质中肽键总数,由2.1肌原纤维蛋白氨基酸组成测得,为7.54mmol/g。
1.2.8蛋白质提取率的测定以上清液中总蛋白质量和底物蛋白质量的百分比表示,即:
蛋白质提取率F(%)=(W1×6.25)/W2×100
式中:W1为酶解物上清液中的总氮含量;6.25为肉类蛋白的蛋白质转换系数;W2为酶解前肌原纤维蛋白含量,总氮含量及蛋白质含量均采用微量凯氏定氮法测定。
1.2.9酶解液肽分子量分布的测定采用Waters600 高效液相色谱仪(配2487紫外检测器和Empower工作站GPC软件)分析,标准肽样品:CytochromeC(MW12384)、Bacitracin(MW1450)、Gly-Gly-Tyr-Arg(MW451)、Gly-Gly-Gly(MW189)。为TSKgel2000SWXL300mm×7.8mm的分离柱,柱温:30 ℃。吸取样品2mL于10mL容量瓶中,用流动相稀释至刻度,用微孔过滤膜过滤后供进样。检测波长为220nm,最大压力为2.0MPa。流动相:乙腈/水/三氟乙酸,45/55/0.1(V/V),流速为 0.5mL/min。
1.3数据处理与分析
所有实验重复三次,采用Spss17.0和DesignExpert7.0对各实验数据进行统计学分析,并用Origin7.0对各单因素数据作图。
2 结果与讨论
2.1肌原纤维蛋白氨基酸组成分析
蛋白质的氨基酸组成及比例在评价其酶解产物营养价值、风味、加工特性和生理活性等方面起着决定性作用[10,18]。从鸡胸肉中提取肌原纤维蛋白的氨基酸分析结果见表3,从表中可知肌原纤维蛋白的氨基酸种类齐全,组成比例均衡,必需氨基酸(色氨酸在酸水解过程中不稳定而分解,未测定)含量占总氨基酸质量分数的40.90%,高于FAO/WHO推荐的成人理想氨基酸模式(36%),表明鸡肉蛋白是一种优质的动物性蛋白源。

表3 肌原纤维蛋白中的各种氨基酸含量
2.2肌原纤维蛋白水解酶的确定
分别采用胰蛋白酶、胃蛋白酶、木瓜蛋白酶、碱性蛋白酶及中性蛋白酶在各自最适条件下水解定量肌原纤维蛋白,水解结果见表4。
从表4中可以看出,5种酶对肌原纤维蛋白的水解效果因酶切方式的不同而各有差异。从蛋白质提取率方面来看,胃蛋白酶与碱性蛋白酶处理效果显著(p<0.05),优于中性蛋白酶、木瓜蛋白酶及胰蛋白酶;五种蛋白酶在水解度方面差异不显著,其原因可能是该蛋白水解产物中氨基酸态氮含量相近;而从酶解液风味外观来看,各蛋白酶水解肌原纤维蛋白后产物均出现味腥味现象,且出现不同程度浑浊,仅胃蛋白酶与碱性蛋白酶感观稍佳;但由于胃蛋白酶属于酸性蛋白酶,对蛋白质溶解度影响较大,加之胃蛋白酶仅作用于肽键两端是芳香族氨基酸的的肽键[19]。综合上述因素,选定碱性蛋白酶为肌原纤维蛋白水解最佳用酶。此与周雪松报道的碱性蛋白酶最适合鸡肉蛋白深度酶解相符[9]。

表4 各酶较适宜条件下水解肌原纤维蛋白的结果
注:实验数据为3次重复实验的平均值,下同。
2.3碱性蛋白酶水解肌原纤维蛋白的单因素实验
根据2.2确定的碱性蛋白酶较适宜水解条件进行酶解单因素实验,以水解度和蛋白质提取率为测定指标,确定各个因素较佳的酶解反应范围。
由图1可知,碱性蛋白酶酶解肌原纤维蛋白的水解度与蛋白质提取率变化趋势相似,二者在1000~5000 U/g的加酶量范围内呈先增加后趋于稳定的趋势,而水解度因酶阻遏效应在酶量过剩时会略降低,二者均在3000 U/g时有较佳效果;酶解液的pH及酶解温度都呈现出先升后降的典型趋势,且分别在pH8.0、45 ℃时较好;在优化好的各条件下,碱性蛋白酶酶解肌原纤维蛋白的水解度和蛋白质提取率均随酶解时间的延长而增加,在6 h以后变化不显著。因此,单因素实验所得碱性蛋白酶酶解肌原纤维蛋白的较佳工艺条件为:加酶量3000 U/g、pH 8.0、温度45 ℃、酶解时间6 h;因酶解效率、经济利益等原因,最佳酶解时间确定为6 h,该因子不参与响应面实验优化。且因蛋白质提取率是从蛋白质层面考虑该蛋白水解效果,而水解度则是从肽键断裂数目层面探讨该蛋白的水解程度,前者受酶解产物中非蛋白氮影响较大,故在后续Box-Behnken优化实验中选择水解度为响应值。

图1 不同加酶量(a)、pH(b)、酶解温度(c)及时间(d)对肌原纤维蛋白水解度及蛋白质提取率的影响Fig.1 The effects of enzyme concentration(a)、pH(b)、hydrolysis temperature(c)and time(d) on degree of hydrolysis(DH)and protein extraction rate(PER)of myofibrillar protein
2.4碱性蛋白酶水解肌原纤维蛋白的响应面优化实验
根据2.3的单因素实验结果,从中选出对实验影响较大的加酶量、pH及温度三个因素为响应因子,并以水解度为响应值,按表1进行3因素3水平的Box-Behnken实验设计,实验设计及结果见表5。由Design Expert 7.0分析软件对表5结果进行回归分析,所得的方差分析结果见表6。
由表6可以看出,模型的p值<0.0001,回归模型极显著;失拟项p=0.1065>0.05不显著,说明该模型拟合度较好,故用该模型对碱性蛋白酶水解肌原纤维蛋白的水解过程进行优化是合适的。根据回归系数,得出肌原纤维蛋白水解度的二次多项回归方程为:DH=0.023152X1+224.506X2+7.0719X3-1.885E-003X1X2+2.245E-004X1X3+0.419X2X3-2.89025E-006X12-14.901X22-0.12421X32-1054.746。回归系数的显著性分析结果表明,X12、X22、X32为极显著项,X1、X3、X1X2和X1X3项显著,其他项均不显著,说明加酶量及温度对水解度的影响较大。由方差分析结果可知,研究范围内的3个因素对水解度影响的主次顺序为:X1>X3>X2,即加酶量>温度>pH。
通过响应面的数字最优组合分析得到碱性蛋白酶水解肌原纤维蛋白的最佳工艺条件为:加酶量3463.4 U/g、pH7.72、温度43.57 ℃,该条件下经6 h酶解,水解度为32.63%。
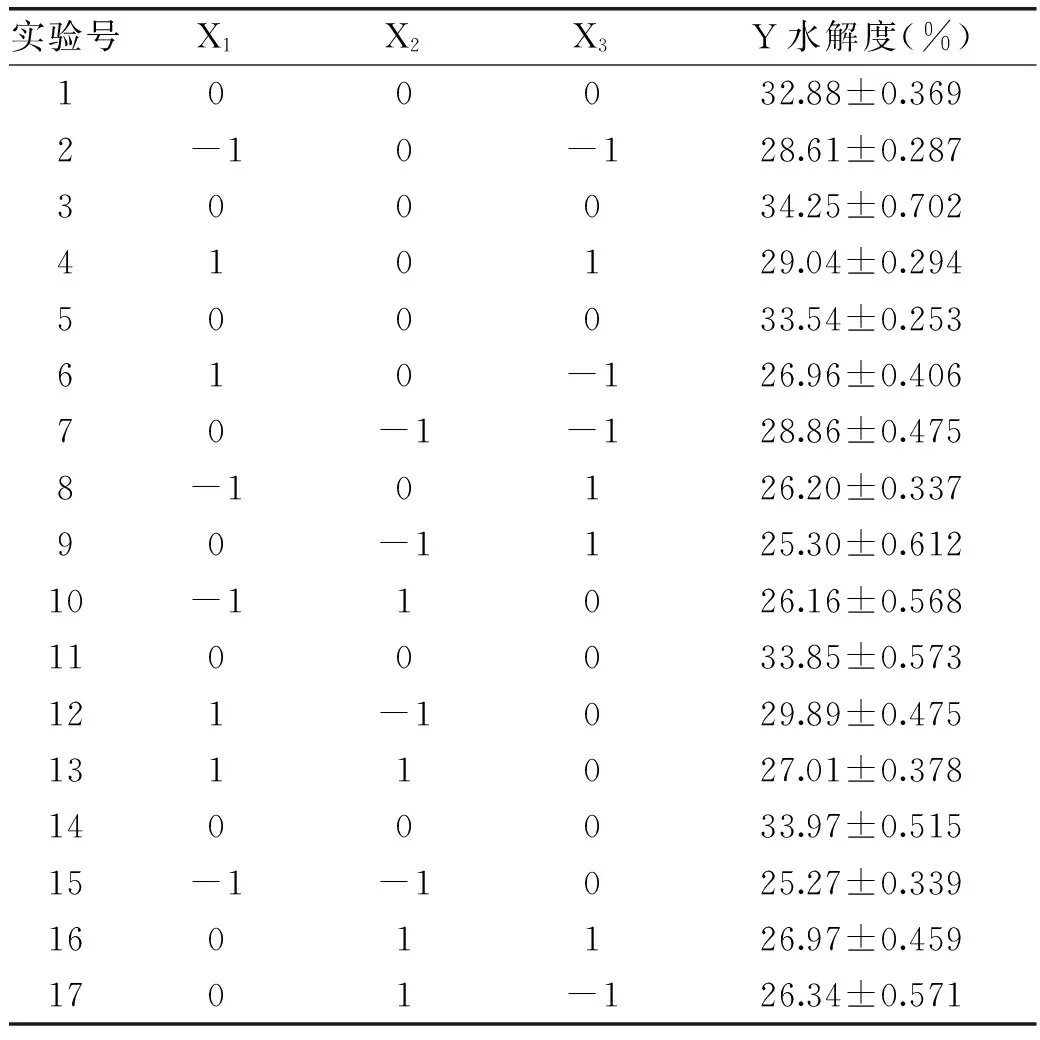
表5 Box-Behnken实验设计及结果
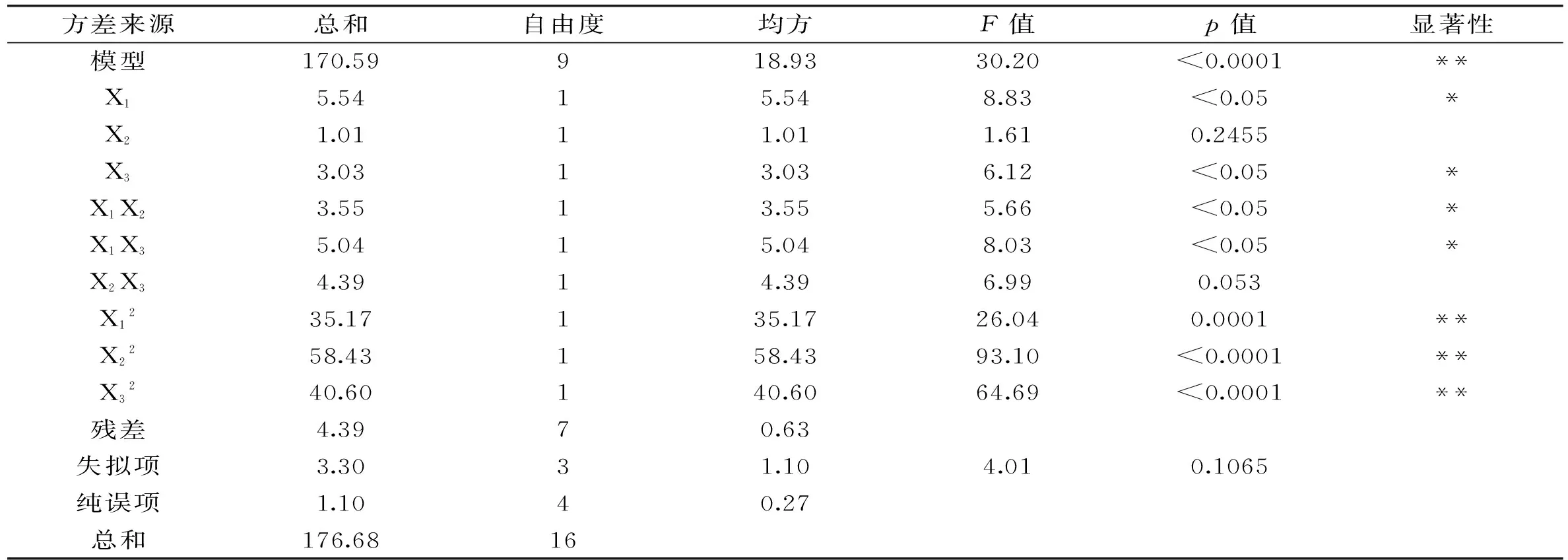
表6 回归模型方差分析表
注:*-显著性(0.01 2.4.1加酶量和pH之间的交互作用的分析图2为加酶量和pH之间的交互作用,加酶量不变时,随着pH的升高,肌原纤维蛋白的水解度先上升后又下降,升高和下降的幅度都很显著(p<0.05);当pH处于较高或较低水平时,加酶量的变化对水解度的影响不大,当pH处于中等水平时,随着加酶量的增大,肌原纤维蛋白的水解度平稳升高后趋于稳定,而在酶量过于充足时水解度因酶阻遏效应而略降低。椭圆形的等高线图说明加酶量与pH间的交互作用显著。等高线沿加酶量轴向方向比pH轴向密集,说明加酶量对肌原纤维蛋白水解程度的影响度比pH的影响大。 图2 酶量和pH对肌原纤维蛋白水解度影响的响应面图Fig.2 Response surface graph of enzyme concentrationand pH on the degree of myofibrillar protein hydrolysis 2.4.2加酶量和温度之间的交互作用的分析加酶量和温度之间的交互作用见图3,由图3可以看出,加酶量与温度之间的交互作用显著。温度一定时,肌原纤维蛋白的水解度随着加酶量的增加呈先上升后趋于稳定的趋势;在较适宜的酶添加量下,水解度随温度的升高呈先升高后下降的趋势。由椭圆形等高线图可知,加酶量与温度间的交互作用显著;且等高线沿加酶量轴向方向较温度的密集,说明加酶量对肌原纤维蛋白水解程度的影响度比温度的影响大。 2.4.3pH和温度之间的交互作用的分析从图4可以看出,当pH不变时,肌原纤维蛋白的水解度随温度的升高而先上升后又下降,且在pH在8.0左右变化最显著(p<0.05);当温度不变时,随pH7.5~8.5之间的增加,肌原纤维蛋白的水解度平稳升高后迅速下降。pH和温度的等高线图接近圆形,说明二者之间的交互作用不显著;等高线沿温度轴向方向比pH轴向稍密集,pH和温度对肌原纤维蛋白水解度的影响度程度相近。 表7 酶解液不同肽分子量分布及含量 图3 酶量和温度对肌原纤维蛋白水解度影响的响应面图Fig.3 Response surface graph of enzyme concentrationand temperature on the degree of myofibrillar protein hydrolysis 图4 pH和温度对肌原纤维蛋白水解度影响的响应面图Fig.4 Response surface graph of pH and temperature on the degree of myofibrillar protein hydrolysis 2.5酶解最佳工艺条件的确定及验证结果 为验证响应面实验的可靠性,采用由Design Expert软件及二次多项回归方程得到的碱性蛋白酶水解肌原纤维蛋白最佳工艺条件(加酶量3463.4 U/g、pH7.72、温度43.57 ℃)对其进行验证。考虑到实验的实际可操作性,将工艺参数中的酶量修正为3500 U/g,pH修正为7.8,水解温度修正为44 ℃。在此条件下水解6 h,三次平行实验所得肌原纤维蛋白水解度为(33.1±0.7697)%,与预测值32.63%差异不显著,说明采用响应面法优化肌原纤维蛋白酶解工艺条件行之有效,具有实用价值。 2.6酶解液肽分子量分布分析 鸡胸肉提取的肌原纤维蛋白以大分子为主,分子量13.8~200 kDa[20-21]。在响应面优化得到的最佳工艺条件下,经碱性蛋白酶水解6 h后,肌原纤维蛋白酶解液肽分子量分布及含量见表7。由表可得,酶解产物分子质量大于3000 Da的组分仅占8.3%,而<1000 Da的小肽含量高达61.5%,说明碱性蛋白酶较高程度的水解了肌原纤维蛋白。 然而,蛋白质酶解是一动态变化的过程,酶解液分子量分布比例仅反映体系中宏观整体的分子量情况,酶解液中寡肽的具体组成需进一步分离鉴定[22-23]。QI M[24]和NAQASH S Y[25]等研究发现小于3 kDa的寡肽组分有较好的生物功能活性,而Bamdad等[26]发现不是分子量越小肽的抗氧化能力越强,只有肽的分子量超过一定临界值时才表现出较强的抗氧化能力。对酶解产物生物活性的分析将是本研究进一步探讨的内容。 鸡胸肉中提取的肌原纤维蛋白浓度为59.27%,该蛋白氨基酸种类齐全,组成比例均衡,必需氨基酸含量达40.90%,是一种优质的动物性蛋白源。水解酶优化实验表明肌原纤维蛋白税额的较佳用酶是碱性蛋白酶。 在单因素实验基础上,经Box-Behnken实验优化并经修正得到肌原纤维蛋白酶法水解的最佳工艺条件为:加酶量3500 U/g、pH7.8、温度44 ℃;此条件下经6 h酶解,水解度为(33.1±0.7697)%,与预测值32.63%差异不显著,说明响应面法能较好的用于肌原纤维蛋白酶解工艺条件的优化,可为鸡肉蛋白酶解的进一步研究以及生物活性肽类产品的开发提供理论依据。肽分子量分布分析发现酶解液中<1000 Da的小肽含量高达60.5%,说明碱性蛋白酶较高程度的水解了肌原纤维蛋白。 [1]高晓平,黄现青,赵改名,等. 水煮中心温度对鸡胸肉食用品质的影响[J]. 食品与机械,2012,28(3):49-51. [2]郭蕾. 亚洲鸡肉产量将占全球产量三分之一[N]. 中国畜牧兽医报,2013-9-22(1). [3]刘登勇,周光宏,徐幸莲. 我国肉鸡加工业的现状及发展趋势[J]. 食品科学,2005,26(11):266-269. [4]Rojas G C R,Ronnestad I. Assimilation of dietary free amino acids,peptides and protein in post-larval Atlantic halibut(Hippoglossus hippoglossus)[J]. Mar Biol,2003,142(4):801-808. [5]Saiga,A.,Okumura,T.,et al. Angiotensin I-converting enzyme inhibitory peptides in a hydrolyzed chicken breast muscle extract[J]. Journal of Agricultural and Food Chemistry[J]. 2003,51(6):1741-1745. [6]Seth,A.,Diaz,M.,Mahoney,R.R. Iron solubilisation by chicken muscle protein digests[J]. Journal of the Science of Food and Agriculture. 1999,79(13):1958-1963. [7]刘改英,潘道东,郭宇星. 响应面法优化复合蛋白酶水解鸡肉蛋白工艺研究[J]. 食品科学,2010,31(20):208-214. [8]赵谋明,曾晓房,崔春,等. 鸡肉蛋白肽-葡萄糖Maillard反应中肽的降解研究[J]. 四川大学学报(工程科学版),2007,39(2):77-81. [9]周雪松. 鸡肉蛋白酶解及其产物抗氧化活性研究[D]. 广州:华南理工大学,2006. [10]赵谋明,曾晓房,崔春,等. 不同鸡肉蛋白肽在Maillard反应中的降解趋势研究[J]. 食品工业科技,2007,28(2):92-95. [11]Saiga A,Tanabe S,Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. J Agric Food Chem,2003(51):3661-3667. [12]Ionescu A,Aprodu I,Darabă A,et al. The effects of transglutaminase on the functional properties of the myofibrillar protein concentrate obtained from beef heart[J]. Meat Science,2008,79(2):278-284. [13]Mohr V. Enzymes technology in the meat and fish industries[J]. Process Biochem,1980,15(32):18-21. [14]Wonnop Visessanguan,Soottawat Benjakul,Siriporn Riebroy,et al. Changes in composition and functionnal properties of proteins and their contributions to Nham characteristics[J]. Meat Sci,2004,66(3):579-588. [15]魏广东. 水产品质量安全检测手册[M]. 北京:中国标准出版社,2005:120-133. [16]黄文涛,胡学智译. 酶应用手册[M]. 上海:上海科学技术出版社,1989:231. [17]GB/T 5009.39-2003,酱油卫生标准的分析方法[S]. 中华人民共和国国家标准,2003. [18]J. Cui,B. Chong,S.M. Rutherfurd,et al. Gross and true ileal digestible amino acid contents of several animal body proteins and their hydrolysates[J]. Meat Science,2013,94(3):349-354. [19]韩仁娇,刘春红,冯志彪. 不同酶切方式对乳清蛋白疏水性和乳化性的影响[J]. 中国乳品工业,2011,39(10):15-22. [20]T. Iwasaki,K. Noshiroya,N. Saitoh,et al. Studies of the effect of hydrostatic pressure pretreatment on thermal gelation of chicken myofibrils and pork meat patty[J]. Food Chemistry,2006,95(3):474-483. [21]Xiong YL. Structure-function relationships of muscle protein[M]//DAMODARAN S,PARAF A. Food protein and their application.New York:Marcel Dekker Inc,1997:341-392. [22]REN Jiaoyan,ZHAO Mouming,SHI J,et al. Optimization of antioxidant peptide production from grass carp sarcoplasmic protein using response surface methodology[J]. LWT-Food Science and Technology,2008,41(9):1624-1632. [23]Jeon Y J,Byun H G,Kim S K. Improvement of functional properties of cod frame protein hydrolysates using ultrafiltration membranes[J]. Process Biochem,1999,35(5):471-478. [24]QI M,HETTIARACHCHY N S,KALAPATHY U. Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J]. Journal of Food Science,1997,62(6):1110-1115. [25]NAQASH S Y,NAZEER R A. Optimization of enzymatic hydrolysis conditions for the production of antioxidant peptides from muscles of Nemipterus japonicus and Exocoetus volitans using response surface methodology[J]. Amino Acids,2012,43(1):337-345. [26]Fatemeh B,Wu J P,Chen L Y. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science,2011(54):20-28. Optimization of enzymatic hydrolysis conditions for myofibrillar protein of chicken breast by response surface methodology BAI Teng-hui,Ma Ya-ping,KANG Zhuang-li,PAN Run-shu,MA Han-jun* (College of Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China) Based on the degree of hydrolysis,enzymatic hydrolysis conditions of the myofibrillar protein extracted from chicken breast was optimized by response surface methodology in this article,the protein content and amino acid composition of the myofibrillar protein and the molecular weight distribution of the hydrolysates were also measured. Results showed that protein content of the extracted myofibrillar was 59.27%,the types and composition ratio of amino acids in this protein was every inch and balanced,the content of essential amino acid reached 40.90%. The best enzyme for hydrolyzing myofibrillar protein was alcalase. On the foundation of single factors experiment,the optimal hydrolysis conditions for myofibrillar protein hydrolyzed by alcalase was obtained as:enzyme concentration 3500 U/g,pH7.8 and temperature 44 ℃ through the Box-Behnken methodology. After hydrolysis for 6 h under the above conditions,the DH reached 33.17%. The content of peptide<1000 Da reached 61.5% by peptide molecular weight distribution,illustrated that myofibrillar proteins hydrolyzed in a high degree by alcalase. myofibrillar protein;enzymatic hydrolysis;response surface methodology;protein extraction rate;degree of hydrolysis 2015-04-07 白腾辉(1988-),男,硕士,研究方向:农产品加工及贮藏工程,E-mail:th2012ky@163.com。 马汉军(1965-),男,博士,教授,主要从事农产品深加工研究,E-mail:xxhjma@126.com。 农业部公益性行业科研专项(201303083);河南省高校科技创新团队支持计划资助(13IRTSTHN006)。 TS252.1 A 1002-0306(2016)01-0000-00 10.13386/j.issn1002-0306.2016.01.000



3 结论
