辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌患者癌痛的有效性及安全性研究
2016-07-25穆守印
穆守印
·药物与临床·
辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌患者癌痛的有效性及安全性研究
穆守印
066500河北省秦皇岛市青龙县医院
【摘要】目的探讨辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌患者癌痛的有效性及安全性。方法选取2013年1月—2015年6月秦皇岛市青龙县医院收治的晚期肺癌癌痛患者80例,随机分为对照组与治疗组,每组40例。两组患者均进行化疗,在此基础上,对照组患者予以盐酸羟考酮控释片治疗,治疗组患者在对照组基础上加用辛伐他汀治疗;两组患者均连续治疗1个月。观察两组患者治疗前后暴发痛次数、视觉模拟评分法(VAS)评分、生活质量综合评定问卷(GQOL-74)评分、血清白介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平、盐酸氢考酮控释片日用量及不良反应发生情况。结果治疗前两组患者暴发痛发生次数比较,差异无统计学意义(P>0.05);治疗后治疗组患者暴发痛次数少于对照组(P<0.05)。治疗前两组患者VAS评分比较,差异无统计学意义(P>0.05);治疗后治疗组患者VAS评分低于对照组(P<0.05)。治疗前两组患者躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分比较,差异无统计学意义(P>0.05);治疗后治疗组患者躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分高于对照组(P<0.05)。治疗前两组患者血清IL-6、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后治疗组患者血清IL-6、TNF-α水平低于对照组(P<0.05)。治疗组患者盐酸羟考酮控释片日用量少于对照组(P<0.05)。治疗组患者不良反应发生率低于对照组(P<0.05)。结论辛伐他汀联合盐酸羟考酮控释片可有效减少晚期肺癌癌痛患者疼痛次数及盐酸羟考酮控释片用量,缓解患者疼痛程度,提高患者生活质量,减轻患者炎性反应,且安全性较高。
【关键词】肺肿瘤;疼痛;辛伐他汀;盐酸羟考酮控释片;治疗结果
穆守印.辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌患者癌痛的有效性及安全性研究[J].实用心脑肺血管病杂志,2016,24(6):108-111.[www.syxnf.net]
MU S Y.Effectiveness and safety of simvastatin combined with oxycodone hydrochloride controlled-release tablets on cancerous pain of patients with advanced lung cancer[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(6):108-111.
目前,肺癌已成为位居全世界发病率和病死率第1位的恶性肿瘤[1]。随着肺癌发病率的逐渐升高,晚期肺癌患者癌痛的发生率逐渐升高,严重影响患者的生存质量,已受到人们的广泛关注。目前,全世界约50%的癌症患者正遭受疼痛折磨,其中约50%的患者为中度疼痛,约30%的患者为难以忍受的重度疼痛,且晚期癌症患者中出现癌痛的比例和疼痛程度更高[2]。目前,治疗癌痛最有效的药物为阿片类药物,如盐酸羟考酮控释片,但其耐药性较高,且随着用药剂量的增加会导致便秘、呼吸抑制等不良反应的发生风险增加[3]。他汀类药物是临床常用的降脂药物。有研究表明,辛伐他汀和瑞舒伐他汀能缓解坐骨神经结扎引起的神经病理性疼痛[4]。目前已有关于瑞舒伐他汀预防正常大鼠吗啡耐受,并恢复吗啡耐受大鼠吗啡镇痛效能的报道[4-6];但有关辛伐他汀治疗晚期肺癌患者癌痛的作用机制目前尚无报道。本研究旨在探讨辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌患者癌痛的有效性及安全性,现报道如下。
1资料与方法
1.1一般资料选取2013年1月—2015年6月秦皇岛市青龙县医院收治的晚期肺癌癌痛患者80例,经术后病理检查确诊为晚期非小细胞肺癌,其中男51例,女29例;年龄41~76岁,平均年龄(59.2±6.0)岁;腺癌42例,鳞癌38例。排除严重心脑血管疾病患者,妊娠期及哺乳期妇女,肾功能损伤患者,肝功能损伤患者,合并严重消化道疾病(如消化性溃疡、严重慢性便秘等)患者。将所有患者随机分为对照组与治疗组,每组40例。两组患者性别、年龄、病理类型、疼痛程度比较,差异无统计学意义(P>0.05,见表1),具有可比性。两组患者均签署知情同意书,并经医院伦理委员会批准。
1.2方法两组患者均进行化疗,化疗方案:腺癌患者采用培美曲塞+顺铂,鳞癌患者采用吉西他滨+顺铂。在此基础上,对照组患者予以盐酸羟考酮控释片(商品名:奥施康定,萌蒂制药有限公司生产,国药准字J20110014)治疗,起始剂量:视觉模拟评分法(VAS)评分4~6分患者予以10 mg,VAS评分7~10分患者予以20 mg。治疗组患者在对照组基础上加用辛伐他汀(山东鲁抗医药集团赛特有限责任公司生产,国药准字H20083839)10 mg,每晚睡前口服。两组患者均连续治疗1个月。

表1 两组患者一般资料比较
注:a为t值
1.3观察指标观察两组患者治疗前后暴发痛次数、VAS评分、生活质量综合评定问卷(GQOL-74)评分、血清白介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平、盐酸氢考酮控释片日用量及不良反应(恶心呕吐、便秘、肝功能损伤、呼吸抑制)发生情况。
1.3.1VAS评分采用VAS评分评定患者疼痛程度,0分表示无痛,10分代表最痛,患者根据自身疼痛程度挑选1个数字作代表。
1.3.2GQOL-74评分采用GQOL-74评分评定患者生活质量,包括躯体功能、心理功能、社会功能、物质生活状态、总体生活质量,共74个条目。躯体功能(条目F11~F30)、心理功能(条目F31~F50)、社会功能(条目F51~F70)、物质生活状态(条目F1~F10)4个维度中前3个维度各有5个因子,物质生活状态有4个因子,另包括1个总体生活质量维度(条目G1~G4),共20个因子。GQOL-74评分越高表示患者的生活质量越好。
1.3.3血清IL-6、TNF-α水平抽取患者清晨空腹肘静脉血4 ml,离心分离后取血清,采用酶联免疫吸附法测定(试剂盒由深圳晶美生物工程有限公司提供)血清IL-6、TNF-α水平。

2结果
2.1暴发痛次数治疗前治疗组患者出现暴发痛(10.3±2.1)次,对照组患者出现暴发痛(9.6±1.6)次;治疗后治疗组患者出现暴发痛(1.8±0.3)次,对照组患者出现暴发痛(4.6±0.9)次。治疗前两组患者暴发痛发生次数比较,差异无统计学意义(t=1.032,P>0.05);治疗后治疗组患者暴发痛次数少于对照组,差异有统计学意义(t=18.667,P<0.05)。
2.2VAS评分治疗前两组患者VAS评分比较,差异无统计学意义(P>0.05);治疗后治疗组患者VAS评分低于对照组,差异有统计学意义(P<0.05,见表2)。
Table2ComparisonofVASscorebetweenthetwogroupsbeforeandaftertreatment
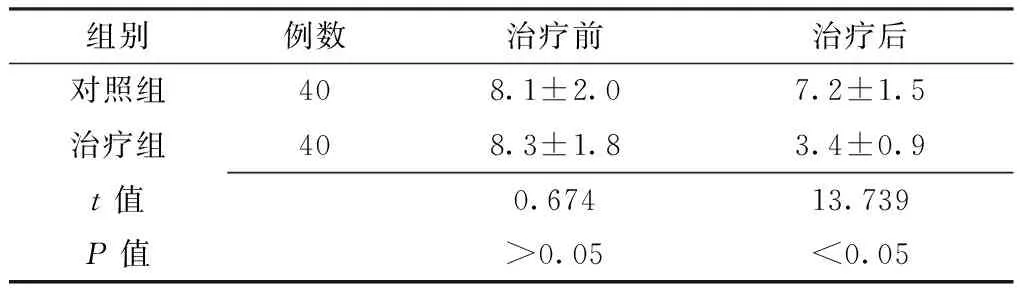
组别例数治疗前治疗后对照组408.1±2.07.2±1.5治疗组408.3±1.83.4±0.9t值0.67413.739P值>0.05<0.05
注:VAS=视觉模拟评分法
2.3GQOL-74评分治疗前两组患者躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分比较,差异无统计学意义(P>0.05);治疗后治疗组患者躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分高于对照组,差异有统计学意义(P<0.05,见表3)。
2.4血清IL-6、TNF-α水平治疗前两组患者血清IL-6、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后治疗组患者血清IL-6、TNF-α水平低于对照组,差异有统计学意义(P<0.05,见表4)。
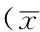
Table4ComparisonofserumlevelsofIL-6andTNF-αbetweenthetwogroupsbeforeandaftertreatment

组别例数IL-6(ng/L)治疗前 治疗后TNF-α(μg/L)治疗前 治疗后对照组40221.7±43.8204.8±42.52.09±0.201.73±0.33治疗组40222.6±45.6162.8±33.72.13±0.221.16±0.27t值0.0904.8970.8518.455P值0.9280.0000.3970.000
注:IL-6=白介素6,TNF-α=肿瘤坏死因子α
2.5盐酸羟考酮控释片日用量治疗组患者盐酸羟考酮控释片日用量为(35.6±6.7)mg,对照组患者盐酸羟考酮控释片日用量为(48.2±7.8)mg。治疗组患者盐酸羟考酮控释片日用量少于对照组,差异有统计学意义(t=7.750,P<0.05)。
2.6不良反应治疗组患者出现不良反应15例(37.5%),对照组患者出现不良反应25例(62.5%)。治疗组患者不良反应发生率低于对照组,差异有统计学意义(χ2=5.000,P<0.05,见表5)。
表5两组患者不良反应发生率比较〔n(%)〕
Table 5Comparison of incidence of adverse reactions between the two groups

组别例数恶心呕吐便秘肝功损伤呼吸抑制对照组406(15.0)16(40.0)2(5.0)1(2.5)治疗组403(7.5)11(27.5)1(2.5)0
3讨论
肺癌是常见的恶性肿瘤之一,也是病死率最高的恶性肿瘤,其发病率随着全球环境的恶化呈逐年升高趋势,已成为全球公共卫生问题[7]。目前,肺癌的治疗方法主要有外科手术、放化疗、免疫疗法及中药治疗等。晚期癌症患者由于癌痛的影响而导致生活质量降低[8-9]。62%~86%的晚期癌症患者伴有疼痛症状,其中癌性骨痛是最常见的癌痛类型[10]。肺癌患者易发生骨转移,转移灶可见于全身多个部位,给患者身心带来极大的痛苦。
目前认为癌痛由伤害性疼痛和神经性疼痛组成[11],伤害性疼痛是由于肿瘤及其相关细胞释放的致痛物质(如前列腺素、白介素等)、破骨细胞导致的溶骨性破坏引起的酸中毒、机械性结构失去稳定及骨折等造成[12-13]。癌痛患者应采用病因治疗、药物治疗、心理干预等综合治疗。目前,治疗癌痛最有效的药物为阿片类药物,如盐酸羟考酮控释片。盐酸羟考酮控释片自1995年上市以来,由于其对癌痛的治疗效果理想,已广泛应用于癌痛的治疗[14],但其易产生耐药性,且随着用药剂量增加会导致便秘、呼吸抑制等不良反应的发生风险增加[3]。
他汀类药物具有多效性。李晓霞[15]采用尼莫地平、辛伐他汀联合吗啡控释片治疗癌痛,结果显示,研究组患者总有效率(95.45%)高于对照组(80.30%),提示尼莫地平、辛伐他汀和吗啡控释片联合治疗癌痛的止痛效果良好。李永乐[16]研究结果证实,瑞舒伐他汀对吗啡耐受大鼠吗啡镇痛效能有增强作用。
表3 两组患者治疗前后GQOL-74评分比较±s,分)
本研究结果显示,治疗前两组患者暴发痛发生次数间无差异,治疗后治疗组患者暴发痛次数少于对照组;治疗前两组患者VAS评分间无差异,治疗后治疗组患者VAS评分低于对照组;治疗前两组患者躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分间无差异,治疗后治疗组躯体功能、心理功能、社会功能、物质生活状态、总体生活质量评分高于对照组;治疗前两组患者血清IL-6、TNF-α水平间无差异,治疗后治疗组患者血清IL-6、TNF-α水平低于对照组;治疗组患者盐酸羟考酮控释片日用量少于对照组;治疗组患者不良反应发生率低于对照组。提示辛伐他汀联合盐酸羟考酮控释片治疗晚期肺癌癌痛患者的临床疗效确切,可减少暴发痛疼痛发生次数,缓解疼痛程度,减少盐酸羟考酮控释片日用量,提高患者的生活质量,减少不良反应的发生。另外,晚期肺癌患者骨转移后癌痛与炎性因子水平有关,辛伐他汀可降低炎性因子(如IL-6、TNF-α)水平,进而缓解癌性疼痛,这可能是辛伐他汀治疗癌性疼痛的作用机制之一。但本研究样本量小,且其他类型他汀类药物治疗晚期肺癌患者癌痛的作用机制未明,仍有待今后研究进一步证实。
综上所述,辛伐他汀联合盐酸羟考酮控释片可有效减少晚期肺癌癌痛患者疼痛次数及盐酸羟考酮控释片用量,缓解患者疼痛程度,提高患者生活质量,减轻患者炎性反应,且安全性较高,值得临床推广应用。
参考文献
[1]李瑞娜,郝元涛.肺癌流行病学和病因学研究[J].实用医学杂志,2009,25(11):1904-1905.
[2]邵月娟,王昆.310例中重度癌痛患者临床特征分析[J].中国肿瘤临床,2014,52(15):989-992.
[3]姜香琴,方晓,吴慧莉,等.老年晚期肺癌患者阿片类药物不良反应的观察及护理[J].解放军护理杂志,2013,30(20):47-48.
[4]李永乐,谢军明,舒银银,等.瑞舒伐他汀部分恢复吗啡耐受大鼠的吗啡镇痛效能[J].中国药理学通报,2013,29(1):64-68.
[5]LI W,LI Y,ZHU S,et al.Rosuvastatin attenuated the existing morphine tolerance in rats with L5 spinal nerve transection through inhibiting activation of astrocytes and phosphorylation of ERK42/44[J].Neurosci Lett,2015(584):314-319.
[6]LI Y,SHU Y,JI Q,et al.Attenuation of morphine analgesic tolerance by rosuvastatin in nave and morphine tolerance rats.[J].Inflammation,2015,38(1):134-141.
[7]许凤,李勇,陈石伟,等.羟考酮缓释片在缓解晚期肺癌疼痛中的效果观察[J].上海预防医学,2013,25(10):597-599.
[8]景年财,郭环宇,王军,等.加减身痛逐瘀膏外敷联合强阿片类药物治疗肺癌骨转移中、重度疼痛的疗效[J].中国老年学杂志,2014,34(19):5428-5430.
[9]张涛,史秀忠,金小桦,等.美施康定在中重度癌痛治疗中的预处理临床观察[J].交通医学,2011,25(4):388-389.
[10]郭剑锋,吴永忠,陈晓品.肺癌骨转移性癌痛放射治疗方法研究[J].重庆医学,2002,31(3):211-213.
[11]万信念,陈涛.骨癌痛病理机制的研究进展[J].广东医学,2014,52(12):1950-1952.
[12]彭皓.内皮素系统与骨转移性癌痛[J].医学信息,2014,28(12):632-633.
[13]赵晓丽.长期护理干预对骨转移癌痛患者生活质量的影响[J].中华现代护理杂志,2012,18(8):889-891.
[14]刘佳琪,王虚实,张玲,等.阿片类药物治疗中重度癌痛患者146例临床分析[J].中国综合临床,2014,30(5):475-478.
[15]李晓霞.尼莫地平、辛伐他汀联合吗啡控释片治疗癌痛66例疗效研究[J].世界最新医学信息文摘(连续型电子期刊),2015,15(46):98.
[16]李永乐.瑞舒伐他汀对吗啡耐受大鼠吗啡镇痛效能的影响[D].广州:南方医科大学,2013.
(本文编辑:李洁晨)
【中图分类号】R 734.2
【文献标识码】B
DOI:10.3969/j.issn.1008-5971.2016.06.028
(收稿日期:2016-01-02;修回日期:2016-05-25)
Effectiveness and Safety of Simvastatin Combined With Oxycodone Hydrochloride Controlled-release Tablets on Cancerous Pain of Patients With Advanced Lung Cancer
MUShou-yin.
TheHospitalofQinglongCounty,Qinhuangdao066500,China
【Abstract】ObjectiveTo investigate the effectiveness and safety of simvastatin combined with oxycodone hydrochloride controlled-release tablets on cancerous pain of patients with advanced lung cancer.MethodsFrom January 2013 to June 2015,a total of 80 advanced lung cancer patients complicated with cancerous pain were selected in the Hospital of Qinglong County,Qinhuangdao,and they were randomly divided into control group and treatment group,each of 40 cases.Based on chemotherapy,patients of control group received oxycodone hydrochloride controlled-release tablets,while patients of treatment group received simvastatin combined with oxycodone hydrochloride controlled-release tablets;both groups continuously treated for 1 month.Times of breakthrough pain,VAS score,GQOL-74 score,serum levels of IL-6 and TNF-α,daily dosage of oxycodone hydrochloride controlled-release tablets and incidence of adverse reactions were compared between the two groups.ResultsNo statistically significant differences of times of breakthrough pain was found between the two groups before treatment(P>0.05),while times of breakthrough pain of treatment group was statistically significantly less than that of control group after treatment(P<0.05).No statistically significant differences of VAS score was found between the two groups before treatment(P>0.05),while VAS score of treatment group was statistically significantly lower than that of control group after treatment(P<0.05).No statistically significant differences of physical function score,mental function score,social function score,material living score or whole living quality score was found between the two groups before treatment(P>0.05),while physical function score,mental function score,social function score,material living score and whole living quality score of treatment group were statistically significantly lower than those of control group after treatment(P<0.05).No statistically significant differences of serum level of IL-6 or TNF-α was found between the two groups before treatment(P>0.05),while serum levels of IL-6 and TNF-α of treatment group were statistically significantly lower than those of control group after treatment(P<0.05).Daily dosage of oxycodone hydrochloride controlled-release tablets of treatment group was statistically significantly less than that of control group(P<0.05),while the incidence of adverse reactions of treatment group was statistically significantly lower than that of control group(P<0.05).ConclusionSimvastatin combined with oxycodone hydrochloride controlled-release tablets can effectively reduce the times of breakthrough pain and daily dosage of oxycodone hydrochloride controlled-release tablets,relive the pain intensity and inflammatory reaction,improve the living quality,and is safe.
【Key words】Lung neoplasms;Pain;Simvastatin;Oxycodone hydrochloride controlled-release tablets;Treatment outcome
