基于保护剂筛选及优化策略提高苯丙氨酸羟化酶热稳定性
2016-07-21叶双双周丽周哲敏
叶双双,周丽,周哲敏
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
基于保护剂筛选及优化策略提高苯丙氨酸羟化酶热稳定性
叶双双,周丽,周哲敏*
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
摘要苯丙氨酸羟化酶(Phenylalanine hydroxylase,PAH)具有治疗苯丙酮尿症(phenylketonuria, PKU)的潜在药用价值,而热稳定性和储存稳定性差是限制其应用的重要因素。文中考察了多种保护剂对PAH热稳定性的影响,表明添加10%的甘油可将PAH在50 ℃处理10 min的酶活保留率提高3.1倍,达到 (98.3±0.8)%,同时海藻糖、棉籽糖和甘露醇均能将PAH酶活保留率提高到78%以上。鉴于甘油在临床应用过程中可能出现不良反应,对后3种保护剂进行正交实验,获得最佳复合保护剂组合:2.5 mmol/L甘露醇、1 mmol/L 棉籽糖和1.5 mmol/L 海藻糖,可将50 ℃酶活保留率提高3.1倍,达到 (99.3±1.2)%。10%甘油和复合保护剂均能显著提高PAH在4、20、37 ℃的储存稳定性,其中添加10%甘油或复合保护剂使得PAH在37 ℃下储存半衰期分别延长到129.9 h和237.5 h,比未添加保护剂的分别提高了1.9倍和4.3倍。该结果为PAH在医药领域的应用奠定了基础。
关键词苯丙氨酸羟化酶(Phenylalanine hydroxylase,PAH);保护剂;稳定性
苯丙氨酸羟化酶(Phenylalanine hydroxylase, PAH, EC 1.14.16.1)主要功能是催化苯丙氨酸羟化反应生成酪氨酸。人体内PAH基因突变导致该酶的活性降低或丧失,苯丙氨酸代谢紊乱,最终形成苯丙酮尿症(phenylketonuria, PKU)[1-2]。目前该疾病患者只能通过摄入低苯丙氨酸或不含苯丙氨酸的配方食品或低蛋白食物[3]来控制疾病。但是这种治疗方法会导致患者微量元素缺乏、脂肪酸缺乏和低胆固醇血症等[4]。如果能将PAH直接添加到食物中,可有效控制苯丙氨酸同时不影响其他营养物质摄入。紫色色杆菌(Chromobacteriumviolaceum)PAH的催化区域与人类来源PAH几乎完全一致,能够在人体温度和pH条件下催化苯丙氨酸羟化反应,且相对其他来源的PAH稳定性更高[5]。YEW等[6]运用紫色色杆菌PAH成功降低了正常小鼠血液中苯丙氨酸水平,为其在功能食品领域的运用提供了参考。然而,稳定性低仍然是限制PAH进一步应用的重要因素[7]。
酶的热稳定性和储存稳定性是影响其在医药、食品等领域应用的关键因素。在诸多提高酶蛋白稳定性的方法中,添加保护剂不仅能有效提高酶的热稳定性,延长酶类的保存时间,而且工艺简单,成本低。如GEORGE等[8]在木聚糖酶中分别添加甘油、山梨醇、甘露醇、明胶或海藻糖等,均显著提高了木聚糖酶在80 ℃条件下的稳定性;李群等[9]发现,添加0.5 mmol/L海藻糖的乙醇脱氢酶在30~60 ℃条件下处理20 min后酶活保留率显著升高。此外,一些研究者发现将多种保护剂组合,可进一步提高酶的热稳定性和储存稳定性。例如,刘彩琴等[10]在α-半乳糖苷酶中添加复合保护剂(1.75 mmol/L海藻糖、1.5 mmol/L甘露醇和2 mmol/L棉籽糖),使α-半乳糖苷酶在30~60 ℃时酶活保留率提高11.6%~21.7%;COASTA[11]等人在过氧化氢酶中加入由甘油和聚乙烯乙二醇组成的复合保护剂提高了其储存稳定性。
常用的酶保护剂有多元醇、糖类、氨基酸、盐类、蛋白质、大分子聚合物等[12-17],这些保护剂对酶的作用机制是使酶表面完全水化和保护剂完全结合之间建立其一种平衡,从而改变溶液的热力学性质,发挥保护蛋白质稳定性的作用[18-20]。本研究选取多种适用于医药领域的保护剂,考察它们对PAH热稳定性的影响,通过正交实验确定最佳保护剂组合,并比较了最佳保护剂在不同温度下的储存效果。
1材料与方法
1.1材料与仪器
1.1.1材料
菌种:EscherichiacoliBL21(DE3)/pET24a-pah由本实验室构建并保存[7]。
保护剂:海藻糖、乳糖、蜜二糖、棉籽糖、甘油、山梨醇、甘露醇、CaCl2、山梨酸钾、NaCl、白蛋白、L-半胱氨酸、明胶。
发酵培养基:2YT培养基(胰蛋白胨15 g/L,酵母提取物10 g/L,NaCl 10 g/L)。
1.1.2主要仪器
SW-CJ-2D超净工作台,美国Thermo公司;超声破碎仪,美国SONICS公司;CF16RXⅡ离心机,日本HITACHI公司;HYG-A全温立式摇床,江苏太仓设备厂;AKTAXPRESS蛋白纯化仪,通用电气医疗机械集团;HiTrap FF DEAE 1mL阴离子柱,通用电气医疗器械集团。
1.2实验方法
1.2.1PAH的制备
以E.coliBL21(DE3)/pET24a-pah作为出发菌株,当菌种OD600值=0.6时,添加终浓度0.6 mmol/L 的IPTG,24 ℃ 200 r/min条件下发酵24 h。菌种发酵培养后离心(8 000 r/min,4 ℃,5 min)收集细胞。用适当体积20 mmol/L pH 7.5 Tris-HCl重悬后用超声破碎仪破碎,离心(12 000 r/min,4 ℃,30 min)取上清液,用0.45 μm微孔滤膜过滤,经DEAE阴离子交换柱纯化目的蛋白[7],获得较纯的目的蛋白。
1.2.2PAH酶活测定方法
PAH酶液稀释至0.5 mg/mL,取50 μL加到250 μL 100 mmol/L HEPES(pH 7.5)缓冲液中,然后在该体系中加入50 μL浓度为10 mmol/L的苯丙氨酸、50 μL浓度为50 mmol/L的DTT、50 μL浓度为50 μmol/L FeSO4、50 μL浓度为2 mmol/L的DMPH4,37 ℃处理10 min,加入500 μL甲醇终止反应。15 000 r/min离心30 min,取上清,用0.22 μm微孔有机滤膜过滤,利用HPLC检测产物生成量[7]。
1.2.3保护剂的筛选
将所选的各种类型的保护剂以一定的比例与PAH混合,50 ℃处理10 min后立即用冰水冷却,测定残存酶活。以处理前PAH活性作为100%,分别计算不同条件下的酶活力保留率。
(1)
1.2.4复合保护剂组分优化
根据单因素实验结果,确定保护剂种类和浓度,进行三因素四水平(采用L16(43)的正交表,如表1)的正交实验,优化保护剂配方。
1.2.5保护剂对PAH储存稳定性的影响
储存实验分别在4、20、37 ℃(分别属于保鲜温度、常温及PAH最适反应温度)进行。在酶液中分别添加不同的保护剂,对照组不添加任何保护剂,每隔12 h或24 h取样测定酶活保留率。
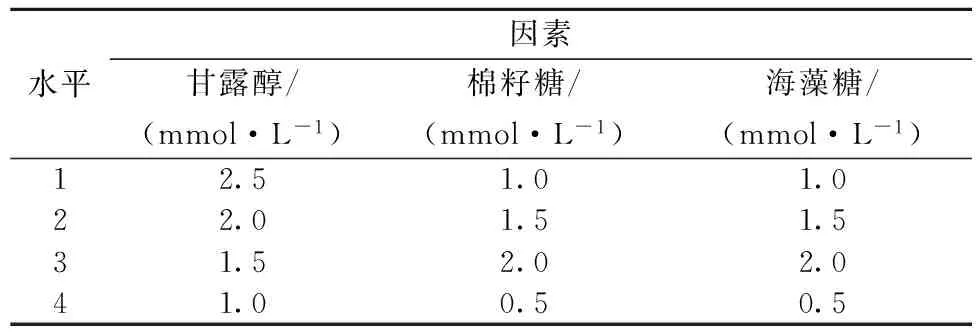
表1 复合保护剂正交实验因素水平
2结果与分析
2.1保护剂种类对PAH热稳定性的影响
选取可应用于医药领域的保护剂加入到PAH中,50 ℃保温10 min后测定残留PAH活性,比较各保护剂对PAH热稳定性的影响,结果如表2所示。
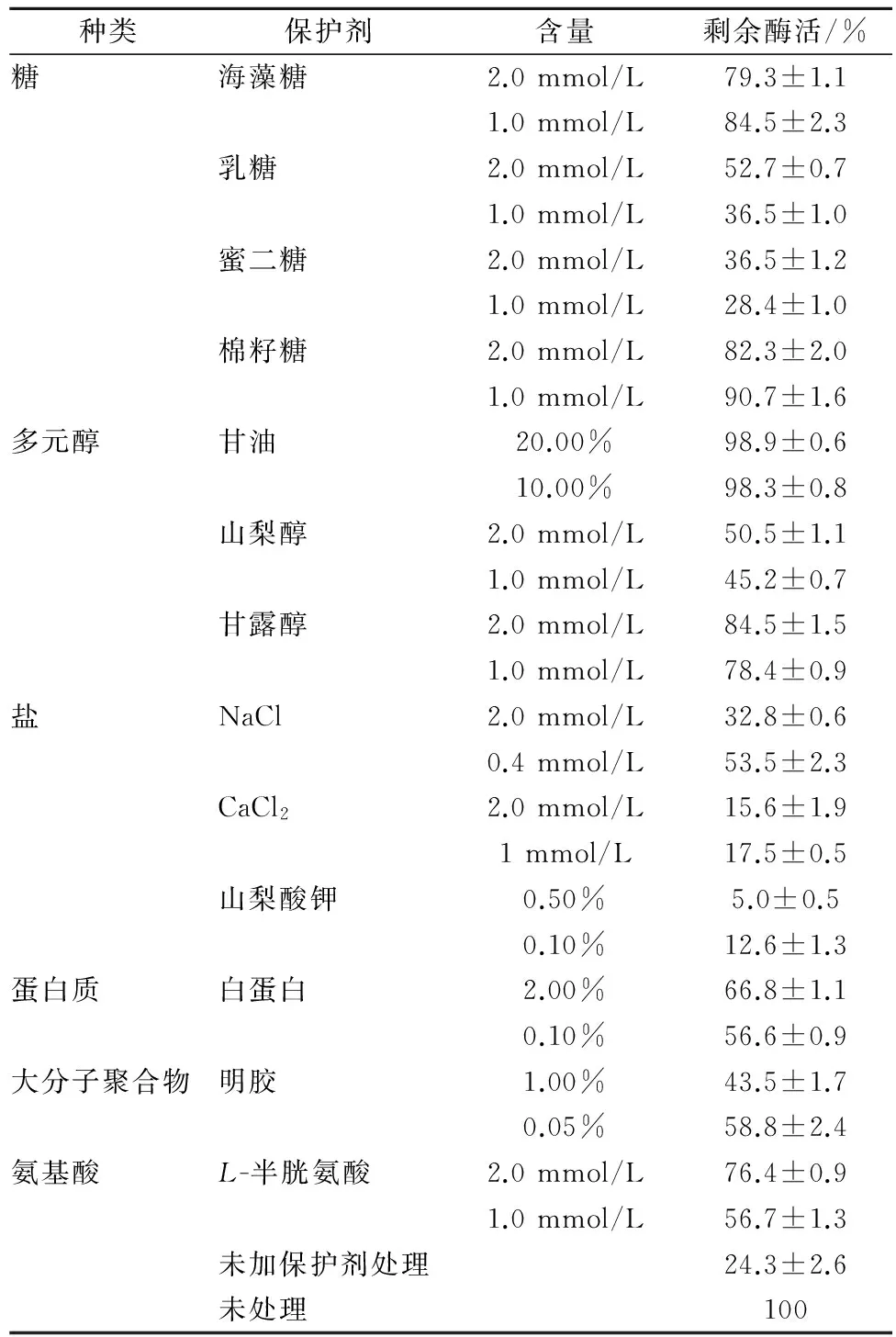
表2 单一保护剂对PAH热稳定性的影响
由表2可知,中性盐对PAH的保护效果较差,其中NaCl对PAH无显著保护效果,CaCl2、山梨酸钾对酶活有明显的抑制作用;而糖类、多元醇、蛋白类、聚合物和氨基酸对PAH的热稳定性都有一定的促进作用,其中甘油效果最好,添加10%或者20%的甘油后,PAH酶活保留率分别高达 (98.3±0.8)%、(98.9±0.6)%,相比未添加保护剂的对照组(酶活保留率为 (24.3±2.6)%)提高了3.1倍左右,棉籽糖,海藻糖,甘露醇保护效果略次于甘油,处理之后的酶活保留率均高于78%。
已有研究[13]认为,盐中金属离子能够结合酶的带电基团,从而提高酶的稳定性。本实验结果表明,盐类对PAH没有显著的效果,CaCl2、山梨酸钾甚至对PAH活性产生显著抑制,可能是因为PAH活性中心结合一个Fe2+才能发挥催化作用,当加入其他金属离子时会干扰Fe2+与酶的活性中心结合,导致酶活下降。
酶的热稳定性,主要取决于酶分子的空间结构。通常情况下,高温会导致维系酶分子空间结构的氢键或疏水键遭到破坏,失去原有的空间构象,最终失去原有的生物活性。当添加甘油、海藻糖、棉籽糖或甘露醇至酶液中,它们的羟基能够与酶分子表面的酰胺基之间形成氢键[21],因此能有效提高酶的热稳定性。
2.2保护剂浓度对PAH热稳定性的影响
在不同浓度保护剂下,50 ℃保温10 min,PAH活性残留率如图1所示。表明棉籽糖的最佳质量体积百分浓度为1.0%,相对酶活为 (94.0±1.8)%,高于同浓度下的海藻糖、甘露醇和甘油。甘油在高浓度(体积分数≥10%)下对PAH具有良好的稳定作用,相对酶活为98%左右,直到甘油浓度提高至50%仍未出现抑制现象。
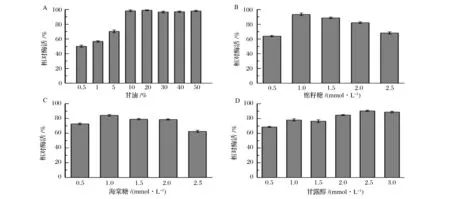
图1 保护剂浓度对PAH热稳定性的影响Fig.1 Effects on thermostability of PAH in the presence of protective additive with different concentrations
2.3复合保护剂对PAH热稳定性的影响
根据上述单因素实验结果,10%甘油即表现出非常显著的保护效果,但是甘油在临床应用中也会出现一些不良反应,如曾出现由于10%复方甘油引起血红蛋白尿的病例[22];口服甘油合剂导致患者出现恶心、呕吐等症状[23];甘油灌肠剂也可能对患者产生不良反应[24]等。而将多种保护效果略差的保护剂进行合理组合,同样可达到显著提高酶稳定性的效果。因此选取甘露醇(A)、棉籽糖(B)、海藻糖(C)三种保护剂设计三因素四水平实验,优化获得最佳保护剂组合。结果如表3所示。
由表3极差分析可以看出甘露醇对PAH热稳定性作用最显著,海藻糖、棉籽糖效果相似。根据K值得出PAH最佳保护剂配方为A1B1C2,即2.5 mmol/L甘露醇、1 mmol/L棉籽糖、1.5 mmol/L海藻糖。
将上述获得的最佳复合保护剂添加到PAH中,在50 ℃条件下处理10 min,测定残余酶活,表明酶活保留率达到 (99.3±1.2)%,比未添加保护剂的酶活保留率((24.3±2.6)%)提高了3.1倍。
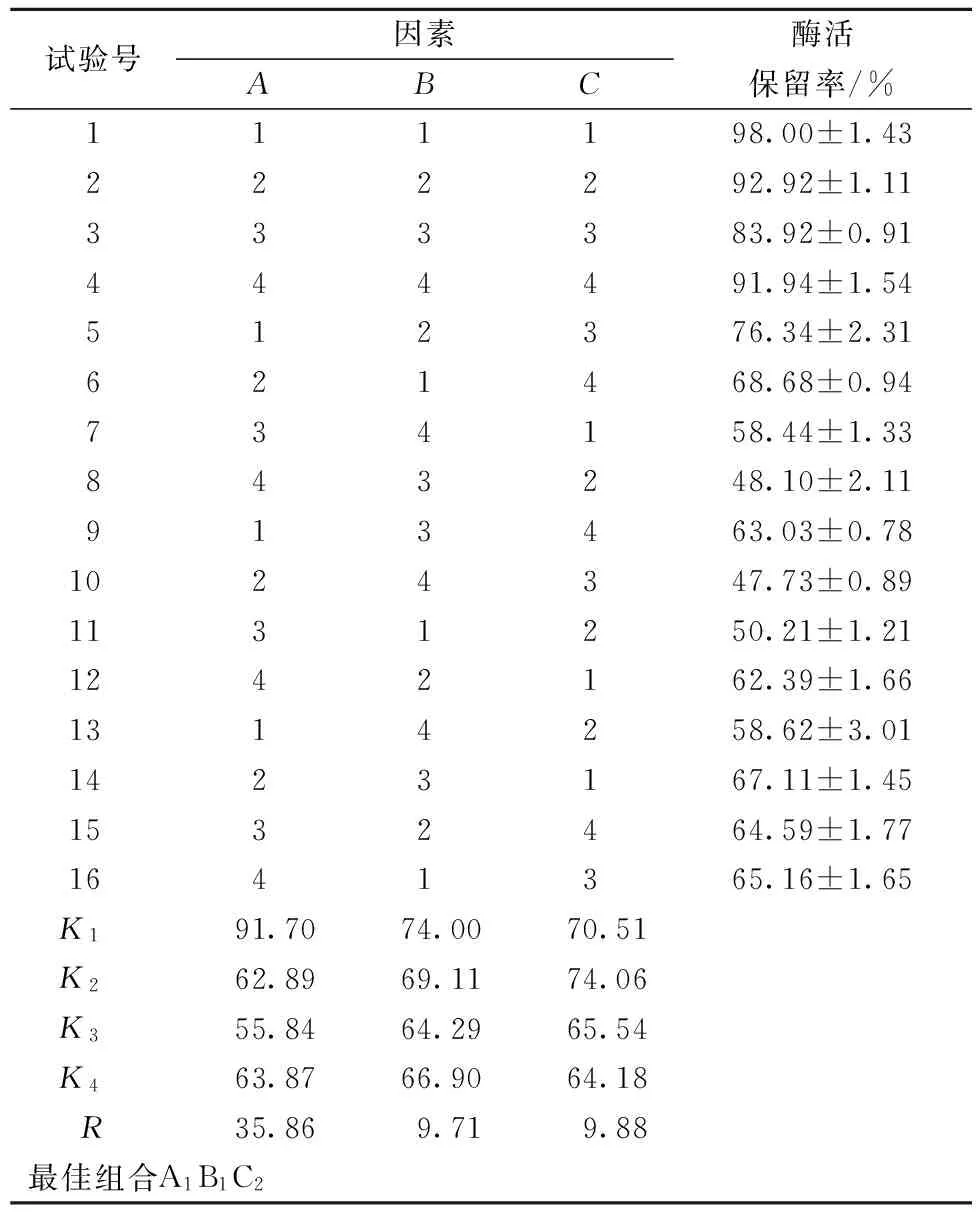
表3 复合保护剂的正交实验设计及实验结果
2.4甘油与复合保护剂对PAH储存稳定性的影响
酶的稳定性及储存稳定性是酶临床应用的重要因素,液体酶直接储存,容易丧失酶活性,不易长期保存。冷冻真空干燥工艺复杂,成本高,难以大规模应用。因此选择适合的保护剂提高酶的热稳定性对该酶的应用具有重要意义。根据单因素和优化复合保护剂结果可以看出,10%甘油和复合保护剂(甘露醇2.5 mmol/L、棉籽糖1 mmol/L、海藻糖1.5 mmol/L)对PAH热稳定性均具有很好的保护效果。为了比较二者在储存过程中对PAH的保护效果,分别在4、20、37 ℃三个温度条件下保温不同时间,并测定PAH的酶活残留率。
由图2 所示,随着温度升高PAH失活速度明显增加,在4 ℃条件下放置两2后剩余酶活为 (53.6±1.3)%,在20、37 ℃仅放置10天后酶活已分别降至 (19.3±2.5)%、(6.9±1.9)%。添加保护剂能显著降低PAH失活速度,在4 ℃放置2周,添加保护剂的PAH酶活保留率可达85%左右,比未添加保护剂的对照组高出近58.6%;在20 ℃条件下,添加保护剂处理10天后酶活保留率仍然在50%以上,而不添加保护剂时PAH半衰期仅为84.1 h左右;在37 ℃条件下,添加甘油和复合保护剂后PAH半衰期分别提高到129.9、237.6 h左右,相比未添加保护剂的PAH半衰期(45.2 h左右)分别提高了2.8、4.0倍。
同时,复合保护剂对提高PAH储存稳定性的效果明显优于甘油,20 ℃放置10天后添加复合保护剂酶活保留率比添加10%甘油的高出24.1%,在37 ℃放置时添加复合保护剂PAH半衰期(237.6 h左右)较添加甘油(半衰期129.9 h)高出82.9%。表明在不同的储存温度下,复合保护剂均比10%甘油更具优势。
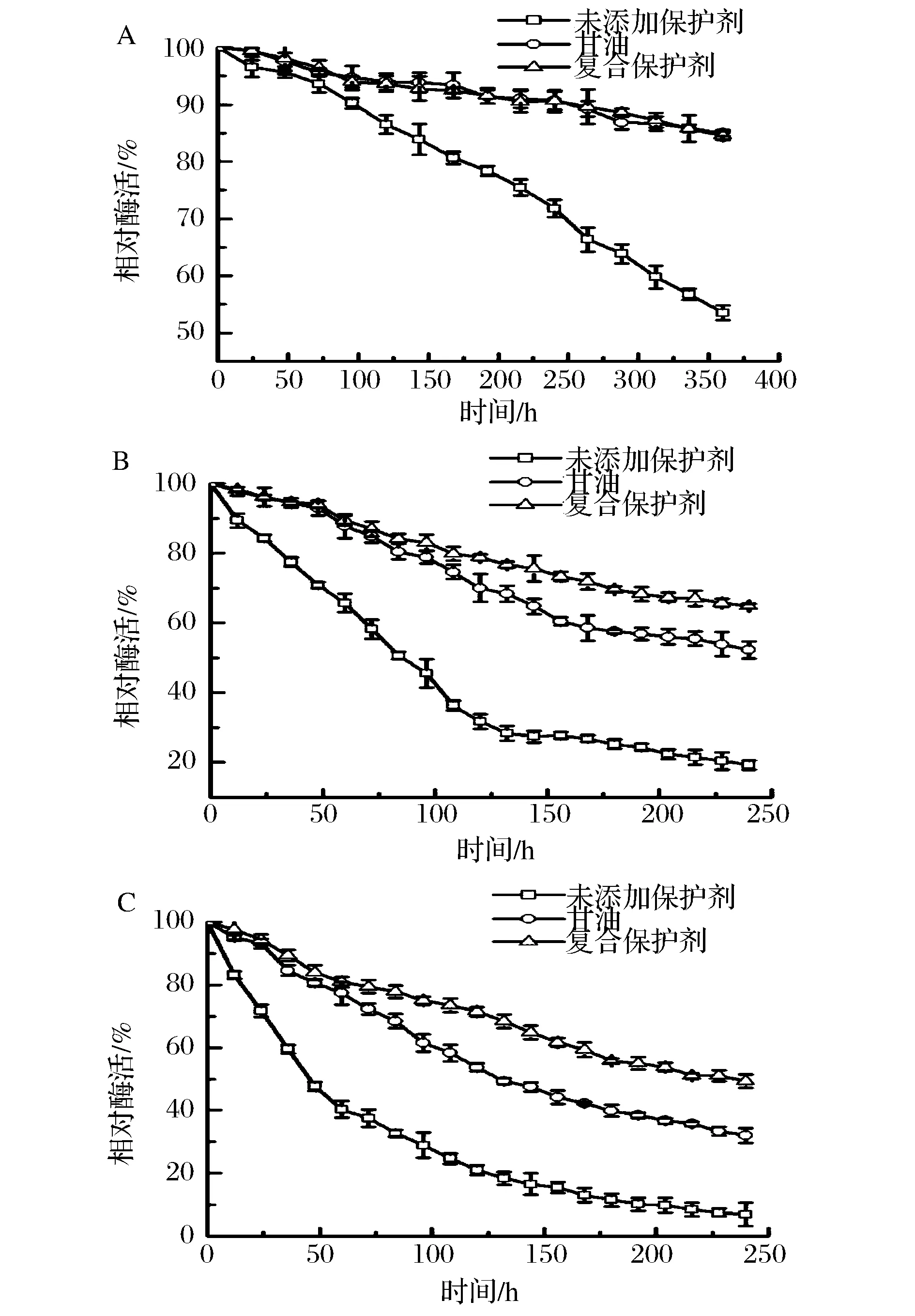
A:4 ℃条件;B: 20 ℃条件;C:37 ℃条件图2 甘油和复合保护剂对苯丙氨酸羟化酶储存稳定性的影响Fig.2 Effects on storage stability of PAH in the presence of glycerol or combination additives
3结论
本研究分析了在PAH中添加糖类、多元醇、盐类、蛋白质、大分子聚合物、氨基酸等化学物质对酶热稳定性的影响,筛选出了可有效提高PAH稳定性的4种保护剂,分别是甘油、甘露醇、棉籽糖、海藻糖。对甘露醇、棉籽糖、海藻糖进行正交优化得到最佳复合保护剂配方:2.5 mmol/L甘露醇、1 mmol/L棉籽糖、1.5 mmol/L海藻糖,可将PAH在50 ℃酶活保留率提高到 (99.3±1.2)%。在4、20、37 ℃下,添加10%甘油或复合保护剂均能提高PAH储存稳定性,延长储存时间。与10%甘油相比,温度越高时复合保护剂对PAH储存稳定性的保护效果越好。
参考文献
[1]FLYDAL M I, MARTINEZ A. Phenylalanine hydroxylase: Function, structure and regulation[J]. Annual Review of Nutrition, 2013, 65(4): 341-349.
[2]KALHAN S C, BIER D M. Protein and amino acid metabolism in the human newborn[J]. Annual Review of Nutrition, 2008, 28: 389-410.
[3]WILLIAMS R A, MAMOTTE C D, BURNETT J R. Phenylketonuria: an inborn error of phenylalanine metabolism[J]. The Clinical Biochemist Review, 2008, 29(1): 31-41.
[4]赵彩虹, 张立琴. 苯丙酮尿症饮食治疗及相关营养问题研究进展[J]. 中国儿童保健杂志, 2010, 18(8): 672-674.
[5]LOAIZA A, AMSTRONG K M, BAKER B M, et al. Kinetics of thermal unfolding of phenylalanine hydroxylase variants containing different metal cofactors (Fe Ⅱ, Co Ⅱ, Zn Ⅱ) and their isokinetic relationship[J]. Inorganic Chemisry, 2008, 47(11): 4 883-5 877.
[6]YEW N S, DUFOUR E, PRZYBYLSKA M, et al. Erythrocytes encapsulated with phenylalanine hydroxylase exhibit improved pharmacokinetics and lowered plasma phenylalanine levels in normal mice[J]. Molecular Genetics and Metabolism, 2013, 109(4): 339-344.
[7]曹淑慧, 周丽, 崔文璟, 等. 紫色色杆菌苯丙氨酸羟化酶的异源表达及重组酶学性质研究[J]. 生物技术通报, 2014(8): 153-158.
[8]GEORGE S P, AHMAD A, RAO M B. A novel thermostable xylanase fromThermomonosporasp.: influence of additives on thermostability[J]. Bioresource Technology, 2001, 78(3): 221-224.
[9]李群, 袁勤生, 李永丰. 海藻糖对酶热稳定性保护作用的研究[J]. 药物生物技术, 1997(4): 28-31.
[10]刘彩琴, 阮晖, 傅明亮, 等. 提高 α- 半乳糖苷酶稳定性的研究[J]. 食品与发酵工业, 2007, 33(11): 26-29.
[11]COSTA S A, TZANOV T, CARNEIRO A F, et al. Studies of stabilization of native catalase using additives[J]. Enzyme and Microbial Technology, 2002, 30(3): 387-391.
[12]KIMA J, GRATE J W, WANG P. Nanostructures for enzyme stabilization[J]. Chemical Engineering Science, 2006, 61(3): 1 017-1 026.
[13]KLIBANOV A M. Stabilization of enzymes against thermal inactivation[J]. Advances in Applied Microbiology, 1983, 29: 1-28.
[14]SCHMID R D. Stabilized soluble enzymes[M]. Advances in Biochemical Engineering. Department of Biotechnology, Henkel KGaA, 1979: 41-118.
[15]OBON J M, MANJON A, IBORRA J L. Comparative thermostability of glucose dehydrogenase fromHaloferaxmediterranei. effects of salts and polyols[J]. Enzyme and Microbial Technology, 1996, 19(5): 352-360.
[16]COMBES D, MONSAN P. Effect of poloyhydric alcohol on invertase stabilization[J]. Annals of the New York Academy of Sciences, 1984, 434: 61-63.
[17]CHEN C C, TU Y Y, CHANG H M. Thermal stability of bovine milk Immunoglobulin G (IgG) and the effect of added thermal protectants on the stability[J]. Journal of Food Science, 2000, 65(2): 188-193.
[18]TIMASHEFF S N. Control of protein stability and reactions by weakly interacting co solvents: the simplicity of the complicated [J]. Advances in Protein Chemistry, 1998, 51: 355-432.
[19]WANG W. Lyophilization and development of solid protein pharmaceuticals[J]. International Journal of Pharmaceutics, 2000, 203(1-2): 1-60.
[20]ARAKAWA T J, PACE A L, LI M, et al. Protein-solvent interactions in pharmaceutical formulations[J]. Pharmaceutical Research, 1991, 8(3): 285-291.
[21]许燕波, 钱春香, 陆兆文. 甘油提高巴氏芽孢杆菌脲酶的热稳定性[J]. 东南大学学报(自然科学版), 2013, 43: 147-151.
[22]尹桂玉, 韩贞琳, 李德宽. 10%复方甘油引起血红蛋白尿3例报告[J]. 哈尔滨医药, 1994, 14(4): 50-51.
[23]王桂珍, 施道生. 甘油合剂在眼科临床的应用及处方改进[J]. 中级医刊, 1984(4): 38.
[24]徐慰婕, 毛红梅, 谭月英, 等. 甘油灌肠剂灌肠后不良反应观察及操作改进后效果对比[J]. 中外健康文摘, 2012, (36): 227-228.
Enhancement of thermostability of phenylalanine hydroxylase based on the strategy of screening and optimization of additives
YE Shuang-shuang, ZHOU Li, ZHOU Zhe-min*
(Schoool of Biotechnology and the Key Laboratory of Industrial Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACTPhenylalanine hydroxylase (PAH) is a potential medicine for phenylketonuria (PKU). However, the application of PAH is mainly limited by its low thermostability and storage stability. The effects of several additives on the thermostability of PAH were tested in the present study. Addition of 10% glycerol could improve the residual activity of PAH to (98.3±0.8) % after incubation at 50 ℃ for 10 min, which was 3.1 times higher than that without protective additive. In addition, trehalose, raffinose and mannitol could improve residual activity of PAH to over 78%. In view of the possible adverse reactions of glycerol in the process of clinical application, the later three additives were optimized using the orthogonal experiment. An optimal combination additive of 2.5 mmol/L mannitol, 1 mmol/L raffinose and 1.5 mmol/L trehalose was obtained. With the optimal combination additive, residual activity of PAH could reach (99.3 ± 1.2) %, which was 3.1 times higher than that without protective additive. Both 10% glycerol and the optimal combination additive could significantly improve the storage stability of PAH at 4 ℃, 20 ℃ and 37 ℃. With 10% glycerol or combination additive, the half-life of PAH at 37 ℃ were increased to 129.9 h and 237.5 h, respectively, which were 1.9 times and 4.3 times higher than that without protective additive. The result laid the foundation for medical application of PAH.
Key wordsphenylalanine hydroxylase (PAH ); protective additive; thermostability
DOI:10.13995/j.cnki.11-1802/ts.201606010
基金项目:国家863计划(2014AA021304);2014年基本科研(JUSRP51411B);江苏高校优势学科建设工程资助项目(111-2-06)
收稿日期:2015-12-18,改回日期:2016-03-03
第一作者:硕士研究生(周哲敏教授为通讯作者,E-mail:zhmzhou@jiangnan.edu.cn )。
