两色金鸡菊花提取物的抗氧化活性测定及TLC-Bio分析抗氧化活性成分
2016-07-02古扎力努尔艾尔肯李新霞李琳琳毛新民
古扎力努尔·艾尔肯,王 健,兰 怡,李新霞,李琳琳,王 烨,毛新民
(新疆医科大学1中心实验室; 2基础医学院,乌鲁木齐 830011; 3附属中医医院,乌鲁木齐 830000; 4中医学院,乌鲁木齐 830011)
·药学研究·
两色金鸡菊花提取物的抗氧化活性测定及TLC-Bio分析抗氧化活性成分
古扎力努尔·艾尔肯1,王 健2,兰怡3,李新霞1,李琳琳2,王烨2,毛新民4
(新疆医科大学1中心实验室;2基础医学院,乌鲁木齐830011;3附属中医医院,乌鲁木齐830000;4中医学院,乌鲁木齐830011)
摘要:目的比较两色金鸡菊花不同极性提取物的体外抗氧化活性,并用TLC-Bio技术分析抗氧化活性成分。方法将两色金鸡菊花分别用水、甲醇、乙醇等溶剂提取;采用DPPH自由基以及羟基自由基清除法测定两色金鸡菊花不同极性提取物的自由基清除率,计算C50值,进行比较;建立两色金鸡菊花提取物的薄层展开条件,用薄层生物自显影技术(TLC-Bio)对抗氧化活性最强的提取物进行抗氧化活性成分的指认。结果DPPH自由基清除法测定结果:水提物C50=0.962 8 mg/mL,甲醇提物C50=0.203 0 mg/mL,乙醇提物C50=0.031 0 mg/mL;羟基自由基清除法测定结果:水提物C50=0.620 9 mg/mL,甲醇提物C50=1.702 3 mg/mL,乙醇提物C50=0.101 1 mg/mL;薄层生物自显影技术检测出具有抗氧化活性的斑点有8个,其中指认出3个成分,分别为马里苷、奥卡宁、 flavanokanin。结论两色金鸡菊花提取物中,DPPH自由基及羟基自由基清除能力最强的均是乙醇提取物。
关键词:两色金鸡菊; 抗氧化活性; 薄层生物自显影
两色金鸡菊(Coreopsis tinctoria Nutt.)俗名雪菊,属菊科金鸡菊属1年生草本植物,主要分布在新疆和田、喀什、皮山县克里阳乡等地;其为维吾尔族民间世代传承下来的养生、保健的天然植物,常花茶饮用[1];其具有清热解毒、和胃健脾、活血化瘀、软化血管等作用,对冠心病、糖尿病、高血脂等有一定的疗效[2-4]。两色金鸡菊的化学成分主要是黄酮类化合物。黄酮类化合物均具有清除自由基的作用,有抗氧化活性。本研究以Vc(抗氧化剂)为阳性对照,分别采用DPPH法和清除羟基自由基法(Fenton反应)[5-7],对两色金鸡菊花不同极性提取物进行体外抗氧化活性测定。采用薄层生物自显影技术(TLC-Bio)分析抗氧化活性部位中的具体化合物,现报道如下。
1仪器与试药
1.1实验药材药材两色金鸡菊由乌鲁木齐三高和药业有限公司提供,经新疆昌吉卫校杨卫星教授鉴定为菊科金鸡菊属1年生草本植物两色金鸡菊(Coreopsis tinctoria Nutt.)。
1.2实验仪器半自动点样仪(瑞士卡玛,LINOMAT5),薄层色谱数码成像系统(瑞士卡玛,REPROSTAR3),展开缸(20 cm×10 cm),硅胶G高效板(青岛海洋化工厂,5 cm×10 cm);离心机(Thermo公司,MULTIFUGEX-3R),分析天平(AB135-S,Mettler-Teledo),紫外可见分光光度计(GBC公司,Centra-401)。
1.3实验试剂马里苷(批号00013126-604,ChromaDEX),Flavanomarein(批号00006030-705,ChromaDEX),聚乙二醇400(天津市百世化工有限公司),1,1-二苯基苦基苯肼(DPPH)(Sigma),2-氨基乙基联苯基硼酸酯(Sigma),乙酸乙酯(20140612,分析纯),甲酸(T20140106,分析纯)。
2方法与结果
2.1实验溶液制备
2.1.1DPPH溶液制备用甲醇制备0.004% (4 mg/100 mL) 的溶液,作为DPPH原液。2.1.2Vc溶液制备称取一定量Vc对照品粉末,置于10 mL的容量瓶,并用甲醇溶解,定容至刻度。分别配成5、10、15、20、30、40、45 μg/mL的系列浓度。
2.1.3甲醇提取物样品制备从甲醇提取物储备液中吸取适量样品溶液置10 mL的容量瓶,用甲醇定容,配成浓度分别为0.05、0.1、0.2、0.4、0.5 mg/mL的甲醇提取物溶液。
2.1.4水提取物样品制备从水提取物储备液中吸取适量样品溶液置10 mL的容量瓶,用蒸馏水定容,配成浓度分别为0.1、0.5、1.0、1.5、2.0、3.0 mg/mL的水提取物溶液。
2.1.5乙醇提取物样品制备从乙醇提取物储备液中吸取适量样品溶液置10 mL的容量瓶,用乙醇定容,配成浓度分别为0.006 4、0.016 1、0.032 1、0.048 2、0.064 2、0.080 2 mg/mL的乙醇提取物溶液。
2.2两色金鸡菊不同极性提取部位对DPPH的清除作用用紫外分光光度计在200~700 nm处扫描,得到DPPH原溶液在516 nm处具有最大吸收峰。吸取4 mL的DPPH原溶液,加入1 mL甲醇混合,516 nm处测定反应溶液吸光度A0;再吸取4 mL的DPPH原溶液,分别加不入同浓度的样品溶液各1 mL,在室温暗处反应30 min。测定516 nm处吸光度Ai,吸取不同浓度的样品溶液各1 mL,分别加入4 mL的甲醇溶液,在室温暗处反应30 min。测定516nm处吸光度为Aj。最后计算出自由基清除率,绘制成曲线图(图1~4),根据公式:清除率 (%) =[1-(Ai-Aj)/A0]×100%,再计算出相应的IC50值。结果表明,VC对DPPH自由基的清除C50=0.019 1 mg/mL,两色金鸡菊不同极性提取部位对DPPH的清除C50值分别为:水提物C50=0.962 8 mg/mL,甲醇提物C50=0.203 0 mg/mL,乙醇提物C50=0.031 0 mg/mL,3种提取物中乙醇提取物的清除效果最好。
2.3两色金鸡菊不同极性提取部位对羟基自由基的清除作用取1 mL 0.75 mmol/L的邻二氮菲无水乙醇溶液置于试管中,依次加入0.2 mol/L的pH=7.40的磷酸盐缓冲溶液2 mL和蒸馏水2 mL,混匀,加入0.75 mmol/L的硫酸亚铁溶液(FeSO4) 1 mL,混匀,再加入0.01%的双氧水(H2O2) 1 mL,置于37℃水浴反应1 h,测其510 nm处损伤管的吸光值A损,以1 mLVC溶液或样品液代替蒸馏水,可以得到VC溶液或样品的510 nm处吸光值A样;用1 mL蒸馏水代替H2O2测得510 nm处吸光值为A未。重复3次。计算清除率:清除率(%)=(A样-A损)/(A末-A损)×100%。 分别测定VC、两色金鸡菊水提取物、甲醇提取物、乙醇提取物对羟基自由基的清除能力,绘制成曲线图(图5~8),并计算得各样品IC50值。结果表明,VC对羟基自由基的清除C50=0.019 1 mg/mL,两色金鸡菊不同极性提取部位对羟基自由基的清除C50值分别为:水提物C50=0.962 8 mg/mL,甲醇提物C50=0.203 0 mg/mL,乙醇提物C50=0.031 0 mg/mL,3种提取物中乙醇提取物的清除效果最好。
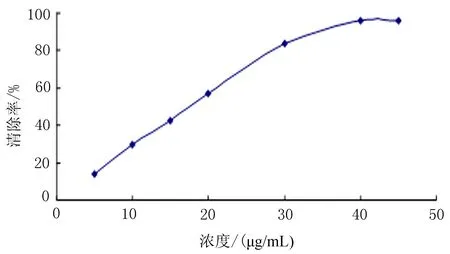
图1 VC清除DPPH曲线图

图2 两色金鸡菊水提取物清除DPPH曲线图

图3 两色金鸡菊甲醇提取物清除DPPH曲线图
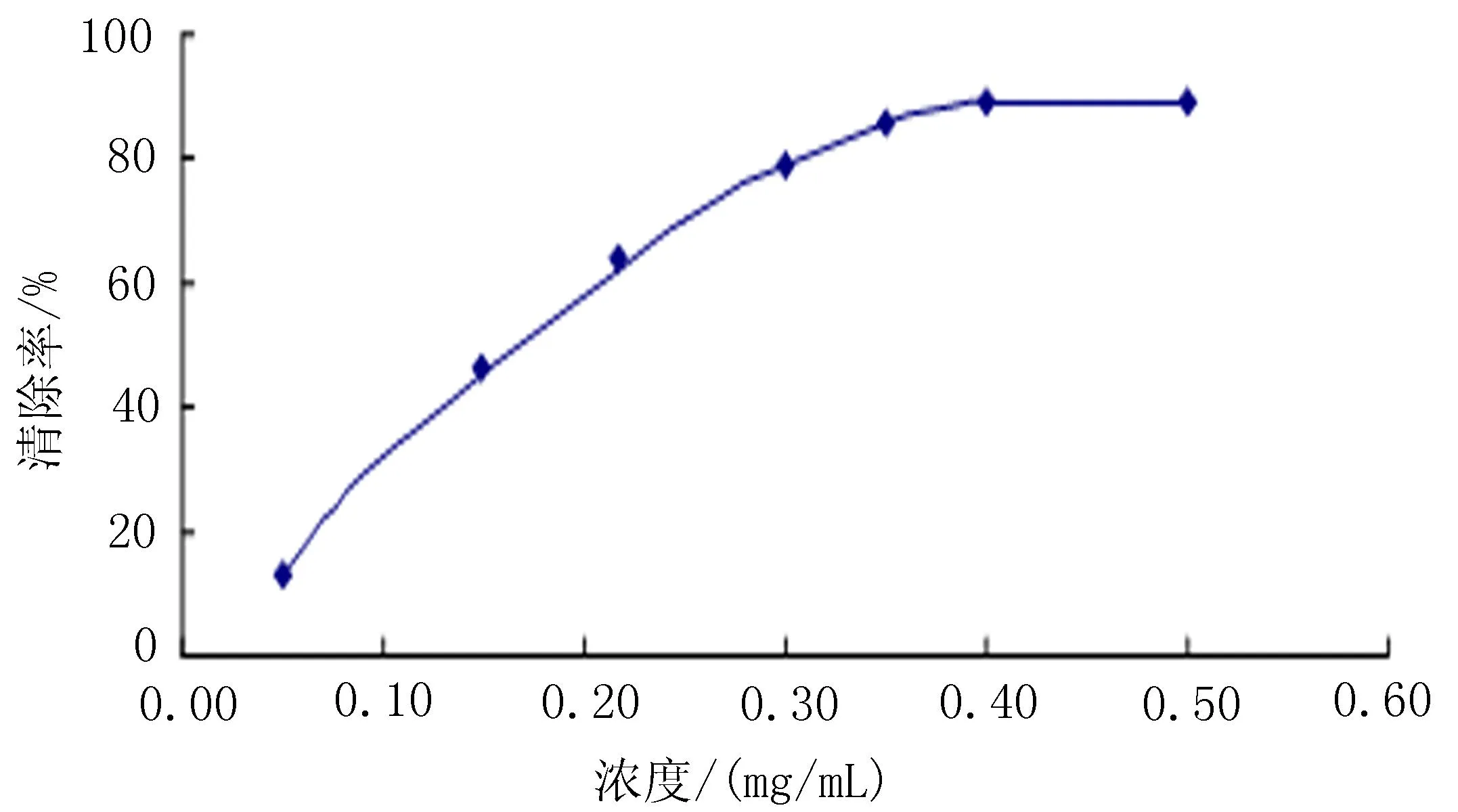
图4 两色金鸡菊乙醇提取物清除DPPH曲线图

图5 VC清除羟基自由基曲线图

图6 两色金鸡菊水提取物清除羟基自由基曲线图

图7 两色金鸡菊乙醇提取物清除羟基自由基曲线图
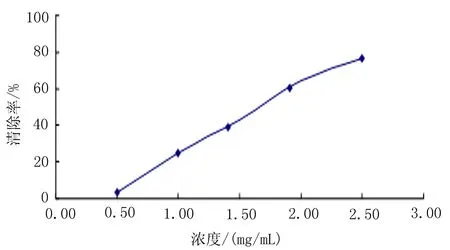
图8 两色金鸡菊水提取物清除羟基自由基曲线图
2.4TLC-Bio分析两色金鸡菊提取物的抗氧化活性成分由抗氧化试验结果确定两色金鸡菊花乙醇提取物有较强的抗氧化活性,结合薄层生物自显影技术[8-10]对提取物的抗氧化活性物质群进行分析。参考Concepcion等[7]研究两色金鸡菊中黄酮类化合物的薄层鉴别方法,进行展开方法优化,得到可将两色金鸡菊花乙醇提取物中化合物有效分离的展开溶剂条件:甲苯-乙酸乙酯-甲酸=9∶7∶3;取2块高效G硅胶薄层板(A、B板)。取两色金鸡菊花乙醇提取物溶液点样量为1 μL,用半自动点样仪分别点于2块硅胶G高效板上,每个板各点2点,进行展开;待展开完全后,将板取出晾干。将晾干的A板喷NP/PEG显示剂,于可见光及366 nm处检视(图9);将薄层图上斑点的颜色及Rf值同文献[7]中两色金鸡菊化合物薄层鉴别结果(表1)进行比较,指认出新疆两色金鸡菊花乙醇提取物展开板中Rf值为0.1、 0.4、0.73,依次对应于马里苷、flavanokanin、奥卡宁。

图9 A板薄层色谱图

Rf自然光UV366nm0.05棕色橘色0.1紫色红色0.4-绿色0.73粉色橘色
其中Rf = 0.1 为马里苷: Marein,Rf =0.4为flavanokanin;Rf=0.73为奥卡宁 : Okanin。
将B板喷DPPH(1 mL含0.08 mg的甲醇溶液),直到背景呈现紫色,在可见光下检视。样品显现白色、淡黄色斑点(图10),说明此处的化合物具有抗氧化活性。根据化合物确认结果,可确定Rf值为0.1、0.4、0.73,依次对应于马里苷、 flavanokanin、奥卡宁,全为白色斑点,都具有抗氧化活性。

图10 B板薄层色谱图
3讨论
将两色金鸡菊花不同溶剂提取物采用DPPH自由基清除法、羟基自由基清除法进行体外抗氧化研究,验证各提取物均对DPPH以及羟基自由基有较强的清除能力,即两色金鸡菊花不同溶剂提取物均有抗氧化活性,其中乙醇提取物抗氧化能力最强,其DPPH清除C50为0.031 0 mg/mL,接近于阳性对照药物VC的清除率(C50=0.019 1 mg/mL),羟基自由基清除C50为0.101 1 mg/mL,强于阳性对照药物VC的清除率(C50=0.430 3 mg/mL)。可见两色金鸡菊花的抗氧化活性具有进一步研究开发的价值。将抗氧化活性测定结果与TLC-Bio技术结合,指认两色金鸡菊花提取物中具有抗氧化作用的化学物质,为两色金鸡菊的进一步研发打下了基础。薄层生物自显影结果显示两色金鸡菊花乙醇提取物中,有抗氧化活性的物质大多为黄酮类化合物,其中马里苷、Flavanokanin、奥卡宁均显示有很好的抗氧化活性。下一步研究中,可将已确定具有抗氧化活性的物质通过分离纯化后进行细胞实验或动物体内抗氧化活性实验等,研究其作用机制,确定两色金鸡菊的药效物质基础。
参考文献:
[1]新疆植物志编辑委员会.新疆植物志[M].乌鲁木齐:新疆科技卫生出版社,1999:33.
[2]梁淑红,刘晓燕.金鸡菊提取物降血脂作用的动物实验研究[J].农垦医学,2009,31(6):495-498.
[3]梁淑红,哈木拉提·吾普尔.金鸡菊提取物降压化学成分实验研究[J].时珍国医国药,2010,21(7):1619-1621.
[4]张淑鹏,李琳琳,木合布力·阿布力孜,等.昆仑雪菊提取物对α葡萄糖苷酶的抑制作用[J].现代生物医学进展,2011,11(6):1055-1057.
[5]汪祺,张聿梅,戴忠,等.黄芪中氨基酸、黄酮类成分的特征薄层图谱鉴别[J].中国药事,2012,26(1):50-52.
[6]隋辉,王文.氧自由基与高血压关系研究进展[J].高血压杂志,2002,10(5):414-416.
[7]Concepcion SM,Jose AL.Free radical scavenging capacity and inhibition of lipid oxidation of wines,grape juices and related polyphenolic constituents[J].Food Res Int,1999,32(1):407-410.
[8]杨映雪,陈建业,王亚平.黄芪总黄酮的抗氧化作用[J].川北医学院学报,2007,22(6):606-608.
[9]辛晓林,刘长海.中药多糖抗氧化作用研究进展[J].北京中医药大学学报,2000,23(5):54-56.
[10]罗丽萍,高荫榆,洪雪娥,等.薯蔓黄酮和多糖体内抗氧化作用研究[J].食品科学,2005,26(8):408-410.
(本文编辑施洋)
Determine antioxidative activity of different solvent extracts from the Coreopsis Tinctoria and analyse with the TLC-Bio
Guzhalinuer Aierken1,WANG Jian2,LAN Yi3,LI Xinxia1,LI Linlin2,WANG Ye2,MAO Xinmin4
(1Central Laboratory, Xinjiang Medical University, Urumqi 830011, China;2College of Basic,Xinjiang Medical University, Urumqi 830011, China;3Affiliated Hospital of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830000, China;4College of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830011, China)
Abstract:ObjectiveA Comparative study of antioxidative activity of different solvent extracts from the Coreopsis Tinctoria with an analysis on the antioxidative composition by TLC-Bio technology. MethodsConduct extraction processes on the Xinjiang Coreopsis Tinctoria with water, methanol and ethanol and other solvents; Determine the free radical scavenging rate of the different solvent extracts by the DPPH and (·OH) free radical scavenging assay, and calculate the C50values for comparison; Establish conditions for the TLC expansion on the extracts to identify the antioxidative composition of the extracts with the strongest antioxidant activity by TLC-bioautography. ResultsDPPH free radical scavenging assay data: water extract C50=0.962 8 mg/mL, methanol extract C50=0.203 0 mg/mL, ethanol extract C50=0.031 0 mg/mL; (·OH) free radical scavenging assay data: water extract C50=0.620 9 mg/mL, methanol extract C50=1.702 3 mg/mL, ethanol extract C50=0.101 1 mg/mL; TLC-bioautography found there were eight blotches with antioxidant activity, three of which were identified, namely mali glycosides, okanin and flavanokanin. ConclusionEthanol extract was the best of the DPPH free radical scavenging assay and the (·OH) free scavenging assay.
Keywords:
Coreopsis Tinctoria Nutt., antioxidative activity, TLC-Bio
基金项目:NSFC-新疆联合基金重点项目(U1303223);新疆医科大学创新基金(XJDCX201403)
作者简介:古扎力努尔·艾尔肯(1986-),女(维吾尔族),硕士,研究实习员,研究方向:药理学。 通信作者:毛新民,男,博士,教授,博士生导师,研究方向:糖尿病药理学,E-mail: mxm3277@sina.com。
中图分类号:R963
文献标识码:A
文章编号:1009-5551(2016)07-0858-04
doi:10.3969/j.issn.1009-5551.2016.07.011
[收稿日期:2015-5-16]
