黄芪多糖的提取与抗氧化活性检测
2015-10-09吴铭韩丹郭立泉
吴铭++韩丹++郭立泉


摘要:利用超声波提取法从黄芪(Radix astragali)中提取多糖,应用正交试验法优化提取条件,并采用超氧阴离子和DPPH自由基体系对黄芪多糖的抗氧化活性进行研究。结果表明,黄芪多糖提取的最佳条件为固液比1∶20、超声提取时间12 min、超声功率65 W、超声提取温度60 ℃,在此条件下,黄芪多糖提取率为8.75%。抗氧化活性试验结果表明,黄芪多糖具有较高的清除DPPH自由基和超氧阴离子自由基的活性。
关键词:黄芪(Radix astragali)多糖;超声波提取; 正交试验;抗氧化活性
中图分类号:R284 文献标识码:A 文章编号:0439-8114(2015)17-4263-03
DOI:10.14088/j.cnki.issn0439-8114.2015.17.040
黄芪(Radix astragali)是一种常见的中药,属于豆科黄芪属,以根入药,具有补气升阳、脱毒、利水消肿、益胃固表等功效,是中国传统的补益药[1]。现代医药研究发现,它能有效治疗各种疾病,已被广泛应用于增强人体的免疫系统[1,2]。黄芪含有大量的生物活性成分,包括皂苷、黄酮和多糖[3]。多糖是黄芪已确定的主要生物活性成分之一。有研究表明,黄芪多糖有抗肿瘤、抗氧化、抗高血压和免疫调节活性[4]。
黄芪多糖的提取方法是研究黄芪多糖活性的第一步,最常见的提取方法是利用传统的溶剂萃取法从植物中提取多糖,但这些方法通常存在提取时间较长、提取温度较高,且提取效率较低等缺点[5,6]。近年又发展了几种从植物中提取多糖的新技术,包括超临界流体萃取法,超声波提取法和微波提取法。其中,超声波提取法相比其他方法对植物材料的结构和分子性质损害更低[7]。利用超声波的空化作用、机械效应和热效应可以加强胞内物质的释放、扩散和溶解,从而显著提高提取效率[8,9]。由于这些原因,超声波提取法被广泛应用于植物多糖的提取。本研究利用超声波提取法从黄芪中提取黄芪多糖(RAP),应用正交试验优化提取条件,然后采用超氧阴离子自由基体系和DPPH自由基体系对黄芪多糖的抗氧化活性进行研究。
1 材料与方法
1.1 材料
干黄芪购买于长春市草药药店。DPPH(1,1-diphenyl-2-picrylhydrazyl)、BHT(Butylated hydroxy toluene)、NADH(Nicotinamide adenine dinucleotide)和NBT(Nitroblue tetrazolium)为Sigma公司产品;其他的化学试剂均为分析纯。
1.2 黄芪多糖的提取及单因素试验
将干黄芪磨成细粉,过40目筛。然后将干粉沉浸在去离子水中,调整固液比(1∶10、1∶15、1∶20、1∶25、1∶30,m/V,g∶mL)、超声提取时间(5、10、15、20、25 min)、超声功率(40、50、60、70、80 W)和超声提取温度(30、40、50、60、70 ℃),收集提取液,于3 000 r/min离心10 min,取上清,按sevag法(氯仿/正丁醇=5∶1)脱蛋白质,用真空旋转蒸发仪将滤液浓缩,取滤液加4倍体积的95%乙醇进行沉淀,放置过夜,次日以3 000 r/min离心10 min,取沉淀用丙酮和乙醇清洗,得到粗多糖。多糖提取率的计算公式为:Y=m2/m1×100%,其中,Y表示多糖提取率(%),m1表示多糖的质量(g),m2表示干黄芪样品质量(g)。
1.3 黄芪多糖提取正交优化试验
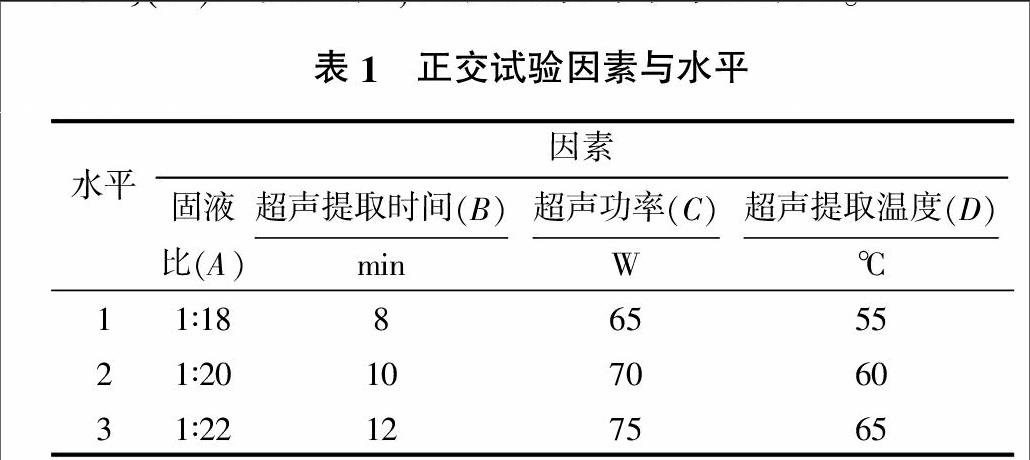
在单因素试验的基础上,对固液比、超声提取时间、超声功率和超声提取温度进行4因素3水平的L9(34)正交试验,试验因素与水平见表1。
1.4 黄芪多糖的抗氧化活性测定
1.4.1 DPPH自由基体系[10] 将黄芪多糖配成不同浓度(0.05、0.10、0.15、0.20、0.25、0.30 mg/mL)的待测液,另外用50%乙醇配置6 mg/100 mL的DPPH溶液。在试管中依次加入1 mL黄芪多糖不同浓度待测液和2 mL DPPH溶液,室温放置(避光)反应30 min,然后在517 nm处测定吸光度,以1 mL 50%乙醇加入到2 mL DPPH溶液中作为空白对照,以二叔丁基对甲酚(BHT)作为参照。每个样品做3个平行样,取其平均值。DPPH清除率计算公式如下:
SCDPPH=(1-■)×100%
式中,SCDPPH为DPPH的清除率;AS517 nm为样品的吸光度;Ac517 nm为对照的吸光度。
1.4.2 超氧阴离子自由基体系 将黄芪多糖配成不同浓度(0.05、0.10、0.15、0.20、0.25、0.30 mg/mL)的待测液,取1 mL NTB溶液(156 μmol/L NBT溶于100 mmol/L磷酸盐缓冲液,pH 7.4)、1 mL NADH溶液(468 μmol/L NADH溶于100 mmol/L磷酸盐缓冲液,pH 7.4)和1 mL不同浓度黄芪多糖待测液,混匀后,加入100 μL的PMS溶液(60 μmol/L PMS溶于100 mmol/L磷酸盐缓冲液,pH 7.4),混匀后置于25 ℃水浴中反应5 min,然后在560 nm处测定吸光度,以空白样品作为对照,以BHT作为参照。每个样品做3个平行样,取其平均值。超氧阴离子清除率计算公式如下:
SC■=(1-■)×100%
式中,SC■为超氧阴离子的清除率;AS517 nm为样品的吸光度;AC517 nm为对照的吸光度。
2 结果与分析
2.1 黄芪多糖提取的单因素试验结果
在超声提取时间为10 min、超声功率为60 W、超声提取温度为50 ℃时,考察固液比对黄芪多糖提取的影响,结果(图1A)表明,黄芪多糖提取的最佳固液比例为1∶20。在此基础上,对超声提取时间进行单因素试验,结果(图1B)表明,最适超声提取时间为10 min。进一步对超声功率进行单因素试验,结果(图1C)表明,最适超声功率为70 W。最后,在上述各最适条件的基础上,考察超声提取温度对黄芪多糖的影响,结果(图1D)表明,最适超声提取温度为60 ℃。
2.2 黄芪多糖提取的正交试验优化结果
黄芪多糖提取条件的正交试验优化结果见表2。由表2可知,4个因素对黄芪多糖提取率影响的主次因素为A、B、D、C,最佳提取条件组合是A2B2C1D2,实际试验组合中以A2B3C1D2提取率最高,方差分析可知B因素2水平与3水平差异不显著,因此选取A2B3C1D2为最佳组合,即固液比为1∶20,超声提取时间为12 min,超声功率为65 W,超声提取温度为60 ℃,在此条件下,黄芪多糖的提取率为8.75%。
2.3 黄芪多糖的抗氧化活性检测结果
由图2A可知,在浓度为0~0.20 mg/mL时,黄芪多糖对DPPH自由基的清除率比参照BHT弱,当浓度为0.25~0.30 mg/mL时,黄芪多糖对DPPH自由基的清除率超过了BHT。由图2B可知, 随着浓度的增加,黄芪多糖和BHT对超氧阴离子自由基的清除率也随之增强,且BHT对超氧阴离子的清除率一直高于黄芪多糖。总的来说,黄芪多糖具有较高的清除DPPH自由基和超氧阴离子自由基的活性,且对DPPH自由基的清除能力更强。
3 小结
超声波提取法已经被广泛应用于黄芪多糖的快速提取,由正交试验结果可知,黄芪多糖最佳提取条件为固液比1∶20、超声提取时间12 min、超声功率65 W、超声提取温度60 ℃,在此条件下,黄芪多糖的提取率为8.75%。此外, 通过对黄芪多糖清除超氧阴离子自由基和DPPH自由基的研究表明,黄芪多糖具有清除DPPH自由基和超氧阴离子自由基的活性,黄芪多糖的抗氧化活性和抗氧化机制有待进一步研究。
参考文献:
[1] 吴 铭,周桃英,陈年友,等.黄芪多糖抗疲劳作用研究[J].湖北农业科学,2014,53(1):175-177.
[2] 许灵波. 黄芪多糖在动物生产中应用的研究进展[J].中国畜牧杂志,2015,51(3):84-87.
[3] KALLON S,LI X,JI J,et al. Astragalus polysaccharide enhances immunity and inhibits H9N2 avian influenza virus in vitro and in vivo[J]. J Anim Sci Biotechnol,2013,4(1):22-33.
[4] DU X G,ZHAO B,LI J Y,et al. Astragalus polysaccharides enhances immune responses of HBV DNA vaccination via promoting the dendritic cell maturation suppressing Treg frequency in mice[J]. Int Immunopharmacol,2012,14(4):463-470.
[5] LI R,CHEN W C,WANG W P,et al. Extraction, characterization of Astragalus polysaccharides and its immune modulating activities in rats with gastric cancer[J]. Carbohydrate Polymers,2009,78(4):738-742.
[6] QIU H H,CHENG G L,XU J Q,et al. Effects of Astragalus polysaccharides on associated immune cells and cytokines in immunosuppressive dogs[J]. Procedia in Vaccinology,2010,2(1):26-33.
[7] YAN F,ZHANG Q Y,JIAO L,et al. Synergistic hepatoprotective effect of Schisandrae lignans with Astragalus polysaccharides on chronic liver injury in rats[J]. Phytomedicine,2009, 16(9):805-813.
[8] ZHANG J,XIE X,LI C,et al. Systematic review of the renal protective effect of Astragalus membranaceus (root) on diabetic nephropathy in animal models[J]. Journal of Ethnopharmacology,2009,126(2):189-196.
[9] LI X Y,WANG Z Y,WANG L, et al. Ultrasonic-assisted extraction of polysaccharides from Hohenbuehelia serotina by response surface methodology[J].Int J Biol Macromol,2012,51(4):523-530.
[10] WANG K,WANG Y,LIN S,et al. Analysis of DPPH inhibition and structure change of corn peptides treated by pulsed electric field technology[J].J Food Sci Technol,2015,52(7):4342-4350.
