骨髓间充质干细胞条件培养液对H2O2诱导PC12细胞损伤的保护*
2016-06-27林珊珊朱波付高勇
林珊珊 朱波 付高勇
(宜宾市第一人民医院 1. 康复医学科,2. 血管外科,四川 宜宾 644000)
·论著·
骨髓间充质干细胞条件培养液对H2O2诱导PC12细胞损伤的保护*
林珊珊1朱波2付高勇1
(宜宾市第一人民医院1. 康复医学科,2. 血管外科,四川 宜宾 644000)
【摘要】目的探讨骨髓间充质干细胞(BMSC)条件培养液 (CM)对氧化应激损伤神经细胞的保护作用。方法采用密度梯度离心联合贴壁法分离SD大鼠BMSC,采用流式细胞术,成骨、成脂诱导分化鉴定BMSC,提取骨髓间充质干细胞条件培养液。制作过氧化氢损伤PC12细胞模型,实验分为对照组、H2O2损伤组以及共培养组。MTT检测BMSC-CM对损伤PC12细胞活性的影响,流式细胞术检测各组凋亡率的变化,免疫印迹法分别检测硫氧还蛋白(Trx)、B淋巴细胞瘤/白血病-2(Bcl-2)蛋白、Bcl-2相关X蛋白(Bax)水平的变化。结果分离提取的BMSC高表达CD29,CD44,不表达CD31,CD45。BMSC-CM能提高H2O2损伤PCI2细胞的活力,使细胞凋亡率下降,Trx和Bcl-2的蛋白量增加,Bax蛋白水平下降。结论BMSC-CM通过提高受损细胞内Trx、Bcl-2水平,降低Bax蛋白水平,一定程度上抑制了过氧化氢致PC12细胞氧化应激和凋亡。
【关键词】骨髓间充质干细胞;条件培养液;过氧化氢;PC12细胞;氧化应激
神经系统退行性疾病,是一类慢性进行性中枢神经系统退行性变疾病的总称,包括阿尔茨海默病(AD)、小脑萎缩症、肌萎缩侧索硬化症(ALS)、帕金森氏病(PD)、多发性硬化(MS)、亨廷顿病(HD)等,此类疾病的病因及其机制目前尚未完全阐明。但近年研究表明,氧化应激损伤在阿尔茨海默病及多发性硬化等神经系统退行性疾病的发生发展过程中具有重要的作用,可导致神经元胞膜的破坏、通透性增加,进而引起Ca2+大量涌入胞内,激活细胞内钙依赖性激酶、促进自由基的产生,造成生物分子物质氧化损伤,最终导致细胞损伤甚或死亡[1]。在神经系统中,NGF、BDNF、bFGF等神经营养和保护因子可通过不同的机制起着神经保护的作用,减少神经细胞的凋亡,促进神经组织与细胞损伤修复及功能改善[2-4]。近年研究证实间充质干细胞移植可促进中枢神经系统疾患的损伤修复以及功能的改善[5-8]。但骨髓间充质干细胞移植人体后,由于多种不利因素的影响,细胞很快发生死亡。进一步研究发现,骨髓间充质干细胞发挥治疗作用更有可能与其分泌的细胞因子有关[9, 10]。本实验通过体外培养、纯化BMSCs并收集其条件培养液,观察BMSCs分泌物对过氧化氢诱导的PCI2细胞损伤的保护作用。可为神经系统退行性疾病的治疗提供新的解决方案。
1材料和方法
1.1主要材料PC12细胞由军事医学科学院放射与辐射医学研究所提供。2周龄SD大鼠(雌雄不限),由军事医学科学院实验动物中心提供。α-MEM培养基(Gibco公司),高糖DMEM培养基(Gibco公司),胰蛋白酶(Sigma公司),Ficoll-hypague(天津血液学研究所提供),马血清(Gibco公司),胎牛血清(HyClone公司), MTT (Sigma公司),地塞米松、1-甲基-3异丁基-黄嘌呤和吲哚美辛(美国Sigma 公司),β-甘油磷酸钠盐和维生素C (美国Fluka 公司)抗鼠CD29、CD31、CD44、CD45抗体(PharMingen公司),Bcl-2、Bax抗体、兔抗Trx (美国Cell Signaling公司)、GAPDH小鼠抗大鼠多克隆抗体、兔抗小鼠抗体、羊抗兔抗体(英国Abcam公司) 、凯基AnnexinV-FITC细胞凋亡检测试剂盒(南京凯基生物)。
1.2BMSCs分离与培养SD大鼠脱臼处死,75%酒精浸泡5min,无菌条件下取出大鼠胫骨和股骨,用含10%血清的 a-MEM 培养基冲洗髓腔,采用密度梯度离心法分离获取单个核细胞,接种于含 10%胎牛血清的α-MEM培养液中,接种密度为1×106cells/cm2,将细胞置于5% CO2、37℃条件下培养,48h后半量换液,4d后全量换液以去除未贴壁细胞,以后每2天换液一次。待细胞克隆团生长至80~90%融合时,用0.05%胰蛋白酶消化后进行传代培养。
第三代 BMSCs生长融合至 70~80%,PBS洗涤两遍后用 DMEM培养基培养,置体积分数 1%O2、5%CO2、94% N2孵箱条件培养,培养 12h 后收上清,2 000 r/min 离心 10 min 弃去细胞碎片,将获取的 BMSCs 条件培养基-80 ℃冻存备用。
1.3骨髓间充质干细胞鉴定收获大鼠BMSCs,PBS洗涤2次后,每管5×105个细胞,分别加入FITC/PE标记的抗鼠单克隆抗体CD29、CD31、CD44、CD45,室温避光孵育30 min,PBS 洗涤两次,将洗涤后的细胞悬于300μL PBS 中,应用流式细胞仪收集数据(BD公司FACSCALIBUR型),WinMDI2.9软件分析结果。
体外诱导分化实验时,将细胞按2×104/孔接种于24孔板中,待细胞60~70%融合时,加入成脂诱导培养液(含胎牛血清10%,1-甲基-3异丁基-黄嘌呤0.5μM,地塞米松10-6M,吲哚美辛10-4M,胰岛素10ng/ml)和成骨诱导培养液(含胎牛血清10%,地塞米松10-7M,维生素C 50 μM,β甘油磷酸钠10 mM),每3天更换一次。约2周后,分别使用油红O和碱性磷酸酶染色,以鉴定成脂肪细胞和成骨细胞。
1.4PC12细胞培养及H2O2损伤模型的建立PCI2细胞用含有5%胎牛血清、10%马血清的高糖DMEM培养基,在37℃、5%CO2的培养箱中进行培养,细胞增殖至80%时进行传代接种。实验前将培养液更换为无血清培养基培养,以终止血清对实验的影响。12h后再次换液,加入含有终浓度为200μmmol/L H2O2的培养基。分别培养0,6h,12h,24h,加入 20 μL MTT,继续孵育 4 h,弃去上清,加入二甲基亚砜(DMSO) 150 μL 溶解结晶。用全自动酶标仪检测波长为490 nm 时的吸光度 A 值。每组均设 6 个副孔,取平均值计算细胞的抑制率。观察H2O2作用不同时间对PC12细胞活性的影响,建立损伤模型。
1.5BMSC-CM 对H2O2损伤PC12细胞保护作用将正常培养的PC12细胞进行传代接种,实验分为正常培养组 (DMEM)、模型组 (DMEM+0.2 mmol/L H2O2)、MSC-CM 组(MSC-CM+0.2 mmol/L H2O2),每组6个副孔。正常培养 2 d,无血清培养 12 h 后,换各组培养液作用12h,MTT检测各组细胞活性。收集各组细胞,AnnexinV-PI 凋亡试剂盒说明检测凋亡率。
1.6免疫印迹分析将各组培养瓶中细胞吸去培养基,用预冷的D-Hank′s液洗3遍,RIPA裂解细胞,提取总蛋白,BCA法测蛋白质浓度,取40μg总蛋白进行SDS-PAGE电泳。电转法将蛋白质转移到NC膜上,5%脱脂牛奶室温下封闭2h。兔抗Trx,鼠抗Bcl-2抗体、Bax抗体或GAPDH抗体4℃孵育过夜。经洗涤后,加入辣根过氧化物酶标记的抗兔或抗小鼠二抗,室温反应2 h,化学发光法(ECL)显示结果,并曝光于胶片上。
2统计学分析
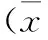
3结果
3.1BMSCs培养与鉴定分离培养的BMSC流式细胞检测结果显示高表达CD29,CD44,不表达或低表达CD31,CD45(图1A)。实验结果表明,所获取的BMSC得到高度纯化。通过诱导可以分化脂肪细胞(图1B)成骨细胞(图1C)。符合国际干细胞协会关于间充质干细胞的鉴定标准。

图1BMSC鉴定。图A:流式细胞术鉴定结果;图B:BMSC成脂分化;图C:BMSC成骨分化
Figure 1Identification of BMSCs
3.2H2O2对PC12细胞活性的影响将终浓度为200μmmol/LH2O2作用于PC12细胞0,6,12,24h后,采用MTT法检测H2O2对细胞活性的影响。结果表明,随着作用时间的增加,PC12细胞活性逐渐下降,各组细胞活性分别为100.00±1.98%(Con),89.53±4.67%(6h),74.26±3.19%(12h),65.68±4.09%(24h)。培养12h和24h后,H2O2损伤组与对照组相比具有显著性差异(P<0.05 vs. Con),见图2。
图2H2O2作用不同时间后对 PC12细胞活性的影响
Figure 2Effects of H2O2on the cell viability of PC12 cells
3.3BMSC-CM对损伤细胞活性的影响MTT结果表明,与对照组相比,H2O2组细胞活性显著降低(P<0.05),共培养组细胞活性与H2O2组相比显著增加,各组细胞活性分别为100.00±1.59%(Con),73.09±5.13%(H2O2),87.91±5.29%(H2O2+CM)。实验结果具有统计学差异(P<0.05 vs. control;P<0.05 vs. H2O2),见图3 。

图3BMSC-CM对H2O2损伤细胞的保护作用
Figure 3Effects of BMSC-CM on cell viability of H2O2-injured PC12 cells
3.4BMSC-CM对PC12细胞凋亡率的影响流式细胞检测结果表明,与对照组相比,H2O2组细胞凋亡率增加(P<0.05)。BMSC-CM共培养组细胞凋亡率与损伤组相比,差异具有统计学意义,各组细胞凋亡率分别为3.52±1.79%(Con),30.47±4.38%(H2O2),19.58±3.81%(H2O2+CM)(P<0.05 vs. Control;P<0.05 vs. H2O2),见图4。

图4BMSC-CM影响PC12细胞凋亡的结果分析
Figure 4Protection of BMSC-CM against apoptosis of PC12 cells
3.5BMSC-CM对Trx、Bcl-2、Bax蛋白表达的影响免疫印迹结果显示,与对照组相比,共培养组PCI2细胞内Bcl-2和Trx蛋白两者均升高,Bax蛋白水平有所下降,差异具有统计学意义(P<0.05)(图5)。
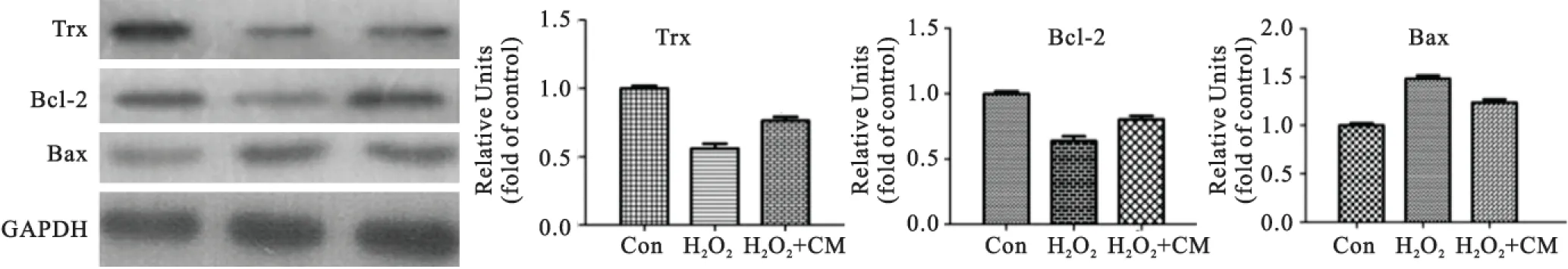
图5BMSC-CM对损伤PC12细胞Trx、Bcl-2、Bax蛋白表达的影响
Figure 5Western blot analysis of the effects of BMSC-CM on Trx, Bax and Bcl-2 levels in PC12 cells
4讨论
氧化应激在多种神经系统退行性疾病的发生发展中具有中心调节作用,是神经退行性疾病中引起细胞损伤的一个主要原因。氧化应激可以引起细胞成分的破坏,继而导致神经细胞损伤、凋亡或者坏死[1,11]。H2O2是一类活性氧,可以与胞膜及胞内物质反应生成活性更强的氧自由基,造成细胞损伤,因而,在氧化应激损伤的体外研究中,H2O2被广泛用作氧化应激的诱导剂[12]。PC12细胞,为大鼠肾上腺嗜铬细胞瘤细胞株,由于其具有类似神经细胞的特性,而被广泛应用于体外神经系统损伤模型[13]。
作为一种新兴的细胞学治疗方法,干细胞移植在基础与临床实验中已证实对组织损伤及神经系统退行性疾病具有治疗作用,但具体机制并未完全清楚。近来研究表明,移植入体内的BMSCs,由于缺血缺氧、PH、炎症以及凋亡因子等恶劣移植环境的影响,在短期内即发生大量死亡,因此,移植细胞多向分化、替代损伤学说受到质疑[9]。现普遍认为BMSCs 的旁分泌作用可能是发挥损伤修复作用的主要机制[9, 14]。研究发现间充质干细胞条件培养基中含有多种与神经营养、组织修复、血管生成及抗凋亡等作用相关的生物活性物质,具有促进细胞的增殖、分化,抑制细胞的凋亡和坏死,提高细胞生存的作用[15,16]。
我们利用200μmmol/L H2O2作用于PC12细胞不同时间,观察其对细胞活性的影响。实验发现,随着H2O2作用时间的增加,PC12细胞的活性有所下降,结果说明H2O2诱导PC12细胞的损伤与凋亡。根据实验结果,我们选用200μmmol/L H2O2作用12h作为损伤模型组。通过进一步实验发现,与损伤组相比,BMSC-CM与H2O2损伤细胞共培养后,可显著提高损伤细胞的活性,降低细胞凋亡率。提示骨髓间充质干细胞条件培养液可明显减轻H2O2对PC12细胞的损伤及凋亡诱导作用。
Trx是一类多功能蛋白,缺氧/复氧能诱导其产生,从而保护各类氧化应激损伤的细胞,此外Trx还能促进细胞的生长,抑制其凋亡并调节各种炎症反应。Trx对维持体内的氧化还原状态有重要的作用,通过结合抑制凋亡信号途径的多种激酶而起到抗凋亡作用[17]。Bcl-2蛋白家族是细胞凋亡的重要调控因子,其家族成员可分为抗凋亡蛋白如Bcl-2、Bcl-XL,以及促凋亡蛋白如Bax、Bad等[18]。两类蛋白相互作用发挥对凋亡的调控作用,二者之间的比率失调,便会影响细胞的活性或凋亡。本研究中,BMSC-CM与H2O2损伤PC12细胞共培养后,Trx和Bcl-2蛋白水平较损伤组增加,而Bax蛋白表达水平较损伤组下降。实验结果提示,BMSC-CM可能通过上调Trx蛋白发挥对H2O2诱导的PCI2细胞的抗氧化和抗凋亡作用。而Trx的抗凋亡作用可能与上调Bcl-2蛋白水平有关,有待进一步研究。
5结论
氧化应激是引起神经细胞损伤、凋亡或者坏死的重要原因之一。本研究通过将BMSC-CM与H2O2损伤PCI2细胞共培养,一定程度上证实了BMSC-CM通过提高受损细胞内Trx、Bcl-2水平,降低Bax蛋白水平发挥抗氧化应激和凋亡的作用。为进一步研究BMSC-CM抗氧化及凋亡的作用提供了一定的实验基础及理论依据。
【参考文献】
[1]阿部康三. 氧化应激与神经系统疾病[J]. 日本医学介绍, 2006, 12(27): 556-557.
[2]郝飞, 梁战华, 李爱萍, 等. 骨髓间充质干细胞应用于多发性硬化的基础及临床研究进展[J]. 中国神经免疫学和神经病学杂志, 2014, 02(21): 134-137.
[3]罗雪丹, 徐冰, 周进, 等.骨髓间充质干细胞分泌物对淀粉样β蛋白1~40损伤PC12细胞的神经保护作用[J].中国组织工程研究与临床康复,2009,13(40):7937-7941.
[4]潘晓华, 刘国荣, 姜长春. 骨髓间充质干细胞治疗缺血性脑血管病的研究进展[J]. 内蒙古医学杂志, 2010, 09(42): 1086-1090.
[5]Egashira Y,Sou S,Yukiya S,etal.The conditioned medium of murine and human adipose-derived stem cells exerts neuroprotective effcts against experimental stroke model. Brain Res, 2012; 1461(21): 87-95.
[6]刘静, 韩冬梅, 丁丽, 等. 脐带间充质干细胞鞘内注射治疗脊髓小脑性共济失调[J].中国组织工程研究, 2014; 41: 6666-6670.
[7]Cho YJ, Song HS, Bhang S,etal. Therapeutic effects of human adipose stem cell-conditioned medium on stroke[J]. J Neurosci Res, 2012(90):1794-1802.
[8]Zheng W, Honmou O, Miyata K,etal.Therapeutic benefits of human mesenchymal stem cells derived from bone marrow after global cerebral ischemia[J]. Brain Res, 2010; 1310:8-16.
[9]郭子宽. 间充质干细胞及其临床应用中的几个问题[J]. 中国组织工程研究, 2012; 01(16): 1-10.
[10] Kinnaird T, Stabile E, Burnett MS,etal. Marrow-derived stromal cells express genes encoding abroad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms[J].Circ Res, 2004; 94(5):678-685.
[11] Zhang L, Bahety P, Ee PL. Wnt co-receptor LRP5/6 overexpression confers protection against hydrogen peroxide-induced neurotoxicity and reduces tau phosphorylation in SH-SY5Y cells. Neurochem Int, 2015,87*9):13-21.
[12] 谢振华, 刘长振, 王爱民, 等. 过氧化氢对PC12细胞中硫氧还蛋白和APE/Ref-1基因表达的影响[J]. 中国老年学杂志, 2007, 2(27): 247-249.
[13] Westerink R, Ewing A. The PC12 cell as model for neurosecretion. Acta Physiol (Oxf), 2008,192(2):273-285.
[14] Boomsma RA, Geenen DL. Mesenchymal stem cells secrete multiple cytokines that promote angiogenesis and have contrasting effects on chemotaxis and apoptosis[J]. PLoS ONE, 2012; 7e:35685.
[15] Chen L, Xu Y, Zhao J,etal. Conditioned medium from hypoxic bone marrow-derived mesenchymal stem cells enhances wound healing in mice[J]. PLoS One, 2014,29;9(4):e96161.
[16] Cantinieaux D, Quertainmont R, Blacher S,etal. Conditioned medium from bone marrow-derived mesenchymal stem cells improves recovery after spinal cord injury in rats: an original strategy to avoid cell transplantation[J]. PLoS One, 2013,27;8(8):e69515.
[17] Masutani H, Ueda S, Yodoi J. The thioredoxin system in retroviral infection and apoptosis[J]. Cell Death Differ, 2005, 12(8): 991-998.
[18] Malla R, Gopinath S, Alapati K,etal. Downregulation of uPAR and Cathepsin B induces apoptosis via regulation of Bcl-2 and Bax and inhibition of the PI3K/Akt pathway in gliomas[J]. PloS one, 2010,29;5(10):e13731.
Effect of bone marrow mesenchymal stem cells conditioned medium on protection of hydrogen peroxide injured PC12 cells
Lin Shanshan, Zhu Bo, Fu Gaoyong
(DepartmentofRehabilitationMedicine,TheFirstPeople′sHospitalofYibin,Yibin644000,Sichuan,China)
【Abstract】ObjectiveTo explore the impact of bone marrow mesenchymal stem cells conditioned medium (BMSC-CM) on the oxidative stress and apoptosis of PC12 cells induced by hydrogen peroxide. MethodsBMSCs were isolated and purified with density-gradient centrifugation method. The surface markers of BMSCs reacted against different antibodies were collected and detected by flow cytometry. Experiment was divided into three groups including control group, H2O2-injured group and co-culture group. MTT test was used to evaluate the cell viability of PC12 cells and AnnexinV-FITC detecting kits were used to detect the apoptosis of PC12 cells. The expression level of Trx, Bcl-2 and Bax protein in PC12 cells were detected by Western Blot. ResultsBMSCs isolated from rat bone marrow were highly positive for CD29, CD44 and negative for CD31, and CD45. BMSC-CM increased cell viability of H2O2-injured PC12 cells, decreased Annexin-V/PI staining positive cells. The expressions of Trx and Bcl-2 protein were significantly increased, and the Bax protein level was decreased compared with the other two groups. ConclusionBMSC-CM could inhibit the oxidative stress and apoptosis in PC12 cells, which could be related to the up-regulation of Trx and Bcl-2 protein expression and decrease of the level of Bax protein.
【Key words】Bone marrow mesenchymal stem cells; Conditioned medium; Hydrogen peroxide; PC12 cells; Oxidative stress
基金项目:宜宾市科技计划项目经费资助(2014SF009)
通讯作者:付高勇,E-mail: 527121032@qq.com
【中图分类号】R 446.8
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.010
(收稿日期:2015-08-04; 编辑: 张文秀)
