异种移植模型中血小板源生长因子改善人卵巢组织移植物微循环重建研究*
2016-06-27张曜耀肖准李尚为汪燕康倍佳
张曜耀 肖准 李尚为 汪燕 康倍佳
(四川大学华西第二医院妇产科生殖医学中心, 四川 成都 610041)
·论著·
异种移植模型中血小板源生长因子改善人卵巢组织移植物微循环重建研究*
张曜耀肖准李尚为 汪燕康倍佳
(四川大学华西第二医院妇产科生殖医学中心, 四川 成都 610041)
【摘要】目的通过运用前期研究提出新型卵巢组织玻璃化冷冻方法,改善了卵巢组织间质和微血管存活状况,在前期研究基础上,对卵巢组织冷冻带来的间质损伤在冻融后进行体外培养修复,培养中通过添加血小板源生长因子(PDGF)改善移植后血管重建过程。方法对3例患者的卵巢组织皮质片进行深低温保存。将3例共24片卵巢组织片配对分为PDGF干预组和对照组,每组各12片组织,通过体外短期培养24小时并在培养期间在PDGF组添加100ng/μl的PDGF作为干预,观测培养前后卵巢组织体外生长趋势。将两组卵巢组织移植到SCID小鼠皮下,两周后将皮下组织取出,观测组织血管重建情况,比较各组微血管密度计数以及组织生长活性及凋亡情况。结果在异种移植模型中通过免疫组织化学法检测卵巢新生微血管提示,添加PDGF因子培养后的卵巢组织移植物新生微血管密度计数显著高于普通培养条件下的卵巢组织移植物。同时采用免疫荧光方法原位检测组织凋亡(TUNEL)情况表明添加PDGF因子培养后的卵巢组织移植物凋亡细胞比例与对照组相比显著降低。结论我们首次在卵巢组织体外培养过程中短期添加PDGF促进卵巢血管生成。在异种移植模型中,我们发现添加PDGF因子的移植物微循环重建情况显著改善,并且移植物凋亡情况与对照组显著降低。以上结果为优化卵巢组织体外培养以及移植物微循环重建效果提供了新思路。
【关键词】卵巢冷冻; 生育力保存;卵巢移植 ;微循环重建;PDGF
不孕不育是严重影响人们生活质量的疾病,其中很大比例为女性生育力的降低,如何维持、保存生育力是生殖医学面临的最大问题[1,2]。近年女性生育力保存问题备受学者关注。年轻的女性恶性肿瘤存活者。随着肿瘤治愈率的提高,其存活情况得以改善的同时,具有细胞毒性的抗肿瘤治疗常对卵巢造成不可逆的损伤,导致提前绝经和不孕[3-5]。此外,许多非肿瘤因素如免疫性疾病、染色体异常、盆腔感染、复发性卵巢良性囊肿,医源性因素等可造成卵巢功能受损甚至引起卵巢早衰[6-9]。卵巢组织冷冻不需要使用促排卵药物治疗,不延误恶性肿瘤患者的治疗时机,不受年龄和婚姻状况的限制,可能有望同时保存女性生育力和生殖内分泌功能。因此,相比较胚胎冷冻和卵子冷冻技术,卵巢组织冷冻更有优势和前景[10,11]。
卵巢间质对卵巢组织片体外培养或移植后卵泡的支持和营养以及微循环的建立具有重要作用。在间质完整性的前提下,血管新生过程还与一系列血管生成调节因子相关。血管生成过程包括:细胞外基质的重建;内皮细胞迁移和增殖;新生血管腔形成;周围细胞募集以稳定新生毛细血管以及最终的成熟血管形成。参与这一过程调控的因子呈网络状分布,其中正性调节因子主要为血管生成因子,包括血管内皮生长因子(VEGF)家族,成纤维细胞生长因子(FGF)家族和血管生成素,此外,还有其他通过上调 VEGF表达来促进血管生成的细胞因子如肝细胞生长因子(HGF),血小板源生长因子(PDGF),表皮生长因子(EGF),转化生长因子β(TGFβ)等以及基质金属蛋白酶(MMP)家族。其中,血小板源生长因子(PDGF) 是由多种细胞产生的重要多肽生长因子,可促进结缔组织细胞(如血管内皮细胞、平滑肌细胞)增殖等。近年来,体内外研究证实PDGF在肿瘤等组织中与血管生成作用密切相关。然而,PDGF是否能影响卵巢组织移植物的血管再生目前尚罕见报道。在本课题研究中,我们拟采用添加促进血管生成因子添加一些促进血管生成的细胞因子进行短期体外培养,以促进移植后卵巢组织新生血管生成,改善移植物微循环的及时建立和稳定性,通过形态学、凋亡检测、微血管计数等方法评价PDGF改善间质存活和促进微循环建立的效果,为优化和改进女性生育力保存体系提供研究思路,为恶性肿瘤存活者以及其他卵巢早衰易患人群的生育力保存和构建人类卵子库提供研究基础。
1材料与方法
1.1实验材料选取我院妇科手术病人卵巢组织,共收集标本3例,病人年龄范围为20~26岁,中位年龄23.7岁。均为子宫恶性肿瘤附件切除患者。收集送病理检查后剩余部分卵巢皮质组织,病检证实有癌细胞转移至卵巢者剔除。本研究涉及人体标本收集过程以及知情同意书经四川大学伦理委员会以及四川大学华西第二医院伦理委员会专家审核批准。
1.2实验方法
1.2.1标本收集将卵巢组织标本放入含10%FBS的L-15培养液中,放置于冰盒中在10分钟内转移至实验室,在无菌超净工作台内,更换新鲜培养液,在培养液中快速用眼科剪剔除卵巢组织髓质后,将厚约1mm的卵巢组织皮质块分割成面积约为2~3mm2大小的组织小块,每例患者标本随机等量分配到新鲜组及不同冷冻方法组。每例卵巢组织标本可分割为约10片组织小块,术后经病理学专家证实所取标本均无癌细胞卵巢转移。冷冻方法分为玻璃化冷冻(NIV法),其中每一例收集冻存的标本均留取少许组织固定,包埋,切片,染色进行形态学分析,进行了基本的解冻复苏后冷冻效果评价。
1.2.2NIV冷冻NIV冷冻法为本课题组首创的新型玻璃化冷冻方法,在该方法中,采用了一种特殊载体——超细针灸针。针灸针为我国传统医疗器械,它由针臂和针体两部分组成。本实验中采用直径为0.18 mm,长为20 mm 的针。具体操作:在标本收集液中将人卵巢组织片每3~4片穿于一根针体上,室温下用镊子钳夹针臂端放入平衡液 B:7.5%(v/v) DMSO+7.5% (v/v) EG 10分钟;再放入冷冻液 B:15% DMSO+15% EG+0.5 M sucrose 2分钟。组织经过脱水后,用消毒纱布轻轻吸去组织周围剩余的冷冻保护剂,以减少保护剂体积,再同时钳夹多根针臂快速浸入装有液氮的金属容器中,并在液氮中将针和组织装入充有液氮预冷的冷冻小管中,放入液氮罐中保存一周以上。
1.2.3玻璃化法冷冻(NIV法)的复苏从液氮中取出冷冻管,空气中晃动10秒,将玻璃化的组织小滴或超细针上的组织块由冷冻管里取出后,立即浸于37 ℃预热的1 M sucrose液中放置5 min,使组织表面的玻璃化液完全溶解。再将组织于室温下迅速移到0.5 M sucrose液中放置5 min, 接着在0.25 M sucrose液中5 min。最后, 解冻的卵巢组织在基础液中漂洗3 次, 一起放入37 ℃培养箱孵育15~20分钟, 进行下部分实验。
1.2.4卵巢组织体外培养 卵巢组织体外培养液以α-MEM 为基础液,添加 10% 人白蛋白, 1% ITS (10μg/ml 胰岛素, 5.5μg/ml 转铁蛋白和6.7ng/ml 亚硒酸钠), 0.3IU/ml 人卵泡刺激素 (Gonal-F), 50 μg/ml 维生素C, 0.47 mmol/L 丙酮酸, 2mmol/L L-谷氨酰胺 , 75 IU/ml 青霉素和 75 μg/ml链霉素。
体外培养法采用Scott提出的培养方法,将新鲜或冷冻复苏后各组的卵巢组织片切成约1 mm×1 mm×1 mm 大小,分组放入24孔培养皿中培养,每孔放4片组织块。培养皿底部预先用100μl 细胞外基质包埋,使组织块能更好在培养皿中生长。每孔中加入800 μl 新鲜培养液,培养皿放置在37℃培养箱中培养24小时。
1.2.5形态学分析(H&E染色)新鲜、冷冻复苏后或经过短期体外培养后的卵巢组织经常规脱水、二甲苯透明、石蜡包埋,按5μm连续切片,间隔10张进行苏木素-伊红染色,光学显微镜下观察始基卵泡的形态。为了避免重复计数,只有卵母细胞核深染的卵泡被计数在内。形态分析参照Gougeon提出的标准。
1.2.6免疫组织化学分析细织标本经常规处理、切片,脱蜡至水;微波抗原修复;体积分数 3 % H双氧水阻断内源性过氧化物酶; 一抗稀释,4度孵育过夜; 二抗室温孵育 30 min; DAB 显色.苏木素复染,二甲苯透明。已知阳性的组织作为阳性对照,以磷酸盐缓冲液代替一抗为阴性对照。微血管判定及 MVD 计数方法参照文献[12]: 每张切片先在低倍(100 倍)视野镜中选出血管最丰富的三个区域,然后在400 倍视野下由两位经验丰富的病理科医师同时计数微血管3次, 取其平均值。凡被CD34免疫组化染色染成棕色单个内皮细胞或内皮细胞簇的,均作为一个血管计数,管腔结构形成并不作为判定的必要条件,已形成明显肌层的血管不参与计数,由两位经验丰富的病理科医师来进行微血管判断。
1.2.7凋亡测定(TUNEL法检测)新鲜或冷冻复苏后的卵巢组织经常规脱水、二甲苯透明、石蜡包埋,按5μm连续切片,间隔10张进行TUNEL染色。按照Promega DeadEndTM Fluorometric Tunel system检测试剂盒说明书中步骤操作。
1.2.8异种移植至重度联合免疫缺陷(SCID)小鼠采用8周龄雄性SCID小鼠,经培养的人卵巢组织异种异体移植至SCID小鼠肾包膜下或皮下,观察移植短期(两周后)卵巢组织细胞存活和新生血管情况 微血管评价:免疫组织化学或免疫荧光化学法检测卵巢新生微血管。分析组织细胞凋亡情况:采用免疫组化和免疫荧光方法原位检测组织CD31及表达,凋亡(TUNNEL),并检测凋亡相关因子。
1.3统计学方法采用chi-square 检验分析干预组和对照组移植后TUNEL阳性细胞百分率;采用方差分析比较干预组和对照组移植后微血管密度。其中P<0.05 被认为具有统计学意义,统计学软件为SPSS 15.0。
2结果
将3例解冻卵巢组织(每例患者各8片组织,共24片组织)分为PDGF干预组与对照组(各12片),添加干预组在常规培养液中添加了100ng/ml的PDGF,空白对照组按照常规培养,在体外培养 24小时后, 光镜下观察组织块形状干预组与空白对照组相比,组织块向间质向外生长程度较好。在8周龄雌性SCID小鼠,分别将添加PDGF因子的干预组及未添加干预因子的空白对照组的人卵巢组织片各12片异体移植至SCID小鼠腹部皮下(每只小鼠腹部皮下移植2片,共移植12只老鼠。两周后将组织片取出通过HE切片在光镜下观察移植卵巢组织形态学显示卵巢组织存活良好(图1)。对比PDGF干预组以及对照组的卵泡计数统计结果表明,PDGF干预组的卵巢组织中形态正常卵泡数目显著高于对照组(P<0.05)。进一步通过免疫组织化学进行卵巢组织CD31染色检测卵巢新生微血管情况(图2),结果表明添加PDGF因子培养后的卵巢组织移植物微血管密度显著高于普通培养条件下的卵巢组织移植物(P<0.05)。

图1PDGF组和对照组卵巢组织HE切片图
Fig.1HE stain of ovarian fissue
注:(A) 添加PDGF干预组移植后两周卵巢组织片HE染色情况,卵泡形态正常,结构紧密,与新鲜对照组相比间质较为疏松。(B) 对照新鲜卵巢组织片HE染色情况,卵泡形态正常,间质形态大致正常,间质较为疏松。(放大倍数400倍)。
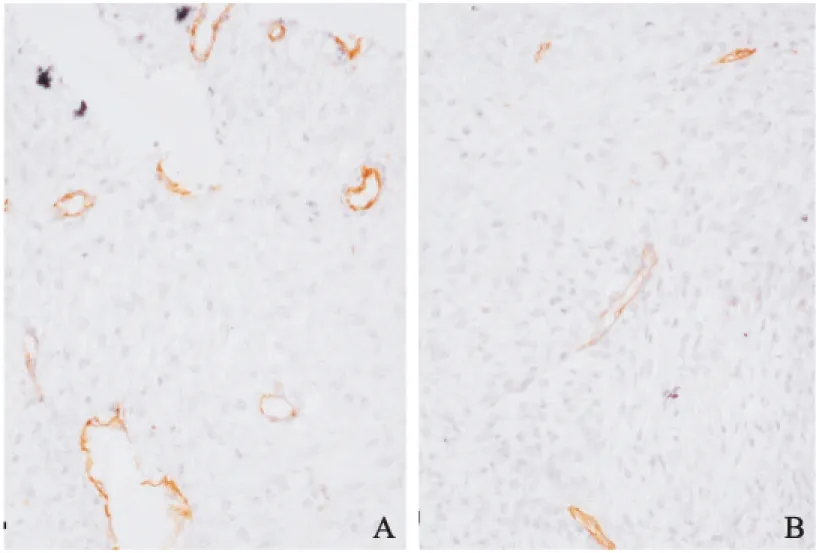
图2各组卵巢组织片免疫组化图(CD31染色)
Fig.2Immunochistochemistry of Ovarian tissue
(A) 添加PDGF组移植后两周卵巢组织片免疫组化染色CD31表达情况,CD31阳性表达的微血管密度较高。(B) 对照新鲜卵巢组织片免疫组化染色CD31表达情况,CD31阳性表达的微血管密度较低(放大倍数400倍)。
采用免疫荧光方法原位检测组织凋亡(TUNEL)情况表明添加PDGF因子培养后的卵巢组织移植物凋亡细胞比例与对照组相比显著降低(P<0.05),见图3。
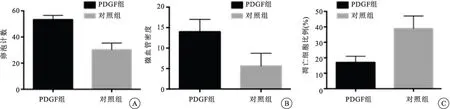
图3PDGF组与对照组卵巢组织移植物的卵泡计数,微血管密度及凋亡比例
Fig.3Ovariantollicale, density of blood lessed and apoptosis
注:(A) 添加PDGF组移植后两周卵巢组织片卵泡计数,PDGF干预组的卵巢组织中形态正常卵泡数目显著高于对照组(P<0.05)。(B) 添加PDGF组移植后两周卵巢组织片微血管密度,添加PDGF因子培养后的卵巢组织移植物微血管密度显著高于普通培养条件下的卵巢组织移植物(P<0.05)。(C) 添加PDGF组移植后两周卵巢组织中卵泡凋亡比例,添加PDGF因子培养后的卵巢组织移植物凋亡细胞比例与对照组相比显著降低(P<0.05)。
3讨论
恶性肿瘤是目前严重威胁人类生命的疾病,随着医疗技术水平的进步,早期诊断和及时有效的治疗,使恶性肿瘤患者的存活率得到极大改善。但大剂量放化疗治疗疾病的同时,也严重损害患者的性腺功能,肿瘤治愈后患者的生活质量越来越引起人们关注。在治愈疾病的同时应注重患者心理以及社会角色的恢复,对生殖健康的维护和生育能力的保存是生殖医学、肿瘤学科,妇产学科等多学科共同探讨的问题[2,13-15]。
随着早期诊断和先进治疗手段的发展,年轻的癌症患者存活率大大增加。然而,细胞毒性的电离辐射和化疗药物可损害卵巢,常导致卵巢早衰造成内分泌及生殖功能损伤。为了改善这种困境,女性生育能力的保存是目前生殖医学领域的研究的热点,包括卵母细胞,胚胎和卵巢组织保存。其中,卵巢组织保存具有其独特的优越性,因为它避免了超促排卵的潜在药物副作用与时间的消耗。此外,卵巢组织保存保存不仅适用于育龄妇女,对于青春期前的女孩而言卵巢组织冷冻是目前唯一的生育力体外保存方法[16]。
冻融后卵巢组织内分泌功能的长期恢复一直是该领域研究的难点问题,冻融后卵巢组织卵泡发育和微循环重建可能与卵巢间质存活状态有着千丝万缕的关系。在卵泡发育过程中,卵巢间质具有支持、营养、促细胞增殖、迁移和稳定局部微环境的作用,部分细胞外基质可以结合生长因子,参与调控卵泡发育和血管新生过程。研究提示:冻融卵巢组织片移植后的 48小时内,由于早期的移植物缺血,新生血管尚未建立,缺血期和再灌注期低氧环境产生的氧代谢产物引起卵泡大量丢失。有学者回溯总结了卵巢移植的一些研究指出:冷冻后卵巢组织移植卵巢功能的恢复和维持不如新鲜卵巢组织移植。因此选择合适的冷冻方案,合理的添加细胞外基质成分和抗氧化成分,在尽可能完好保存卵巢卵泡和间质的前提基础上,建立卵巢移植模型,在移植前筛选增加干预因子降低缺血缺氧损伤,促进血管生长,维持微血管的功能,是卵巢组织冷冻保存和复苏后重建卵巢功能的重要步骤。
卵巢组织成功的冷冻保存后,通过复苏后卵巢移植完全恢复卵巢功能是一个理想状态,但移植后卵巢功能重建仍是一技术难题。结合卵巢组织移植后的缺血损伤和新生血管的建立一直是卵巢冷冻移植的重点和难点问题,本课题提出玻璃化冷冻在保存卵巢间质细胞和血管基质成分具有优势,一方面在冷冻技术上使多细胞尽可能完整保存,以利于组织微循环的再建,另一方面探讨添加干预措施降低组织缺血和氧化应激损伤。本研究旨在改善冻融卵巢的生殖和内分泌功能恢复,通过短期培养过程中添加PDGF促进新生血管建立来改善卵巢移植后功能重建。异种移植模型中观察到PDGF干预后卵巢组织微血管密度情况显著增加。
由于形态学及超微结构分析在卵巢组织发育潜能评价中的局限性,我们通过对凋亡指标的分析比较不同冷冻方法在保存卵巢发育潜能方面的效果。细胞凋亡指细胞在一定的生理或病理条件下发生程序化死亡,细胞最后裂解成若干凋亡小体并被其他细胞所吞噬。各种环境刺激,包括温度、创伤等均可诱导细胞凋亡的发生。在卵巢组织中,卵泡闭锁、排卵、黄素化等过程都观察到凋亡现象的发生,因此凋亡同人卵巢组织正常发育及其功能有密切关系。凋亡同形态学指标相比,在评判卵巢组织冷冻损伤方面更为敏感;同时凋亡的发生率可能反应了卵巢组织冻融后的发育潜能,因而是更有价值的反应卵巢功能的指标。通过TUNEL实验中凋亡发生率的分析,我们发现PDGF干预组冻融卵巢组织经过短期培养与移植后凋亡比率显著低于对照组,提示PDGF的添加可能通过改善卵巢组织微循环重建进而经过降低了卵巢组织的凋亡率。以上结果为优化卵巢组织体外培养以及移植物微循环重建效果提供了新思路,为临床保存女性生育能力,建立人类卵巢组织库提供了研究基础。
4结论
我们首次在卵巢组织体外培养过程中短期添加PDGF促进卵巢血管生成。在异种移植模型中,我们发现添加PDGF因子的移植物微循环重建情况显著改善,并且PDGF组移植物凋亡情况与对照组相比并凋亡显著降低。以上结果为优化卵巢组织体外培养以及移植物微循环重建效果提供了新思路。
【参考文献】
[1]The Practice Committee of the American Society for Reproductive M. Ovarian tissue cryopreservation: a committee opinion[J]. Fertil Steril, 2014,35(3):431-435.
[2]Herraiz S, Novella-Maestre E, Rodriguez B,etal. Improving ovarian tissue cryopreservation for oncologic patients: slow freezing versus vitrification, effect of different procedures and devices[J]. Fertil Steril, 2014, 101(3): 775-784.
[3]Lunardi F O, Araujo V R, Bernuci M P,etal. Restoring fertility after ovarian tissue cryopreservation: a half century of research[J]. Zygote, 2013, 21(4): 394-405.
[4]Babayev S N, Arslan E, Kogan S,etal. Evaluation of ovarian and testicular tissue cryopreservation in children undergoing gonadotoxic therapies[J]. J Assist Reprod Genet, 2013, 30(1): 3-9.
[5]Zakova J, Sedlackova M, Polak S,etal. Methods for preserving fertility in young women suffering from cancer: some aspects of ovarian tissue cryopreservation[J]. Bratisl Lek Listy, 2012, 113(3): 192-194.
[6]Huser M, Zakova J, Crha I,etal. [Ovarian tissue cryopreservation in cancer patients--six years of clinical experience][J]. Ceska Gynekol, 2012, 77(2): 118-126.
[7]Gracia C R, Chang J, Kondapalli L,etal. Ovarian tissue cryopreservation for fertility preservation in cancer patients: successful establishment and feasibility of a multidisciplinary collaboration[J]. J Assist Reprod Genet, 2012, 29(6): 495-502.
[8]Fabbri R, Vicenti R, Magnani V,etal. Cryopreservation of ovarian tissue in breast cancer patients: 10 years of experience[J]. Future Oncol, 2012, 8(12): 1613-1619.
[9]Fabbri R, Vicenti R, Macciocca M,etal. Cryopreservation of ovarian tissue in pediatric patients[J]. Obstet Gynecol Int, 2012, 20(10): 1069-1072.
[10] Rodriguez-Wallberg K A, Oktay K. Recent advances in oocyte and ovarian tissue cryopreservation and transplantation[J]. Best Pract Res Clin Obstet Gynaecol, 2012, 26(3): 391-405.
[11] Isachenko V, Isachenko E, Mallmann P,etal. Long-time cooling of human ovarian tissue before cryopreservation as obvious procedure: stimulation of follicular development and neo-vascularisation[J]. Clin Lab, 2012, 58(11-12): 1293-1300.
[12] Perez-Atayde A R, Sallan S E, Tedrow U,etal. Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia[J]. Am J Pathol, 1997, 150(3): 815-821.
[13] Isachenko E, Isachenko V, Mallmann P,etal. Transplantation of cryopreserved human ovarian tissue: restoration of reproductive function after two cycles of radio- and chemo-therapeutic treatments[J]. Clin Lab, 2014, 60(2): 245-252.
[14] Vanacker J, Luyckx V, Amorim C,etal. Should we isolate human preantral follicles before or after cryopreservation of ovarian tissue?[J]. Fertil Steril, 2013, 99(5): 1363-1368 e2.
[15] Talevi R, Barbato V, Mollo V,etal. Replacement of sodium with choline in slow-cooling media improves human ovarian tissue cryopreservation[J]. Reprod Biomed Online, 2013, 27(4): 381-389.
[16] Luyckx V, Durant J F, Camboni A,etal. Is transplantation of cryopreserved ovarian tissue from patients with advanced-stage breast cancer safe? A pilot study[J]. J Assist Reprod Genet, 2013, 30(10): 1289-1299.
The study of PDGF on reconstruction of microcirculation in transplanted frozen-thawed ovarian tissue in SCID mice
ZHANG Yaoyao,XIAO Zhun,WANG Yan,et al
(CenterofReproductiveMedicine,DepartmentofObstetricsandGynecology,WestChinaSecondUniversityHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveThe problems of the tissue injury and the reconstruction of microcirculation in frozen-thawed ovarian tissue after transplantation are still unsolved. This research aimed at improving the reconstruction of microcirculation in frozen-thawed ovarian tissue after transplantation. MethodsDuring the in vitro culture,PDGF was selected to regulate the angiogenesis and restore the injury of stroma in the short-term culture system before ovarian tissue transplantation, to reduce the hypoxia-ischemia and apoptosis, to promote the angiogenesis and maintain the vascular stability in ovary grafts. ResultsAfter short term culture, the ovarian tissues were transplanted into the SCID mice. After the addition of PDGF during in vitro culture, microvessel density count of ovarian tissue transplantation was significantly higher than control group.At the same time in situ immunofluorescence to detect the apoptosis situation (TUNEL) showed that in the group with addition of PDGF, the proportion of apoptotic cells was statistically significant lower compared with control group.ConclusionIn a xenograft model, we found that after addition of PDGF reconstruction of microcirculation ovarian graft is improved significantly, and the apoptosis of graft was significantly reduced. This study provided the research clue to optimize and improve the female fertility preservation system.
【Key words】Ovarian vitrification; Fertility preservation; Ovarian transptransplantation; Reconstruction of microcirculation; PDGF
基金项目:国家自然科学基金面上项目(C120205)
通讯作者:李尚为,教授,博士生导师,本刊编委,E-mail:lswivf01@sina.com
【中图分类号】R 329.3
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.004
(收稿日期:2016-02-01; 编辑: 张文秀)
