低氧状态下芹黄素通过抑制HIF-1α下调卵巢癌SKOV3细胞GluT-1表达的实验研究*
2016-06-27邓洁张小霞邓晓杨彭聪罗剑波朱涛
邓洁 张小霞 邓晓杨 彭聪 罗剑波 朱涛
(1.成都医学院第一附属医院妇科, 四川 成都 610000;2.四川大学华西医院呼吸病学研究室/呼吸内科,四川 成都 610041
·论著·
低氧状态下芹黄素通过抑制HIF-1α下调卵巢癌SKOV3细胞GluT-1表达的实验研究*
邓洁1张小霞1邓晓杨1彭聪1罗剑波1朱涛2
(1.成都医学院第一附属医院妇科, 四川 成都 610000;2.四川大学华西医院呼吸病学研究室/呼吸内科,四川 成都 610041
【摘要】目的研究在低氧状态下芹黄素能否通过抑制HIF-1α下调卵巢癌SKOV3细胞GluT-1表达。方法将卵巢癌SKOV3细胞分为常氧组、低氧组和低氧+芹黄素组。在低氧状态下对卵巢癌SKOV3细胞使用终浓度为50 μM的芹黄素进行干预,在不同时间点(0h、24h和72 h)使用MTT法对SKOV3细胞活性进行检测;同时在干预24h后,分别使用qPCR法和western blot法对卵巢癌SKOV3细胞GluT-1和HIF-1α mRNA和蛋白表达水平进行检测。结果 低氧环境下SKOV3细胞活性呈时间依赖性下降,差异均有显著统计学意义(P均<0.05);且在各时间点低氧+芹黄素组活性较低氧组下降更加明显,差异均有显著统计学意义(P均<0.05)。同时,在干预24h后卵巢癌SKOV3细胞GluT-1和HIF-1α mRNA和蛋白的表达水平较非干预组细胞明显降低,差异均有显著统计学意义(P均<0.05)。结论 在低氧状态下,芹黄素可以通过抑制HIF-1α的合成下调卵巢癌SKOV3细胞GluT-1的表达,从而抑制肿瘤细胞的增殖。该基础研究为芹黄素应用于卵巢癌等恶性肿瘤的治疗奠定了一定的理论基础。
【关键词】芹黄素;卵巢癌;SKOV3细胞;葡萄糖转运蛋白-1;缺氧诱导因子-1α
卵巢癌(ovarian cancer)是人类女性最常见的妇科肿瘤之一,由于卵巢组织结构来源多样,造成卵巢癌病理类型具有复杂的生物学特点。同时,调查显示卵巢癌细胞恶性程度普遍较高,据美国癌症协会(American Cancer Society, ACS)统计显示美国卵巢癌患者5年生存率仅有44%[1-4]。缺氧诱导因子-1α (Hypoxia-inducible factor-1α, HIF-1α)是一种在低氧状态下诱导表达的核转录因子[5,6]。研究发现HIF-1α对于肺癌、肝癌、乳腺癌和卵巢癌等大多数肿瘤的增殖、转移和血管生成等均有重要的调控作用[5,6]。抑制和下调HIF-1α可有效抑制肺癌和卵巢癌等肿瘤的生长和分化[5-9]。芹黄素(apigenin)作为一种常见的植物黄酮类化合物,广泛存在于多种水果和茶叶中。目前多个研究显示芹黄素具有抗炎症反应和抗肿瘤等药理活性,并认为其药理作用与下调HIF-1α表达密切相关[10-12]。本研究目的是旨在探讨低氧状态下芹黄素对卵巢癌SKOV3细胞的抑制作用及潜在的分子机制。
1材料和方法
1.1主要试剂和材料PCR试剂盒购自宝生物工程有限公司;Heracell 150i细胞培养箱购买于美国Thermo Scientific公司;鼠抗人GluT-1抗体、鼠抗人HIF-1α抗体和鼠抗人β-actin抗体购于美国Cell signaling公司;芹黄素购买于美国Sigma公司;DMEM培养基购买于美国Gibco公司;MTT试剂盒购买于美国Promega公司;其余试剂均为市售分析纯。
1.2细胞培养卵巢癌SKOV3细胞常规接种在含10%FBS、100 g/L青霉素、100 g/L链霉素的DMEM培养液中,置于37℃、95%空气、5% CO2孵箱内培养。每48 h换液、传代1次,取对数生长期细胞用于实验。卵巢癌SKOV3细胞分为常氧组(Normoxia组)、低氧组(Hypoxia组)和低氧+芹黄素组(Hypoxia+Apigenin组)。其中常氧组和低氧组细胞加入PBS,低氧+芹黄素组加入溶于0.5% DMSO终浓度为50 μM的芹黄素,而后将低氧组和低氧+芹黄素组细胞移置于低氧环境(1% O2、5% CO2和94% N2)进行培养。
1.3卵巢癌SKOV3细胞活性检测取对数生长期卵巢癌SKOV3细胞消化制成单细胞悬液,接种于96 孔培养板中,每孔接种100 μL约含5×103个细胞。使用MTT比色试验对芹黄素干预后不同时间点(0h、24h和72 h)的细胞生长状态进行测定,实验重复5次。细胞活性(%) = (OD样本/OD 常氧组0h) × 100 (%)[13]。
1.4qPCR检测卵巢癌SKOV3细胞Glut-1和HIF-1α mRNA表达检测干预24h后,按照qPCR试剂盒说明书提取细胞总RNA。引物:Glut-1正义5′-CCGCAACGAGGAGAACCG-3′,反义5′- GTGACCTTCTTCTCCCGCATC-3′;HIF-1α正义 5′-CTGCCA CCACTG ATGAATTA-3′,反义5′-GTATGT GGGTAGGA GATGGA-3′;β-actin正义:5′- CTCCAT CCTG GCCT CGCTGT-3′,反义:5′-GCTGT CACCTT CACC GTTCC-3′。使用β-actin作为内参基因,使用2-ΔΔCT公式计算目的基因相对表达量。ΔΔCt = (Ct,目标-Ct,β-actin)干预组-(Ct,目标-Ct,β-actin)对照组。
1.5Western blot法检测卵巢癌SKOV3细胞中Glut-1和HIF-1α蛋白表达干预24h后,按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1 h,分别加入鼠抗人单克隆抗体Glut-1 (1∶1000)、HIF-1α (1∶1000)和β-actin (1∶1200),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.6统计学方法计量资料以均数±标准差表示。采用SPSS 17.0进行单因素方差分析,两样本均数多重比较采用LSD法,P<0.05为差异有统计学意义。
2结果
2.1SKOV3细胞活性测定低氧状态下,卵巢癌SKOV3细胞活性随时间延长而逐渐下降,差异均有显著统计学意义(P均<0.05)。且对应时间点与低氧组相比较,低氧+芹黄素组细胞活性下降更加显著,差异均有显著统计学意义(P均<0.05),见表1。
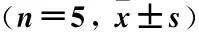
Table 1Cell viability of HCT116 cells in different time points (0 h, 24h, and 72h)

干预时间 0h24h72h常氧组111低氧组100.4±2.688.2±8.4①71.2±10.3①低氧+芹黄素组102.3±3.152.6±15.3①②33.6±11.4①②
注:①与对应时间点常氧组相比较P<0.05;②与对应时间点低氧组相比较P<0.05。
2.2SKOV3细胞GluT-1 mRNA和蛋白的表达在干预24h后,低氧状态下卵巢癌SKOV3细胞GluT-1 mRNA和蛋白的表达较常氧状态下明显增加,差异有显著统计学意义(P均<0.05);与低氧组比较,低氧+芹黄素组细胞GluT-1 mRNA和蛋白表达水平较低,差异有显著统计学意义(P均<0.05),见表2和图1。
2.3SKOV3细胞HIF-1α mRNA和蛋白的表达 在干预24h后,低氧状态下卵巢癌SKOV3细胞HIF-1α mRNA和蛋白的表达较常氧状态下明显增加,差异有显著统计学意义(P均<0.05);与低氧组比较,低氧+芹黄素组细胞HIF-1α mRNA和蛋白表达较低,差异有显著统计学意义(P均<0.05),见表2和图2。

表2 卵巢癌SKOV3细胞Glut-1和HIF-1α mRNA和蛋白表达水平
注:①与常氧组相比较P<0.05;②与低氧组相比较P<0.05。
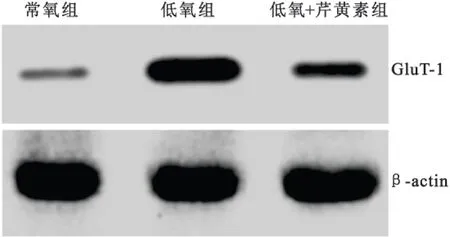
图1卵巢癌SKOV3细胞GluT-1蛋白表达的western blot结果
Figure 1The western blot result of the protein expression of GluT-1 in SKOV3 cells
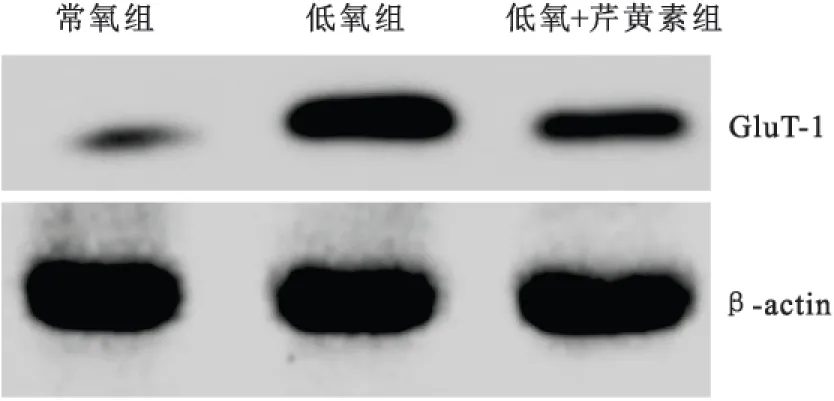
图2卵巢癌SKOV3细胞HIF-1α蛋白表达的western blot结果
Figure 2The western blot result of the protein expression of HIF-1α in SKOV3 cells
3讨论
流行病学调查卵巢癌(ovarian cancer)是人类女性生殖系统仅次于宫颈癌的恶性肿瘤。由于卵巢组织胚胎分化来源较为丰富,故导致卵巢成为机体肿瘤病理类型最丰富的组织器官[1-4]。研究数据显示2012年全球卵巢癌新发病人数约为23.9万,死亡人数约为14万[1-4]。同时,由于卵巢组织位置处于腹腔深处,卵巢癌患者一般诊断时多处于Ⅲ~Ⅳ期,故预后相对较差。据美国癌症协会(American Cancer Society, ACS)统计显示美国卵巢癌患者5年生存率仅有44%左右,而全球卵巢癌患者5年生存率仅有30%左右[1-4]。寻求新的卵巢癌治疗方法和途径具有重要的临床价值和意义。
由于肿瘤组织失去细胞生长抑制和增殖的无序性,使实体肿瘤组织内部长期处于低氧状态。研究发现肿瘤组织内部的低氧与肿瘤细胞的增殖、分化、浸润、转移和血管生成等恶性行为密切相关[5-9]。进一步的研究显示缺氧诱导因子-1α (Hypoxia-inducible factor-1α, HIF-1α)在该过程中扮演着重要的角色[5-9]。一般情况下低氧状态可以诱导肿瘤细胞HIF-1α的表达增加,并进一步上调包括VEGF、NDRG1和GluT-1等下游分子的合成和表达[7, 14-17]。其中GluT-1是细胞糖代谢的重要分子,GluT-1在肿瘤细胞的增殖和分化中扮演着重要的角色[16, 17]。大量的研究表明抑制和阻断HIF-1α相关的信号通路可以有效的抑制包括肺癌A549细胞、乳腺癌MDA-MB-231细胞以及卵巢癌SKOV3和A2780细胞在内的多种肿瘤细胞的增殖、转移和浸润等恶性行为[7, 8, 14-17]。如Wei D等的研究显示低氧状态下地高辛可以通过抑制HIF-1α下调肺腺癌A549细胞VEGF和NDRG1表达,并有效抑制A549细胞的增殖和分化[7]。Ataie-Kachoie P等的研究发现在低氧状态下米诺环素(minocycline)可以通过下调卵巢癌SKOV3和A2780细胞HIF-1α的表达抑制AKT/mTOR信号通路,并抑制肿瘤的增殖和侵袭[8]。
芹黄素(apigenin)作为一种常见的植物黄酮类化合物,伞形科植物旱芹叶中含量较为丰富,此外还广泛存在于多种水果和茶叶以及水蔓青、虎杖和毛叶藜芦等中草药中。目前大量研究发现芹黄素具有显著的抗炎症反应、抗氧化应激、抗器官纤维化及抑制肿瘤增殖、分化和肿瘤血管生成等多种生物学活性[10-12, 18-21]。进一步研究发现芹黄素的多种生物学活性与调控HIF-1α相关的信号通路密切相关[10-12, 18-21]。Fang J等研究发现在低氧状态下芹黄素可以通过抑制HIF-1α下调人前列腺癌PC3和DU145细胞以及结肠癌HCT-8细胞VEGF的表达,以及小鼠移植瘤的血管生成[10]。Tong X等的研究证实在皮肤组织中芹黄素可以有效的抑制和改善紫外线(UVB)诱导的致癌作用(carcinogenesis),并认为该作用与下调HIF-1α信号通路密切相关[11]。Melstrom LG等的研究显示在低氧状态下芹黄素可以通过有效抑制胰腺癌细胞HIF-1α的合成下调GluT-1和VEGF的表达[12]。在本研究中我们发现低氧环境下SKOV3细胞活性呈时间依赖性下降,差异均有显著统计学意义(P均<0.05);且在各时间点低氧+芹黄素组活性较低氧组下降更加明显,差异均有显著统计学意义(P均<0.05)。该结果表明在低氧状态下芹黄素对卵巢癌SKOV3细胞有显著的抑制作用。进一步研究发现在干预24h后卵巢癌SKOV3细胞GluT-1和HIF-1α mRNA和蛋白的表达水平较非干预组细胞明显降低,差异均有显著统计学意义(P均<0.05)。该结果表明芹黄素对于低氧状态诱导的HIF-1α和GluT-1表达有抑制作用。
4结论
在低氧状态下,芹黄素可能可以通过抑制HIF-1α的合成下调卵巢癌SKOV3细胞GluT-1的表达,从而抑制肿瘤细胞的增殖。该基础研究为芹黄素应用于卵巢癌等恶性肿瘤的治疗奠定了一定的理论基础。
【参考文献】
[1]岳军, 胡丽娜. 卵巢癌中雌孕激素受体VEGF蛋白的表达与相关性探讨[J]. 西部医学, 2006, 18(3): 261-263.
[2]Jayson GC, Kohn EC, Kitchener HC,etal. Ovarian cancer. Lancet, 2014,38(4):1376-1388.
[3]梁江红. CXCL12/CXCR-4对卵巢癌高低转移细胞的作用机制探讨[J]. 西部医学, 2012, 24(5): 845-847.
[4]Baldwin LA, Huang B, Miller RW,etal. Ten-year relative survival for epithelial ovarian cancer [J]. Obstetrics and gynecology, 2012, 120:612-618.
[5]秦姣. 缺氧诱导因子-1α与肿瘤关系的研究进展[J]. 西部医学, 2010, 22(7): 1323-1325.
[6]张静. HIF-1α的表达与宫颈癌的关系探讨[J]. 西部医学, 2013, 25(3): 341-342, 345.
[7]Wei D, Peng JJ, Gao H,etal. Digoxin downregulates NDRG1 and VEGF through the inhibition of HIF-1α under hypoxic conditions in human lung adenocarcinoma A549 cells [J]. Int J Mol Sci, 2013, 14(4):7273-7285.
[8]Ataie-Kachoie P, Pourgholami MH, Bahrami-B F,etal. Minocycline attenuates hypoxia-inducible factor-1α expression correlated with modulation of p53 and AKT/mTOR/p70S6K/4E-BP1 pathway in ovarian cancer: in vitro and in vivo studies [J]. Am J Cancer Res, 2015, 5(2): 575-588.
[9]Chen L, Liu T, Zhang S,etal. Succinate dehydrogenase subunit B inhibits the AMPK-HIF-1α pathway in human ovarian cancer in vitro [J]. J Ovarian Res, 2014, 7(1):115.
[10] Fang J, Zhou Q, Liu LZ,etal. Apigenin inhibits tumor angiogenesis through decreasing HIF-1alpha and VEGF expression [J]. Carcinogenesis, 2007, 28(4):858-864.
[11] Tong X, Mirzoeva S, Veliceasa D,etal. Chemopreventive apigenin controls UVB-induced cutaneous proliferation and angiogenesis through HuR and thrombospondin-1 [J]. Oncotarget, 2014, 5(22): 11413-11427.
[12] Melstrom LG, Salabat MR, Ding XZ,etal. Apigenin down-regulates the hypoxia response genes: HIF-1α, GLUT-1, and VEGF in human pancreatic cancer cells [J]. J Surg Res, 2011, 167(2):173-181.
[13] 尹鹏, 胡君, 储著凌, 等. 替米沙坦通过上调 PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J]. 西部医学, 2014, 26(2): 160-162.
[14] Chen T, Ren Z, Ye LC,etal. Factor inhibiting HIF1α (FIH-1) functions as a tumor suppressor in human colorectal cancer by repressing HIF1α pathway [J]. Cancer Biol Ther, 2015, 16(2):244-252.
[15] Eskandani M, Abdolalizadeh J, Hamishehkar H,etal. Galbanic acid inhibits HIF-1α expression via EGFR/HIF-1α pathway in cancer cells [J]. Fitoterapia, 2015, 10(1):1-11.
[16] Campbell EJ, Vissers MC, Bozonet S,etal. Restoring physiological levels of ascorbate slows tumor growth and moderates HIF-1 pathway activity in Gulo(-/-) mice [J]. Cancer Med, 2015, 4(2):303-314.
[17] Wang E, Zhang C, Polavaram N,etal. The role of factor inhibiting HIF (FIH-1) in inhibiting HIF-1 transcriptional activity in glioblastoma multiforme [J]. PLoS One, 2014, 9(1):e86102.
[18] Mirzoeva S, Kim ND, Chiu K,etal. Inhibition of HIF-1 alpha and VEGF expression by the chemopreventive bioflavonoid apigenin is accompanied by Akt inhibition in human prostate carcinoma PC3-M cells [J]. Mol Carcinog, 2008, 47(9):686-700.
[19] Liu LZ, Fang J, Zhou Q,etal. Apigenin inhibits expression of vascular endothelial growth factor and angiogenesis in human lung cancer cells: implication of chemoprevention of lung cancer [J]. Mol Pharmacol, 2005, 68(3):635-643.
[20] Fang J, Xia C, Cao Z,etal. Apigenin inhibits VEGF and HIF-1 expression via PI3K/AKT/p70S6K1 and HDM2/p53 pathways [J]. FASEB J, 2005, 19(3): 342-353.
[21] Osada M, Imaoka S, Funae Y. Apigenin suppresses the expression of VEGF, an important factor for angiogenesis, in endothelial cells via degradation of HIF-1alpha protein [J]. FEBS Lett, 2004, 575(1-3):59-63.
Apigenin reduces GluT-1 expression via down-regulation of HIF-1α under hypoxic conditions in ovarian cancer SKOV3 cells
DENG Jie1, ZHANG Xiaoxia1, DENG Xiaoyang1, et al
(1.DepartmentofGynecology,TheFirstAffiliatedHospitalofChengduMedicalCollage,Chengdu610000,China; 2.DivisionofPulmonaryDiseases,StateKeyLaboratoryofBiotherapyofChina,DepartmentofRespiratoryMedicine,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo explore the value of apigenin on glucose transporter-1 (Glut-1) expression in ovarian cancer SKOV3 cells in hypoxia, and its underlying molecular mechanism. MethodsOvarian cancer SKOV3 cells were divided into 3 groups, including Normoxia group, Hypoxia group and Hypoxia+Apigenin group. At specified time points (0, 24 and 72 h), cell viabilities were analyzed by MTT assay. After 24 hours interventions, Glut-1 and HIF-1α mRNA expression were detected by qPCR, and, Glut-1 and HIF-1α protein expression were measured by Western blot. Results The proliferation of ovarian cancer SKOV3 cells under hypoxic conditions was time-dependently inhibited by apigenin. Our data demonstrated that hypoxia noticeably enhanced the mRNA and protein expression of GluT-1 and HIF-1α in SKOV3 cells. Meanwhile, the hypoxia-enhanced GluT-1 and HIF-1α were significantly suppressed by apigenin. Conclusion Apigenin could suppress GluT-1 expression possibly through inhibition of HIF-1α in ovarian cancer SKOV3 cells in hypoxia.
【Key words】Apigenin; Ovarian cancer; SKOV3 cells; Glucose transporter-1; Hypoxia-inducible factor-1α
基金项目:四川省医学会科研课题(171140342);中国博士后科学基金(2014M552369)
通讯作者:邓晓杨,E-mail:dengxiaoyang2014@sina.com
【中图分类号】R 965.2
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.005
(收稿日期:2015-05-25; 编辑: 张文秀)
