Angiogenin参与冻融人卵巢组织微循环重建效果分析*
2016-06-27张龙康倍佳汪燕李尚为
张龙 康倍佳 汪燕 李尚为
(四川大学华西第二医院生殖中心, 四川 成都 610041)
·论著·
Angiogenin参与冻融人卵巢组织微循环重建效果分析*
张龙康倍佳汪燕李尚为
(四川大学华西第二医院生殖中心, 四川 成都 610041)
【摘要】目的用新型玻璃化冷冻方法冻融人卵巢组织,在体外培养该组织时添加angiogenin,观察其对微血管生成的影响,并将培养后的组织进行异种移植,观察两周后移植物的血循环情况。 方法收集人卵巢组织并用NIV法进行冻融,通过免疫组化染色比较冻融前后组织中angiogenin的表达情况,将冻融的卵巢组织放在angiogenin浓度分别为0,100,200及400ng/ml的培养液中培养7天,取出组织进行CD34免疫组化染色,计数并比较不同angiogenin浓度组卵巢组织微血管密度差异,确定较适宜的培养浓度后,在适宜浓度下培养冻融人卵巢组织0,2,5,7天,观察不同培养时间组卵巢组织的微循环重建效果,将体外培养后的卵巢组织移植到SCID小鼠皮下,一周后取出移植物,观察微血管密度变化及细胞凋亡情况。 结果冻融后卵巢组织间质中的angiogenin表达量下降,卵巢组织在angiogenin浓度为200ng/ml的培养液中生长的卵巢组织微血管密度最高。添加angiogenin后培养5天的卵巢组织微血管密度较培养2天及培养7天组高。 卵巢组织短期培养后移植至SCID小鼠皮下一周,与对照组比较,添加angiogenin 200ng/ml培养后的卵巢移植物微血管密度增高,间质细胞凋亡减少。结论angiogenin可促进冻融人卵巢组织微循环重建,可为女性的生育能力保存提供有力的支持。
【关键词】Angiogenin;玻璃化冷冻;人类;卵巢组织;微循环重建;生育能力保存
卵巢是女性重要的内分泌器官和生殖器官,其功能状态直接影响着女性的生活质量和生育能力。恶性疾病的化疗及卵巢良性疾病等因素均可造成卵巢功能受损,甚至丧失生育能力[1]。因此,如何有效地保存女性的生育潜能是目前生殖领域所面临的重大问题。女性生育力保存可通过冻存卵子,胚胎以及卵巢组织完成。冻存卵子及胚胎均需要行促排卵治疗,但此方式在多种疾病的治疗过程中是不能完成的。此外,胚胎冷冻还受限于女性有无伴侣的条件。所以,卵巢组织冷冻对女性生育力的保存具有重要的作用。目前,在全球范围内已有通过冻融卵巢组织移植获得妊娠的报道[2]。
卵巢组织冻融意在通过此方式获得可供利用的各级卵母细胞,但是卵母细胞并非单独存在,其依赖于周围大量的间质组织及细胞的支持,其中的微血管有着重要的养分供给作用。研究表明,冻融前后卵巢中各种组织均有不同程度的损伤[3]。我们曾通过高通量蛋白芯片检测冻融前后卵巢组织中多种促血管生成因子表达量,得出冻融后间质中多种促血管生成因子水平均下降,而angiogenin则是其中下降较明显的一种。我们推测,通过在体外培养液中添加angiogenin可促进冻融组织微循环重建。目前尚无文献报道angiogenin添加至体外培养体系对冻融人卵巢组织血管生成作用的研究,本文首次针对如何优化angiogenin血管生成作用进行探索。
1材料与方法
1.1实验材料选取我院妇科卵巢手术病人,收集手术切除送检后剩余的卵巢皮质组织,病检证实有癌细胞转移至卵巢者剔除。本研究涉及的人体标本收集过程以及知情同意书经四川大学伦理委员会以及四川大学华西第二医院伦理委员会专家审核批准。在培养液中快速用眼科剪剔除卵巢组织髓质后,将厚约1mm 的卵巢组织皮质块分割成面积约为 2-3mm2大小的组织小块。采用本课题组发明的新型玻璃化冷冻法---细针穿刺浸入式玻璃化冷冻法(needle immersed vitrification,NIV)进行卵巢组织冷冻,液氮环境下保存两周后进行解冻复苏。
8周龄重度联合免疫缺陷小鼠(sever combined immune deficiency mise,SCID小鼠;北京华阜康生物科技有限公司)20只,培养液中不添加angiogenin为对照组(NS组),培养液中添加200ng/ml的angiogenin为实验移植组(C/T组),每组10只。
1.2主要试剂与仪器angiogenin抗体(Abcam公司,美国),angiogenin(Gibco公司,美国),CD34抗体(Abcam公司,美国),Ki67抗体(Abcam公司,美国),TUNEL试剂盒(Enzo Life Sciences公司,美国),CO2培养箱(Thermo Forma公司,美国)。
1.3实验方法与分组
1.3.1将新鲜的卵巢皮质组织及采用NIV法进行冷冻复苏的卵巢皮质组织切片,用angiogenin抗体作为二抗进行免疫组化染色。
1.3.2体外培养液配制培养液以α-MEM 为基础液,添加 10% 人血白蛋白, 1% ITS (10μg/ml 胰岛素, 5.5μg/ml 转铁蛋白和6.7ng/ml 亚硒酸钠), 50 μg/ml 维生素C, 0.47 mmol/L丙酮酸, 2mmol/L L-谷氨酰胺,75 IU/ml 青霉素和 75 μg/ml链霉素。体外培养法采用Scott提出的培养方法[4],并做一定的改进。具体操作:将新鲜或冷冻复苏后各组的卵巢组织片切成约 1mm×1mm× mm 大小,分组放入插入有悬挂式培养皿并添加了100ul matrigil(ECM: collagens, laminin, fibronectin)的12孔培养皿中,每孔放2片组织块。每孔中加入800 μl 新鲜培养液,培养皿放置在37℃培养箱中培养,每两天半量更换培养液并观察组织生长情况。
1.3.3采用transwell小室进行体外培养冻融卵巢组织,并按照培养液中添加的angiogenin浓度分为4组,A组培养液中angiogenin浓度为0,B组培养液中angiogenin浓度为100ng/ml,C组培养液中angiogenin浓度为200ng/ml,D组培养液中angiogenin的浓度为400ng/ml,每组10片卵巢皮质组织,体外培养7天后取出进行CD34及Ki67免疫组化染色。
1.3.4采用angiogenin浓度为200ng/ml的培养液进行冻融卵巢皮质组织培养,并按照培养时间长短分为0天/2天/5天及7天组,在相应培养时间将卵巢组织取出进行CD34染色。
1.3.5采用angiogenin浓度为0的培养液进行卵巢组织体外培养后进行异种移植作为对照组(NS组),用angiogenin浓度为200ng/ml的培养液进行卵巢组织体外培养后进行异种移植作为实验移植组(C/T组),每组10片组织,体外培养时间为7天,受体为8周龄的SCID小鼠,移植部位为皮下,移植后1周取出移植物,固定切片后行CD34染色,并用TUNEL试剂盒检测组织凋亡情况。
1.4检测指标
1.4.1冻融前后angiogenin表达情况通过免疫组织化学染色显示angiogenin的表达部位,各部位中冻融前后表达量的变化趋势。
1.4.2微血管计数微血管判定及微血管密度计数方法[5]: 每张切片先在低倍(100 倍)视野镜中选出血管最丰富的三个区域,然后在 400 倍视野下由两位经验丰富的病理科医师同时计数微血管 3 次, 取其平均值。凡被CD34 免疫组化染色染成棕色单个内皮细胞或内皮细胞簇的,均作为一个血管计数,管腔结构形成并不作为判定的必要条件,已形成明显肌层的血管不参与计数。
1.4.3Ki67阳性细胞比例Ki67 指数指 100 个细胞中Ki67 的阳性细胞数,计算方法: 每张切片于 400 倍镜下选定 5 个视野, 每个视野计数 100 个细胞, 共500 个细胞, 计算每张切片上的阳性表达百分数即为 Ki67 指数,根据阳性百分比( PP) 和阳性细胞染色强弱( SI) 制定判定标准。PP 0 分: 阳性细胞数 0~5%, 1分: ~25%, 2 分: ~50%, 3 分: >50%;SI 0 分:阴性, 1 分: 核着色浅, 阳性反应仅沿核膜及核仁周围分布, 2 分: 阳性细胞内呈弥漫性颗粒状而核仁不着色, 3 分: 阳性细胞核内为均一棕色。PP 和 SI 相加后 ≥1 分为阳性表达;≥4 分为高表达[6]。
1.4.4组织凋亡检测采用TUNEL试剂盒对使用angiogenin浓度为200ng/ml的培养液培养7天后行异种移植一周的卵巢组织进行凋亡检测,采用未添加angiogenin的培养液中培养7天后行异种移植一周的卵巢组织作为对照。结果判定:参照 Kim 所述方法,间质凋亡阳性率 = 染色阳性的间质细胞面积/组织总面积×100%;当评判间质细胞凋亡面积时,用图像分析软件半定量测定[7]。
1.5统计学方法采用chi-square 检验分析不同浓度angiogenin培养组组织血管壁Ki67评分构成比;采用单因素方差分析比较干预培养组和空白培养组移植后微血管密度以及凋亡阳性细胞百分比。其中P<0.05 被认为具有统计学意义,统计学软件为SPSS17.0。
2结果
2.1Agiogenin在新鲜卵巢组织的卵泡颗粒细胞、卵母细胞及间质细胞胞浆中表达。冻融后Angiogenin的表达量呈下降趋势,冻融前后卵泡液中的angiogenin表达量下降趋势不明显,而间质细胞中的angiogenin表达量下降趋势明显(图1~2)。
2.2在不同浓度angiogenin培养液中生长的冻融卵巢组织中的微血管密度计数显示,随着angiogenin浓度上升,微血管密度计数增加。其中培养液中添加100ng/ml的angiogenin的B组相较于未添加的A组已出现微血管密度增加趋势,差异有统计学意义(P<0.05),而继续增加浓度的C组较B组有更好的效果,差异有统计学意义(P<0.05),但进一步增加浓度的D组却与C组之间差异无明显统计学意义(P>0.05),见图3~4。
2.3在体外干预后异种移植条件下,C/T组的微血管密度计数较NS组高,差异有统计学意义(P<0.05)。而TUNEL凋亡检测提示C/T组组织凋亡较NS组低,差异有统计学意义(P<0.05,图5~6)。

图1新鲜卵巢组织中angiogenin的表达
Fig. 1The expression of angiogenin in fresh ovarian tissue
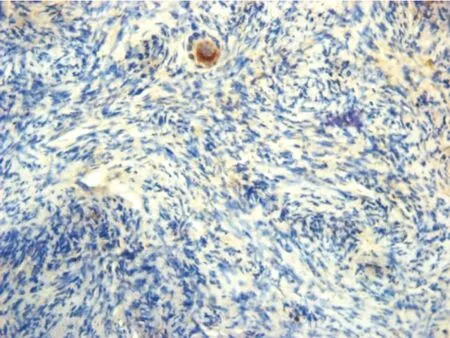
图2冷冻后卵巢组织中angiogenin的表达
Fig. 2The expression of angiogenin in cryopreserved ovarian tissue

图3angiogenin浓度为200ng/ml组CD34表达
Fig. 3The expression of CD34 in group with 200ng/ml of angiogenin

图4未添加angiogenin组CD34表达情况
Figer 4The expression of CD34 in group without angiogenin

图5C/T组凋亡情况
Figer 5Apoptosis in C/T group
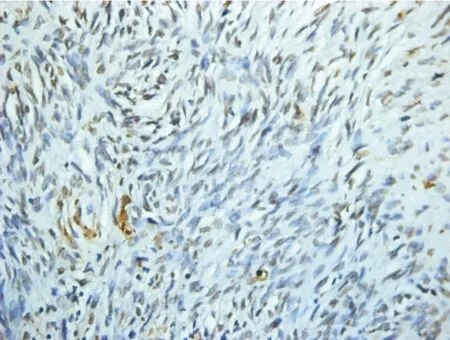
图6NS组凋亡情况
Figer 6Apoptosis in NS group
2.4采用Ki67染色后观察到不同angiogenin浓度培养液中生长的卵巢组织均有增生活性细胞存在,其中可观察到较多的血管内皮细胞增生,说明有较多的新生血管形成。其中C组Ki67高评分比例较A、B两组高,差异有统计学意义(P<0.05),但与D组之间差异无明显统计学意义(P>0.05)。
2.5固定的angiogenin浓度为200ng/ml的培养液进行体外培养的卵巢组织中,培养2天以后即开始出现微血管密度计数增加,差异有统计学意义(P<0.05),而培养5天的组织与培养2天及7天的组织相比,微血管密度计数更高,差异有统计学意义(P<0.05)。
2.6肉眼可见少部分移植组织色泽苍白,多数为淡粉色,较新鲜,移植组织周围血管网形成,且组织已贴附于小鼠皮肤生长。
3讨论
卵巢组织冷冻是女性生育力保存的重要手段之一。因卵巢组织冷冻不需要使用促排卵药物治疗,不延误恶性肿瘤患者的治疗时机,不受年龄和婚姻状况的限制,可能有望同时保存女性生育力和生殖内分泌功能,故其较胚胎冷冻和卵子冷冻技术具有更广阔的应用前景。与卵子冷冻及胚胎冷冻相比,组织冷冻复苏效果受到更多的限制。冻融胚胎体积小,质量轻,降温速度快,复苏后仅依靠胚胎的自身分化潜能即可继续发育。但是卵巢组织的存活与生长并发挥功能,需要保存的不仅仅是各级卵母细胞,还包括大量的间质细胞与组织。本课题组前期研究发现,传统程序化冷冻方法对卵巢组织间质的保存不如玻璃化冷冻法。
有学者回溯总结了卵巢移植的一些研究指出:冷冻后卵巢组织移植卵巢功能的恢复和维持不如新鲜卵巢组织移植[8]。可以推测,冷冻过程对卵巢组织间质的损伤进一步影响了移植后卵巢组织的微循环重建和细胞修复。在卵泡发育过程中,卵巢间质具有支持、营养、促细胞增殖、迁移和稳定局部微环境的作用,部分细胞外基质可以结合生长因子,参与调控卵泡发育和血管新生过程。因此,卵巢间质对卵巢组织片体外培养或移植后卵泡的支持和营养以及微循环的建立具有重要作用。在间质完整性的前提下,血管新生过程与一系列血管生成调节因子相关。
我们的前期研究通过高通量蛋白芯片检测冻融前后卵巢组织中促血管生成因子的表达量发现,angiogenin的表达在冷冻后下降显著。免疫组化结果表明angiogenin在新鲜及解冻后的卵泡液中都有表达,在新鲜组织间质细胞中也有大量angiogenin的表达,但在冻融后的卵巢皮质间质组织中angiogenin的表达明显减少。根据结果我们可以推断,添加angiogenin将作用于间质细胞,从而促进血管生成。
本研究在卵巢组织体外培养过程中短期添加angiogenin因子按不同添加浓度进行体外培养。前期实验亦证实含有200ng/ml angiogenin培养液中的卵巢组织片的微血管计数较空白对照组高。既往有研究者对人卵泡液中的angiogenin浓度进行测定,得到的浓度约为276ng/ml[9]。本研究对照了添加angiogenin浓度分别为0,100ng/ml,200ng/ml以及400ng/ml的培养液对体外干预培养卵巢组织血管生成的影响。结果表明在添加angiogenin 200ng/ml的培养液中卵巢组织片血管计数最高。研究结果提示随着angiogenin浓度增加,组织中微血管生成越多,当angiogenin浓度达到200ng/ml时效果已经达到最优,继续增加angiogenin的浓度并不能显著增加微血管密度。我们认为其可能的原因是由于angiogenin作为蛋白质分子,其发挥作用需要与相应受体结合,当受体达到饱和,继续增加浓度不能增加其效果。
研究亦发现,冻融卵巢组织培养前后间质细胞中均见VEGF呈斑片状弱表达,培养48小时后VEGF表达和微血管均增加并达到峰值,说明冷冻卵巢组织复苏后通过短期体外培养,可以调动血管生成过程[10]。但是,在不添加干预因子的卵巢组织体外培养过程中,培养2天时血管密度计数达到峰值而培养4天以及培养6天后微血管密度下降,本实验采用添加了angiogenin的培养液进行卵巢组织体外干预培养,并对不同培养时间的卵巢组织微血管密度进行计数后发现,从培养2天开始干预组微血管密度较空白对照组高,培养5天后的干预组卵巢组织微血管密度最高,与前期实验结果相比微血管保持的时间更久,此结果说明添加Angiogenin可以能持续促进新生血管形成以及保持已建立的微血管。本结果适用于本实验条件,说明体外培养到5天,未血管密度计数比培养2天及7天高,但并不是说所有的体外培养都应培养到5天。通过不同的培养条件,比如添加多种促学管生成因子协同培养,或者在未来采用组织工程材料进行培养支持可能更好的促进微循环重建,使得冻融卵巢组织的利用更加有效。
解冻后移植是冷冻卵巢组织的利用的重要方法,如果要恢复内分泌功能则必须通过移植进行,若只为生育也许可以采用体外培养结合体外成熟技术来获得可利用的成熟卵子。在实验阶段建立卵巢异种移植模型是一种有效的研究方法,采用SCID小鼠作为移植受体可以极大极大程度降低移植后的排斥反应。培养后移植一周检测微血管密度表明angiogenin浓度为200ng/ml在体内仍能较好的促进血管生成。
4结论
本研究提示在angiogenin浓度为200ng/ml的培养液中培养7天并进行移植一周后的卵巢组织凋亡比率较空白对照组低。较低的凋亡比率意味着更好的保存现有组织细胞,从另一个角度说明了angiogenin对卵巢组织功能的保护作用。
本研究在卵巢组织体外培养过程中添加不同浓度的angiogenin因子进行体外干预,促进移植物微循环的及时建立并保持其稳定性,抑制凋亡发生,促进卵巢组织血供的早期恢复。本研究从改善间质存活和促进微循环建立着手,为优化和改进女性生育力保存体系提供研究思路。但是,卵巢功能的长期恢复在移植物血循环改善的基础上,还与原始卵泡的发育启动和生长成熟过程相关,该过程的调控因素尚需要后续实验进一步研究。
【参考文献】
[1] TIONG V, ROZITA A M, TAIB N A,etal. Incidence of Chemotherapy-Induced Ovarian Failure in Premenopausal Women Undergoing Chemotherapy for Breast Cancer [J]. World J Surg, 2014, 38(9): 2288-2296.
[2]DOLMANS M M, JADOUL P, GILLIAUX S,etal. A review of 15 years of ovarian tissue bank activities [J]. J Assist Reprod Gen, 2013, 30(3): 305-314.
[3]XIAO Z, WANG Y, LI L-L,etal. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method [J]. Cryoletters, 2013, 34(5): 520-526.
[4]SCOTT J E, CARLSSON I B, BAVISTER B D,etal. Human ovarian tissue cultures: extracellular matrix composition, coating density and tissue dimensions [J]. Reprod Biomed Online, 2004, 9(3): 287-293.
[5]PEREZATAYDE A R, SALLAN S E, TEDROW U,etal. Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia [J]. Am J Pathol, 1997, 150(3): 815-821.
[6]JALAVA P, KUOPIO T, JUNTTI-PATINEN L,etal. Ki67 immunohistochemistry: a valuable marker in prognostication but with a risk of misclassification: proliferation subgroups formed based on Ki67 immunoreactivity and standardized mitotic index [J]. Histopathology, 2006, 48(6): 674-682.
[7]KIM S S, YANG H W, KANG H G,etal. Quantitative assessment of ischemic tissue damage in ovarian cortical tissue with or without antioxidant (ascorbic acid) treatment [J]. Fertil Steril, 2004, 82(3): 679-685.
[8]SILBER S J. Ovary cryopreservation and transplantation for fertility preservation [J]. Molecular Human Reproduction, 2012, 18(2): 59-67.
[9]KAWANO Y, HASAN K Z, FUKUDA J,etal. Production of vascular endothelial growth factor and angiogenic factor in human follicular fluid [J]. Mol Cell Endocrinol, 2003, 202(1-2): 19-23.
[10] 傅锦媚, 汪燕, 肖准,etal. 不同冷冻方法对人卵巢组织血管内皮生长因子表达及血管生成的影响 [J]. 中国组织工程研究与临床康复, 2010, 14(2): 233-236.
The microcirculation reconstruction effect of angiogenin on cryopreserved human ovarian tissue
ZHANG Long,KANG BeiJia,LI Shuangwei,et al
(WestChinaSecondHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo investigate the microcirculation reconstruction effect of angiogenin on cryopreserved human ovarian tissue in vitro and xenotransplantation. MethodsThe human ovarian tissues were collected and freeze thawed with NIV. The expression of angiogenin was detected with immunohistochemistry before and after freeze thawing. The freeze thawing ovarian tissues were cultured in angiogenin (0,100,200 and 400ng/ml) for 7 days. The tissues were stained with CD34 immunohistochemistry to observe the effect of microcirculation of reconstruction. The human ovarian tissue cultured in vitro was implanted in the skin of SCID mice. 1 week after implantation, the vessel density and apoptosis of ovarian tissue were observed. ResultsOvarian tissues were culture for 7 days in four groups according to the concentration of Angiogenin,0,100,200 and 400ng/ml. The micro vascular density increase as Angiogenin concentration increase, but same at 200 and 400ng/ml. Angiogenesis in 5 day group was more effective than that of 2 days and 7 days. After a short term culture,the ovarian tissue were xenotransplanted to SCID mice. One week later,the micro vascular density of 200ng/ml group was higher than control group,and the apoptosis rate of this group was significantly lower than that of control group. ConclusionThe 200ng/ml of Angiogenin may be the best concentrate for in vitro culture ovarian tissue and xenontransplanted ovarian tissue. The density of micro vascular in 5 day group is the highest. Apoptosis in angiogenin intervention group is significantly lower than control group. Our research provides the research clue to optimize and improve the female fertility preservation system.
【Key words】Angiogenin;Vitrification; Human;Ovarian tissue; Reconstruction of microcirculation;Fertility preservation
基金项目:国家自然科学基金(31171442)
通信作者:李尚为,教授,博士生导师,本刊编委,E-mail: lswivf01@sina.com
【中图分类号】R 329.33
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.05.003
(收稿日期:2016-02-01; 编辑: 张文秀)
