老年脑胶质瘤患者术后生存及预后相关因素分析*
2016-06-27张维斌廖维靖
张维斌 廖维靖
(1.枣阳市第一人民医院神经外科, 湖北 枣阳 441200;2.武汉大学中南医院康复医学科,湖北 武汉 430071)
·论著·
老年脑胶质瘤患者术后生存及预后相关因素分析*
张维斌1廖维靖2
(1.枣阳市第一人民医院神经外科, 湖北 枣阳 441200;2.武汉大学中南医院康复医学科,湖北 武汉 430071)
【摘要】目的探讨老年脑胶质瘤患者术后生存情况及预后相关因素。方法选择2010年1月~2013年1月在我院行手术治疗的120例脑胶质瘤患者作为研究对象,并对患者进行3年随访,记录患者生存情况;以性别、术前KPS评分、病理分级、肿瘤大小、瘤体切除放射、术后辅助放/化疗等临床资料作为观察指标,筛选出影响患者预后的危险因素。结果至末次随访,120例脑胶质瘤患者死亡74例,患者中位生存时间为28.1个月;1、2、3年生存率分为别92.7%、59.8%和38.3%;单因素分析结果显示,KPS评分、病理分级、肿瘤大小、术后辅助治疗与脑胶质瘤预后密切相关(均P<0.05);多因素分析证实,病理分级、肿瘤大小、辅助放/化疗是对脑胶质瘤患者预后造成影响的独立危险因素(均P<0.05)。结论病理分级、肿瘤长径、术后辅助放/化疗是影响老年脑胶质瘤患者预后的主要因素。
【关键词】脑胶质瘤;手术;生存率;预后;影响因素
脑胶质瘤发病率约占颅内恶性肿瘤的35%~40%[1],该病不仅发病率高,且治疗后复发率高,患者预后差,给临床治疗带来极大挑战。手术是脑胶质瘤治疗的主要措施,开放式大骨瓣开颅术能够将恶变组织完全切除,然而在切除中可能会对正常脑组织造成影响。伴随着显微外科技术的发展,临床上已经开始逐渐用显微手术代替开放手术治疗脑胶质瘤。然而显微手术后脑胶质瘤患者的认知功能、作用机制仍缺乏相关报道,部分高度恶性的脑胶质瘤患者的手术疗效和预后依然不容乐观[2,3]。因此掌握患者术后预后的影响因素,对提高手术疗效、改善患者预后具有重要的指导意义。鉴于此,本研究对我院行手术治疗的脑胶质瘤患者的临床资料进行回顾性分析,探讨影响术后患者预后的相关因素,旨在为脑胶质瘤术后预后的医疗策略提供参考,现报告如下。
1资料与方法
1.1一般资料回顾性分析2010年1月~2013年1月在我院行手术治疗的120例脑胶质瘤患者的临床资料,其中男73例,女47例,年龄61~78岁,平均(70.1±8.4)岁;病程2~15个月,平均(7.4±3.1)个月。按照WHO关于脑胶质瘤的分类及分级标准[4]:Ⅰ级18例,Ⅱ级52例,Ⅲ级29例,Ⅳ级21例。术前经MRI或CT等影像学检查显示,肿瘤最大直径0.6~10.0cm(若有多个病灶,统计各病灶最大直径之和),平均(4.3±2.1)cm。所有患者均排除全身性感染、神经系统病变、自身免疫性疾病或其他恶性肿瘤者,且患者肝、肾功能及凝血功能正常。
1.2手术及术后治疗方法术前经MRI或CT等影像学检查,明确肿瘤的位置、大小和周围组织,以功能区、重要血管区和非功能区3种入路方式,手术方式包括全切或次全切术。术后76例患者给予放射治疗,剂量45~65Gy,共计30~35次;术后化疗患者2例,采用替莫唑胺单药化疗方案。
1.3术后随访所有患者术后进行门诊或电话随访,共随访36个月。随访起始日期以术后第2天开始计算,随访至2016年1月,以手术当天到死亡或最后随访时间作为生存时间,失访病例以失访当日作为死亡开始计算。
1.4资料分析将患者临床资料、治疗情况等录入统一调查表,分析患者临床资料与生存情况的关系。
1.5统计学处理采用SPSS 21.0统计软件进行数据处理,患者生存分析采用Kaplan-Meier法,组间比较采用Log-Rank test,多因素分析采用Cox回归模型,以P<0.05为差异有统计学意义。
2结果
2.1脑胶质瘤患者生存分析至末次随访,120例脑胶质瘤患者死亡74例,患者中位生存时间为28.1个月;1、2、3年生存率分为别92.7%、59.8%和38.8%,见图1。
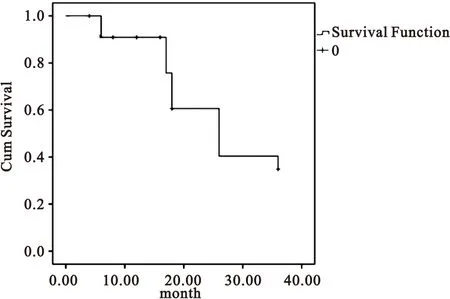
图1120例脑胶质瘤患者术后生存曲线
Figure 1120 cases of glioma patients survival curve
2.2脑胶质瘤预后影响因素的单因素分析结果显示,KPS评分、病理分级、肿瘤大小、术后辅助治疗与脑胶质瘤预后密切相关(P<0.05),见表1。
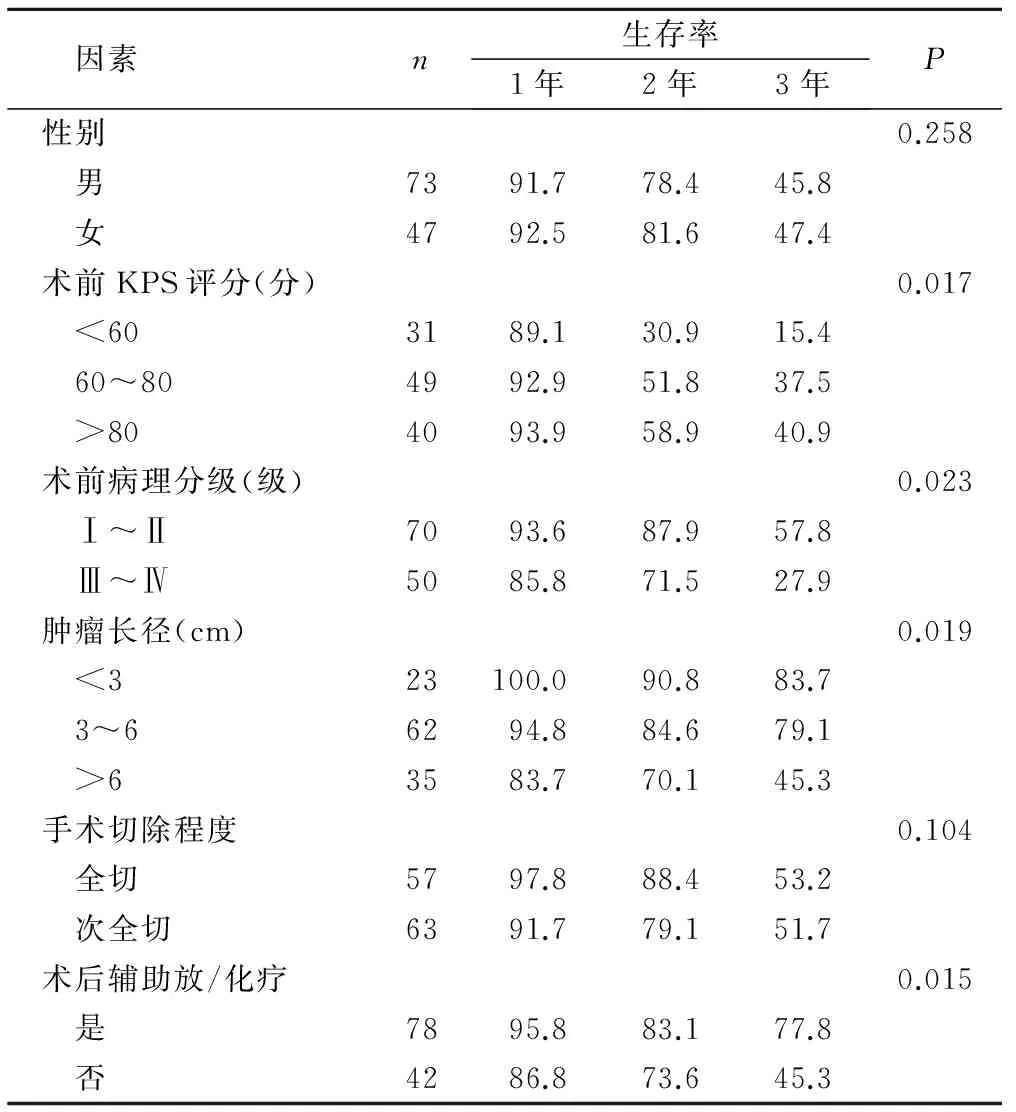
表1 预后影响因素的单因素分析
2.3脑胶质瘤预后影响因素的多因素分析 多因素分析结果证实,病理分级、肿瘤大小、辅助放/化疗是对脑胶质瘤患者预后造成影响的独立危险因素(P<0.05),见表2。
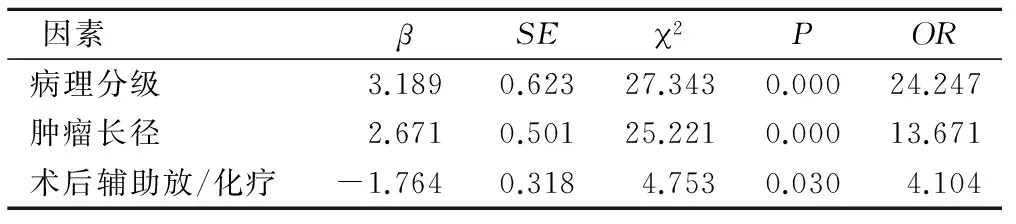
表2 脑胶质瘤预后影响因素的多因素分析
3讨论
目前脑胶质瘤的标准治疗方案是手术联合放、化疗。将病变部位尽可能完全切除,且最低程度影响脑功能,是术者所应遵循的原则。传统开颅术对瘤体和正常脑组织定位主要依赖于医生直视,然而术区不清晰以及脑组织复杂结构等均会影响医生准确识别正常脑组织和瘤体的界限,导致术中切除不完全甚至损伤正常组织。一项国外研究[5]证实,传统开颅术难以完全切除瘤体,导致术后复发率较高。国内研究[6]亦证实,过度切除脑组织会对正常脑功能区及神经功能造成损伤,即使手术顺利完成也会遗留严重后遗症。显微手术在显微镜下能够对瘤体精准切除,并且最大程度减少正常脑组织的暴露,因此患者安全性更高。然而脑胶质瘤患者术后的生存率并不高,Höring等[7-11]报道称脑胶质瘤患者1、2、3年生存率分别为90.8%、57.4%和46.7%。本研究显示,脑胶质患者1、3、5年生存率分为别92.7%、59.8%和38.8%,说明患者术后远期生存率并不高,需要对影响患者预后的因素进行分析,并采取相应措施。
虽然手术联合术后辅助放、化疗明显提高了脑胶质瘤的临床疗效,但是患者的预后依然不甚如人意。本研究显示,病理分级、肿瘤大小、辅助放/化疗是对脑胶质瘤患者预后造成影响的独立危险因素。脑胶质瘤分级越低,肿瘤恶性程度也越低,瘤体生长慢,病灶浸润程度也较为局限,从而使瘤体术中切除难度较低。Gabashvili 等[12-14]报道称脑胶质瘤病理分级越高,其预后越差。饶良俊[9]则证实肿瘤大小与肿瘤细胞数量密切相关,因此肿瘤最大长径多作为疗效评估的标准之一。本研究中肿瘤直径越小,患者预后越好。虽然外科手术的目标是将肿瘤完整切除,然而现实是在手术操作中很难做到,因此国内外专家皆认为脑胶质瘤术后应联合放、化疗。Borisov 等[15-18]报道称术后联合放疗能够使脑胶质瘤3年生存率提高25%,5年生存率提高15%。本研究亦显示辅助放/化疗患者1年生存率为93.3%,而单纯手术的患者仅为77.4%,提示术后辅助放/化疗可以作为脑胶质瘤综合治疗的方案之一。本研究依然存在一定不足,随访时间仅3年,且入组样本量偏少,因此研究得出的结论可能还存在一定误差,我们会在接下来的长期随访中进一步分析。
4结论
本研究经单因素分析结果显示,KPS评分、病理分级、肿瘤大小、术后辅助治疗与脑胶质瘤预后密切相关;而多因素分析证实,病理分级、肿瘤大小、辅助放/化疗是对脑胶质瘤患者预后造成影响的独立危险因素。
【参考文献】
[1]Kounelakis MG, Dimou IN, Zervakis ME,etal.Strengths and Weaknesses of 1.5T and 3T MRS Data in Brain Glioma Classification[J].IEEE Trans Inf Technol Biomed, 2011,15(4):647-654.
[2]桂松柏,白吉伟,于洮,等.成人单侧丘脑胶质瘤手术技术探讨[J].中华神经外科杂志,2013,29(3):251-254.
[3]Garrod R, Bestall JC, Paul EA,etal.Development and validation of a standardized measure of activity of daily living in patients with severe COPD:the London Chest Activity of Daily Living scale(LCADL)[J].Respir Med, 2000,94(6):589-596.
[4]Scazufca M, Almeida OP, Vallada HP,etal.Limitations of the Mini-Mental State Examination for screening dementia in a community with low socioeconomic status: results from the Sao Paulo Ageing & Health Study[J].Eur Arch Psychiatry Clin Neurosci, 2009,259(1):8-15.
[5]Nahed BV, Redjal N, Brat DJ,etal.Management of patients with recurrence of diffuse low grade glioma : A systematic review and evidence-based clinical practice guideline[J].J Neurooncol, 2015,125(3):609-630.
[6]陈晓丰,杨光,滕雷,等.荧光引导下脑胶质瘤边界的组织病理学研究[J].中华神经外科疾病研究杂志,2012,11(2):145-148.
[7]Höring E, Harter PN, Seznec J,etal.The “go or grow” potential of gliomas is linked to the neuropeptide processing enzyme carboxypeptidase E and mediated by metabolic stress[J].Acta Neuropathol, 2012,124(1):83-97.
[8]张杰,施庆余,罗爱林,等.麻醉期间目标导向液体治疗对胶质瘤开颅切除术患者预后的影响[J].华中科技大学学报(医学版),2012,41(1):99-102.
[9]饶良俊,张祥松,王晓燕,等.PET-CT多种显像剂的应用与MRI对胶质瘤诊断价值对比分析[J].中华神经外科杂志,2013,29(10):1009-1012.
[10] Janssens GO, Gidding CE, Van Lindert EJ,etal.The role of hypofractionation radiotherapy for diffuse intrinsic brainstem glioma in children: a pilot study.[J].Int J Radiat Oncol Biol Phys, 2009,73(3):722-726.
[11] Xu R, Fang X H, Zhong P. Myosin VI contributes to malignant proliferation of human glioma cells[J]. Korean J Physiol Pharmacol,2015,20(2):139-145.
[12] Gabashvili A N, Baklaushev V P, Grinenko N F,etal. Antitumor Activity of Rat Mesenchymal Stem Cells during Direct or Indirect Co-Culturing with C6 Glioma Cells[J]. Bull Exp Biol Med,2015,160(4):519-524.
[13] Amirian E S, Zhou R, Wrensch M R,etal. Approaching a Scientific Consensus on the Association between Allergies and Glioma Risk: A Report from the Glioma International Case-Control Study[J]. Cancer Epidemiol Biomarkers Prev,2016,25(2):282-290.
[14] Mazzocco P, Barthelemy C, Kaloshi G,etal. Prediction of Response to Temozolomide in Low-Grade Glioma Patients Based on Tumor Size Dynamics and Genetic Characteristics[J]. CPT Pharmacometrics Syst Pharmacol,2015,4(12):728-737.
[15] Borisov K E, Sakaeva D D. The immunosuppressive microenvironment of malignant gliomas[J]. Arkh Patol,2015,77(6):54-63.
[16] Liu J, Li M, Li G,etal. Anti-leucine-rich glioma-inactivated 1 limbic encephalitis: A case report and literature review[J]. Exp Ther Med,2016,11(1):315-317.
[17] Liu Q, Cao P. Clinical and prognostic significance of HIF-1alpha in glioma patients: a meta-analysis[J]. Int J Clin Exp Med,2015,8(12):22073-22083.
[18] Zhao L. Hirudin inhibits cell growth via ERK/MAPK signaling in human glioma[J]. Int J Clin Exp Med,2015,8(11):20983-20987.
Long term survival and prognostic factors of elderly patients with glioma after operation
ZHANG Weibin1,LIAO Weijing2
(1.DepartmentofNeurosurgery,ZaoyangFirstPeople′sHospital,Zaoyang441200,Hubei,China; 2.DepartmentofRehabilitation,ZhongnanHospital,WuhanUniversity,Wuhan430071,China)
【Abstract】ObjectiveTo explore the long term survival and prognostic factors of elderly patients with glioma after operation.Methods120 glioma patients treated in our hospital from 2010 January to 2013 January were selected as research object. The patients were followed up for 3 years, and the long-term survival of patients were recorded. The gender, tumor grade, tumor size and other general information were observed.ResultsTo the last follow-up, 74 patients died of gastric cancer. The median survival time was 28.1 months.1, 2, 3 year survival rate was 92.7%, 59.8% and 38.8%. Univariate analysis showed that KPS score, TMN stage, depth of invasion, pathological grade, tumor size, postoperative adjuvant radiotherapy/chemotherapy were related to the prognosis of the patients (all P<0.05). Multivariate analysis showed that pathological grade, tumor size, postoperative adjuvant radiotherapy/chemotherapy were independent risk factors for the prognosis of patients with gastric cancer (all P<0.05) .ConclusionPathological grade, tumor size, postoperative adjuvant radiotherapy/chemotherapy are main factors effect of brain glioma prognosis.
【Key words】Glioma; Operation; Survival rate; Prognosis; Influencing factors
基金项目:国家自然科学基金(81072917)
【中图分类号】R 739.41
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.06.012
(收稿日期:2015-12-18; 修回日期: 2016-03-20; 编辑: 母存培)
