CyberKnife等中心及非等中心立体定向治疗计划质量及效率评价
2016-06-18朴俊杰徐寿平王金媛曲宝林段学章巩汉顺徐慧军
朴俊杰 徐寿平 王金媛 曲宝林 段学章 巩汉顺 徐慧军
100853 解放军总医院(朴俊杰,徐寿平,王金媛,曲宝林,巩汉顺);100039 解放军第302医院(朴俊杰,段学章,徐慧军)
·临床研究·
CyberKnife等中心及非等中心立体定向治疗计划质量及效率评价
朴俊杰徐寿平王金媛曲宝林段学章巩汉顺徐慧军
100853 解放军总医院(朴俊杰,徐寿平,王金媛,曲宝林,巩汉顺);100039 解放军第302医院(朴俊杰,段学章,徐慧军)
【摘要】目的探讨并评价CyberKnife(CK)系统利用等中心和非等中心两种计划模式立体定向治疗计划(SRT)的剂量学特性及差异。方法将18例肿瘤患者分为A、B两组:A为小体积组即肿瘤大小在3 cm以下;B为大体积组即肿瘤大小在3 cm以上。每组9例患者计划分别给予同一处方剂量条件40 Gy/5F。在相同的条件下,分别以等中心和非等中心两种布野方式立体定向治疗技术设计相应的计划,通过其靶区适形指数(CI)、非均匀指数(HI)、梯度指数(GI)和危及器官等剂量学参数,分析评估SRT计划优化质量及实施效率,从而实现评价两种治疗模式的剂量学差异。结果等中心组计划执行的平均治疗时间 (P=0.002)及机器MUs(P<0.001)明显优于非等中心组; CI均值(A:P=0.027;B:P=0.007)和GI均值(A:P<0.001;B:P<0.001)分别小于非等中心组; HI均值则略高于非等中心组(A:P=0.029;B: P<0.001);A组平均剂量归一值(P=0.011)等中心组优于非等中心组,而B组(P=0.012)等中心组低于非等中心组。结论等中心治疗模式在治疗时间、MU数及GI上均优于非等中心,在CI和 HI上略低于非等中心模式。小体积肿瘤可考虑等中心治疗模式,而大体积肿瘤则宜用非等中心治疗模式;但仍需更多的临床病例给予研究。
【关键词】CyberKnife;等中心;非等中心;计划质量;剂量学
(ThePracticalJournalofCancer,2016,31:747~751)
立体定向放射治疗(stereotactic radiation therapy,SRT)作为1种外照射治疗技术方法,目前主要采用单次或少数分次精确地对肿瘤靶区进行高剂量照射。SRT主要特点就是对肿瘤靶区实施准确的高剂量照射同时实现靶区外剂量快速地递减。结合生物学特性,采用SRT技术肿瘤可能会得到更高的等效生物剂量,从而获得更佳的临床疗效[1-2]。近年来研究人员采用SRT技术包括CyberKnife(Accuray,CA,USA)技术[3],已经在肿瘤治疗中取得了可喜的临床结果[4-6]。CK系统利用较好的图像引导技术实现精确地照射靶区剂量;通过等中心/非等中心多野聚焦方式从而形成肿瘤靶区周围陡峭的剂量分布。本研究目的是评价CK系统等中心计划的剂量分布及其可行性,进而评估等中心与非等中心两种模式治疗计划之间剂量学特性及差异。
1资料与方法
1.1病例选择
选取自2013年1月至2014年5月期间在解放军第302医院肿瘤放射治疗中心行CyberKnife立体定向放疗的患者18例,男性14例,女性4例,年龄21~73岁,中位年龄54岁,其中头颈部肿瘤患者6例,肺部肿瘤患者6例,腹部肿瘤患者6例。根据肿瘤大小分为A、B两组(表1),其中A为小靶区组(靶区大小在3 cm以内),B为大靶区组(靶区大小在3~5 cm);每组共9例患者,其中头颈、肺及腹部肿瘤各3例。

表1 2组靶区体积的比较
1.2体位固定和CT扫描
根据CK系统的定位要求[7],患者采用仰卧位,双手放于身体两侧,头颈部肿瘤患者采用热塑膜与头枕配合固定,体部肿瘤患者采用真空垫固定,患者于SIEMENS SOMATOM 40排CT下进行扫描,扫描条件为电压120 kV,电流400 mA,层厚1 mm,总长度大于20 cm,总层数要求小于512层。
1.3靶区及危及器官的勾画
CT扫描后将患者影像由网络传输到CK系统数据服务器(CyberKnife Data Management System,CDMS),使用其配套的TPS(MultiPlan,Ver4.0.2)进行图像的融合及配准,并勾画出相应的肿瘤靶区及其危及器官结构。
1.4处方剂量的要求
本研究仅从剂量学特性角度对比两种方法的差异,为了便于比较,研究将不同肿瘤患者的处方剂量统一为40 Gy/5F。
1.5计划设计
所有计划都在MultiPlan工作站上完成,对每个患者设计两套不同的治疗计划,即等中心与非等中心计划,分别选取单个准直器[8]完成计划,根据TG-101[9]报告,设置相同的条件且危及器官受量均在要求范围内。
1.6计划比较
根据分组,对比分析其靶区适形指数(conformity index,CI)、非均匀指数(homogeneity index,HI)、梯度指数(gradient index,GI)与危及器官等剂量学参数,以及机器跳数(MUs)、治疗时间(Time)等参数评估SRT计划优化质量及实施效率情况[10]。
1.7数据统计
应用统计学软件SPSS 16.0进行处理,数据以均数±标准差(SD),采用配对t检验进行数据统计与分析,P<0.05为差异有统计学意义。
2结果
两组(A为小靶区组,B为大靶区组)等中心/非等中心治疗计划均获得了较好的剂量分布,满足99%的靶区体积均接受95%处方剂量的条件,各剂量学参数的数据统计分析见表2。
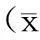
表2 2种计划的剂量学参数比较±s)
2.1靶区覆盖
两种计划方式所得到的剂量分布不同,并且在A、B组中分布也存在差异,分别见图1、2及表2。
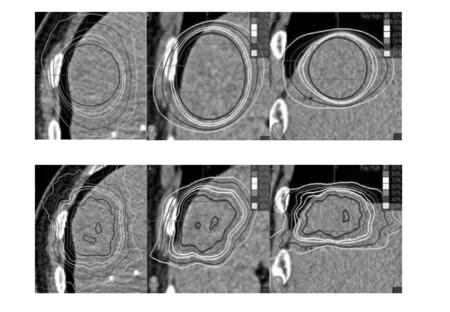
图1 A组等中心(上)与非等中心(下)治疗计划横断、矢状及冠状面剂量分布情况

图2 B组等中心(上)与非等中心(下)治疗计划横断、矢状及冠状面剂量分布情况
靶区适形指数(CI)[11]用来表示处方剂量体积(PIV)与靶区PTV的相对位置关系,定义为:(被处方剂量线包绕的PTV体积)2/(PTV体积×PIV)。该指数反映了处方剂量覆盖靶区的质量以及接受处方剂量的正常组织体积。一个完美的治疗计划CI等于1.00,即PTV完全为处方剂量线包绕。A、B两组P值均小于0.05,且等中心组均值明显小于非等中心组,说明无论靶区大小,非等中心组靶区适形指数CI明显优于等中心组。
靶区非均匀指数(HI)[12]被定义为PTV剂量最大值和最小值之差与平均剂量的比值。这意味着:当该指数为零时PTV剂量分布将是最均匀的。A、B两组P值均小于0.05,即两组都有差异,且等中心组均值明显大于非等中心组,因此说明无论靶区大小,非等中心组靶区HI明显优于等中心组。
靶区梯度指数(GI)[13]用来反映在靶区以外的剂量跌落。PIV外低剂量线可能覆盖更多的正常组织,并且可以解释放疗所产生的并发症,特别是当靶区接近危及器官时。这个指数被定义为 1/2 处方剂量所围绕的全部体积与PIV的比值。GI值低表示剂量跌落快。A、B两组P值均小于0.05,即两组都有差异,且等中心组均值明显大于非等中心组,因此说明无论靶区大小,等中心组GI明显优于非等中心组。
剂量归一值指处方剂量所赋予的相对等剂量线。如表2所示A组P值小于0.05,且等中心组平均剂量归一值明显大于非等中心组,说明小靶区中等中心组计划质量优于非等中心组;B组P值小于0.05,且非等中心组平均剂量归一值明显大于等中心组,说明大靶区中非等中心组计划质量要优于等中心组。
2.2治疗效率参数比较
治疗效率也作为评估两种计划的指标,表2评估了治疗时间(Time)及总机器跳数(MUs)。
治疗时间(Time,单位min)作为治疗效率最直观的参数,A、B两组P值均小于0.05,且等中心组均值明显小于非等中心组,因此说明无论靶区大小,等中心组计划治疗时间明显优于非等中心组。
总机器跳数(MUs)能够客观地体现机器的负荷情况,A、B两组P值均小于0.05,且等中心组均值明显小于非等中心组,因此说明无论靶区大小,等中心组治疗计划MUs明显优于非等中心组。
2.3正常组织受量
研究中还分析了计划中正常组织受量,正常肝和肺的体积-剂量参数情况,见表2。
正常肝脏平均受量,被定义为剔除肿瘤靶区的正常肝脏体积所受到的平均剂量。A组P值小于0.05,且等中心组均值明显小于非等中心组,因此说明小靶区中等中心组正常肝脏平均受量明显好于非等中心组。B组P值大于0.05,因此说明在大靶区两组的正常肝脏平均受量无明显差异。
正常肺平均受量,被定义为剔除肿瘤靶区的正常肺体积所受到的平均剂量。A组P值小于0.05,且等中心组均值明显小于非等中心组,因此说明小靶区中等中心组正常肺平均受量明显优于非等中心组。B组P值大于0.05,因此说明在大靶区中两组的正常肺平均受量不存在明显差异。
3讨论
在SRT治疗条件下,CK系统等中心及非等中心治疗计划基本均能满足临床的剂量分布和剂量学参数要求。尽管两种治疗模式剂量分析存在一些差异,但临床上不易辨别其优劣,最大的可能是因不同治疗照射技术的特点所致[14]。
CK系统是基于圆形准直器的立体定向放射治疗系统,其利用非适形圆形辐射野实现了非共面的叠加式剂量照射,容易导致靶区组织中冷、热点的出现[4]。而这些冷热点可能会引起该技术具有比常规调强或旋转调强治疗(Tomotherapy或VMAT)等技术更不均匀的剂量分布。假如肿瘤靶区和危及器官受量均满足SRT临床剂量要求的话,那么可精确地预见的是两种治疗模式在肿瘤控制概率及并发症上应该无明显差别。许多立体定向放射治疗的研究显示,通过利用均匀或非均匀剂量分布都可以获得良好的肿瘤控制率[6,15]。而SRT中剂量均匀或非均匀的重要性是有争议的[16]。
CK治疗系统最明显的优势是利用立体X线成像系统实时精确地追踪运动靶区进行照射[17],从而可更有效地减少周围正常组织损伤[18]。然而,由于SRT中较高的处方剂量、射野束多及其束流强度调制的复杂性,治疗期间分次内需对运动靶区的予以实时修正,从而导致了治疗时间的增加。本研究结果表明,相比于非等中心治疗,等中心治疗计划可达到较为理想的剂量分布,同时显著地减少了治疗时间和机器MUs,CK系统治疗头内无束流均整器而形成较为陡峭的离轴束流曲线分布。因而不难理解,表2中肿瘤大小A、B组之间采用等中心治疗模式HI值存在明显的差异问题。另外,等中心及非等中心两种治疗模式中HI值A组(P=0.029)、B组(P<0.001)均存在差异,进一步说明CK系统中无均整束流会对等中心治疗靶区的均匀性存在较大的影响,从而导致临床中无论大、小靶区一般利用准直器实施非等中心照射技术的现状。本研究根据实际的临床需要,针对不同患者的肿瘤可选择不同的治疗模式,以期充分利用并发挥各自的优势。
总之,等中心治疗模式在治疗时间、机器MU数及GI上均优于非等中心,但是在靶区适形指数(CI)和非均匀指数(HI)上略低于非等中心模式,考虑到肿瘤大小对2种模式下处方剂量归一的影响,CK系统针对不同大小的肿瘤可采用不同模式设计治疗计划设计可能。临床上体积小肿瘤(特别临近较为重要危及器官)是可以考虑等中心治疗技术,而大体积肿瘤则适用非等中心治疗技术模式;但仍需更多的临床病例及疗效予以研究。
参考文献
[1]Brenner DJ,Hall EJ.Fractionation and protraction for radiotherapy of prostate carcinoma〔J〕.Int J Radiat Oncol Biol Phys,1999,43(5):1095-1101.
[2]Ritter M.Rationale,conduct,and outcome using hypofractionated radiotherapy in prostate cancer〔J〕.Semin Radiat Oncol,2008,18(4):249-256.
[3]Adler JR,Murphy MJ,Chang SD,et al.Image-guided robotic radiosurgery〔J〕.Neurosurgery,1999,44:1299-1307.
[4]King CR,Brooks JD,Gill H,et al.Stereotactic body radiotherapy for localized prostate cancer:interim results of a prospective phase II clinical trial〔J〕.Int J Radiat Oncol Biol Phys,2009,73(4):1043-1048.
[5]Freeman DE,King CR.Stereotactic body radiotherapy for low-risk prostate cancer:five-year outcomes〔J〕.Radiat Oncol,2011,6:3.
[6]King CR,Freeman D,Kaplan I,et al.Stereotactic body radiotherapy for localized prostate cancer:pooled analysis from a multi-institutional consortium of prospective phase II trials〔J〕.Radiother Oncol,2013,109(2):217-221.
[7]Sotiropoulou E,Stathopoulos K,Thanos L.CT-Guided Fiducial Placement for CyberKnife Stereotactic Radiosurgery:An Initial Experience〔J〕.Cardiovasc Intervent Radiol,2010,33(3):586-589.
[8]Hamamoto Y,Manabe T,Nishizaki O,et al.Influence of collimator size on three-dimensional conformal radiotherapy of the CyberKnife〔J〕.Radiat Med,2004,22(6):442-448.
[9]Benedict SH,Yenice KM,Followill D,et al.Stereotactic body radiation therapy:the report of AAPM Task Group 101〔J〕.Med Phys,2010,37(8):4078-4101.
[10]Gevaert T,Levivier M,Lacornerie T,et al.Dosimetric comparison of different treatment modalities for stereotactic radiosurgery of arteriovenous malformations and acoustic neuromas〔J〕.Radioth Oncol,2013,106(2):192-197.
[11]Feuvret L,Noel G,Mazeron JJ,et al.Conformity index:a review〔J〕.Int J Radiat Oncol Biol Phys,2006,64(2):333-342.
[12]Kataria T,Sharma K,Subramani V,et al.Homogeneity Index:An objective tool for assessment of conformal radiation treatments〔J〕.J Med Phys,2012,37(4):207-213.
[13]Paddick I,Lippitz B.A simple dose gradient measurement tool to complement the conformity index〔J〕.J Neurosurg,2006,105(Suppl):194-201.
[14]Lin YW,Lin KH,Ho HW,et al.Treatment plan comparison between stereotactic body radiation therapy techniques for prostate cancer:Non-isocentric CyberKnife versus isocentric RapidArc〔J〕.Physica Medica,2014,30(6):654-661.
[15]King CR,Collins S,Fuller D,et al.Healthrelated quality of life after stereotactic body radiation therapy for localized prostate cancer:results from a multi-institutional consortium of prospective trials〔J〕.Int J Radiat Oncol Biol Phys,2013,87(5):939-945.
[16]Leksell L.An historical vignette.Radiosurgery:Baseline and Trends〔M〕.New York:Raven Press,1992:257-261.
[17]巩汉顺,鞠忠建,徐寿平,等.G4 CyberKnife-全新式立体定向放疗设备及其临床应用〔J〕.医疗卫生装备,2013,34(4):127-129.
[18]Hossain S,Xia P,Huang K,et al.Dose gradient near target-normal structure interface for nonisocentric CyberKnife and isocentric intensity-modulated body radiotherapy for prostate cancer〔J〕.Int J Radiat Oncol Biol Phys,2010,78(1):58-63.
(编辑:吴小红)
Evaluation on Quality and Efficiency of Isocentric and Non-isocentric Stereotactic Treatment Plans From CyberKnife
PIAOJunjie,XUShouping,WANGJinyuan,etal.
GeneralHospitalofPLA,Beijing,100853
【Abstract】ObjectiveTo study the dosimetric charateristics and differences of Isocentric and non-isocentric stereotactic radiotherapy plans are used in CyberKnife system.Methods18 patients were divided into group A and group B.The size of tumors in group A was smaller than 3 cm,and the size of tumors in group B was more than 3 cm.Each group included 9 patients,and both groups were prescribed dose of 40 Gy/5F.The isocentric and non-isocentric techniques were independently used for designing the corresponding treatment plans.The dosimetric parameters,such as conformation index(CI),heterogeneity index (HI),gradient index (GI) and organs at risks (OARs),were used to evaluate the quality of optimization and efficiency of implementation of stereotactic radiotherapy plans for 2 techniques.ResultsThe average treatment time (A:P=0.002;B:P=0.002) and MUs of the machine (A:P<0.001;B:P<0.001) in the isocentric plans were obviously superior to the non-isocentric plans.The mean values of CI (A:P=0.027,B:P=0.007) and GI (A:P<0.001;B:P<0.001) for the isocentric group were slightly smaller than those of the non-isocentric group.And the mean values of HI (A:P=0.029,B:P<0.001)in the isocentric plans was larger than that in the non-isocentric plans.In group A,the normalized average dose (P=0.011) of the isocentric plans was superior to that of the non-isocentric plans.But in group B,the normalized average dose (P=0.012) of the isocentric plans was inferior to that of the non-isocentric plans.ConclusionThe isocentric plans are better than the non-isocentric plans in the treatment time,MUs and GIs.And it is inferior in CIs and HIs.The isocentric plans may be used for designing in small tumors and the non-isocentric plans may be better for large tumors.Of course,more clinical cases should be done for further research.
【Key words】CyberKnife;Isocentric;Non-isocentric;Quality of plans;Dosimetry
基金项目:国家自然科学基金(编号:61171005)
通讯作者:徐寿平
DOI:10.3969/j.issn.1001-5930.2016.05.015
中图分类号:R730.5
文献标识码:A
文章编号:1001-5930(2016)05-0747-05
(收稿日期2016-02-03修回日期 2016-03-15)
